大蒜蔗糖:蔗糖1-果糖基转移酶基因As-1-SST的克隆与表达分析
2021-12-31铁原毓
铁原毓 田 洁,2,*
(1 青海大学农林科学院/青海省蔬菜遗传与生理重点实验室,青海 西宁 810016;2 省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016)
植物中果聚糖作为由蔗糖与一个或多个果糖基连接成的寡糖或多糖,不仅是许多高等植物营养器官中重要的水溶性碳水化合物,还是一种渗透调节剂。果聚糖的解聚能释放可溶性果糖,以调节细胞渗透压,从而提高植物细胞抵御逆境的能力[1]。研究表明,果聚糖作为一种新兴的抗氧化剂,其代谢过程不仅影响植物的生长发育,还能够通过稳定膜系统保护植物免受冰冻或干旱胁迫[2-3]。因此,研究果聚糖合成相关基因,明确基因功能,对揭示植物抗逆机制具有重要意义。
蔗糖:蔗糖1-果糖基转移酶(sucrose: sucrose 1-fructosyltransferase, 1-SST)作为植物果聚糖生物合成过程中的关键酶,通过将一个蔗糖分子上的果糖基转移到另一个蔗糖分子上,催化形成一个果聚三糖(1-蔗果三糖)和一个葡萄糖分子,使果聚糖开始合成[4]。另外,1-SST作为果聚糖合成途径中关键的第一步,对β(2-1)键连接的菊糖型果聚糖新生系列的合成具有重要的催化作用[5]。近年来,关于果聚糖合成相关基因功能的研究已经取得了一定进展,如小麦[6-7]、洋葱[8]、华山新麦草[9]、芦笋[10]、菊芋[11]等植物的1-SST基因已被克隆并进行序列分析。研究表明,1-SST基因在植物合成果聚糖及抵御非生物胁迫中具有重要意义[12-14],如在冬小麦中过表达1-SST基因可以提高转基因植株的耐寒性[15];烟草中过表达莴苣1-SST基因,明显增加了转基因烟草果聚糖的积累,从而提高了植株耐旱性[16]。
大蒜(AlliumsativumL.)又名蒜、胡蒜,百合科葱属二年生草本植物,是世界范围广泛栽培的药食兼用蔬菜[17]。大蒜喜好冷凉环境,但青海高原地区独特的低温、干旱等气候通常使植物遭受环境因素的胁迫伤害,导致大蒜幼苗生长发育受到抑制[18-19]。而果聚糖作为大蒜中干物质含量最高的贮存物质[20],能够在逆境胁迫下通过调节细胞渗透压以提高植物抵御低温、干旱等逆境的抗性,但关于1-SST基因参与大蒜响应逆境过程的研究却鲜有报道。目前大蒜基因组已测序完成[21],但尚未公布1-SST基因相关注释信息,其生物学功能也鲜见相关文献报道。本研究以乐都紫皮大蒜为试验材料,对1-SST基因进行克隆和生物信息学分析,并研究该基因在不同组织、不同胁迫处理下的表达规律,旨在为进一步解析大蒜1-SST基因在高原逆境胁迫下的响应机理奠定理论基础。
1 材料与方法
1.1 材料与试剂
试验材料乐都紫皮大蒜播种于含栽培基质(草炭∶珍珠岩=1∶1)的盆钵中,在青海省农林科学院园艺所植物光照培养箱中进行培养,培养条件:25℃/15℃(14 h/10 h,白天/黑夜),相对湿度70%。培养至大蒜植株长出2~3片叶,且苗高10 cm左右时,选取长势一致、健壮的幼苗,每个处理选取3株。进行如下处理:
(1)对照:培养条件不变,25℃/15℃ (14 h/10 h,白天/黑夜),相对湿度70%,期间正常浇水;
(2)低温胁迫处理:4℃/4℃ (14 h/10 h,白天/黑夜),相对湿度70%,期间正常浇水;
(3)干旱胁迫处理:25℃/15℃ (14 h/10 h,白天/黑夜),参照前期研究[22]通过停止浇水进行人工控水,保持空气相对湿度30%,通过烘干称重法[23]控制土壤相对湿度在45%~55%。
低温和干旱胁迫处理时间分别为0、4、12、24 h和0、1、3、9 d,每个处理3次重复。分别取大蒜根、假茎、叶片和鳞芽各0.5 g,立即用液氮速冻,-80℃保存备用,用于RNA的提取以及cDNA的合成。
总RNA提取试剂 (TRNzol Universal, DP424)、大肠杆菌菌种DH5α,北京天根生化科技有限公司;SanPrep柱式DNA胶回收试剂盒及引物,上海生工生物工程有限公司;质粒载体pMD19-T Vector Cloning Kit,大连TaKaRa公司;高保真酶 (Unique HiQTMPfu DNA Polymerase)、反转录试剂盒 (HonorTMⅡ 1st Strand cDNA Synthesis SuperMix for qPCR)和荧光定量试剂盒 (Unique AptamerTMQpcr SYBR®Green Master Mix),北京诺禾致源科技股份有限公司。
1.2 试验方法
1.2.1 总RNA的提取及cDNA的合成 将经过低温和干旱胁迫处理的不同时期大蒜根、假茎、叶片和鳞芽材料利用TRNzol Universal总RNA提取试剂提取总RNA,通过HonorTMⅡ 1st Strand cDNA Synthesis SuperMix for qPCR试剂盒将大蒜根、假茎、叶片及鳞芽总RNA反转录为cDNA。
1.2.2 大蒜As-1-SST基因的克隆 根据课题组建立的大蒜转录组数据(未公布),检索得到蔗糖:蔗糖1-果糖基转移酶基因序列。设计一对克隆引物As-1-SST-F (5′-A T G T C T T C C G A T G A C C T A G A A T C A C C-3′)和As-1-SST-R (5′-T C A C A T C A T G C T G G T A G C A G G A T-3′),以乐都紫皮大蒜鳞茎cDNA为模板进行扩增。PCR反应体系:2×Unique HiQTM PCR Buffer 25 μL,模板cDNA 1 μL,PfuDNA聚合酶1 μL,上下游引物各2 μL,ddH2O 19 μL。PCR反应程序:94℃预变性5 min;94℃变性30 s,56℃退火30 s,72℃延伸150 s,共35个循环;72℃延伸10 min。PCR产物用1.0%琼脂糖凝胶电泳回收,与pMD19-T载体连接,并转化至大肠杆菌DH5α中,阳性克隆送至北京六合华大基因科技有限公司测序。
1.2.3 序列分析 在NCBI数据库中获得洋葱等其他植物的1-SST序列。利用DNAMAN软件进行氨基酸序列比对和蛋白质疏水性/亲水性分析;采用ExPaSy(https://web.expasy.org/protparam/)软件分析氨基酸基本成分、蛋白质相对分子质量和等电点;采用TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)和Softberry (http://linux1.softber-ry.com/berry.phtml?topic=protcomppl&group=programs&subgroup=proloc)在线软件分别预测跨膜结构域和亚细胞定位。利用SOPMA软件分析蛋白质二级结构 (https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl);通过Phyre 2软件预测蛋白三级结构 (http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index)。使用NCBI中的BLASTP (https://blast.ncbi.nlm.nih.gov/Blast.cgi)在线比对,预测As-1-SST蛋白质保守区。使用MEGA6.0对系统进化树进行测试和编辑,生成报告图形。
1.2.4 实时荧光定量PCR 实时荧光定量PCR(quantitative real-time PCR, qRT-PCR)按照试剂盒操作说明在Roche LightCycler®480 Ⅱ(Roche,美国)上进行。以大蒜CYP基因为内参基因,其引物为CYP-F: 5′-A A G G A C G A G A A C T T C A T C-3′,CYP-R: 5′-T C A A T A T C T C T C A C C A C T T C-3′。根据克隆得到的果聚糖合成酶基因序列设计表达检测引物1-SST-F: 5′-T C G G G T A T G T G G G A A T G T-3′和1-SST-R: 5′-T G G T C G C T C A A A G T A T C G-3′,目的基因与内参基因一起扩增。
1.3 数据分析
以大蒜CYP基因作为定量表达分析的内参基因,采用2-ΔΔCT法计算目的基因的相对表达水平。
2 结果与分析
2.1 大蒜果聚糖合成酶基因As-1-SST的克隆
以乐都紫皮大蒜的鳞茎cDNA为模板,分别以As-1-SST-F和As-1-SST-R作为上游和下游引物,PCR扩增后得到1条长度约为2 000 bp的片段(图1)。测序结果表明,As-1-SST基因编码序列(coding sequences, CDS)全长为1 872 bp,编码623个氨基酸(图2)。将该基因序列上传至GenBank,获得登录号为MW767832。

注:M: DNA分子量标准(2 000 bp)。Note: M: DNA marker(2 000 bp).图1 大蒜As-1-SST基因的RT-PCR扩增Fig.1 As-1-SST gene amplified by RT-PCR from garlic

注:*: 终止密码子。Note: *: Stop codon.图2 大蒜As-1-SST基因的核苷酸序列及其编码的氨基酸序列Fig.2 Nucleotide sequences and predicted amino acid sequences of As-1-SST gene from garlic
2.2 大蒜As-1-SST蛋白的理化性质分析
ExPaSy-ProtParam预测结果表明As-1-SST蛋白分子式为C3168H4790N812O929S20,分子量为69 756.97 Da,理论等电点为5.19,亲水性平均系数为-0.195,是一个稳定性蛋白(不稳定系数为36.64);SignaIP 3.0 Server预测结果显示该蛋白无信号肽,不属于分泌型蛋白;TMHMM预测该蛋白有一个跨膜螺旋区,其位置在39~40(图3);As-1-SST蛋白的亚细胞定位预测结果表明,该蛋白定位于液泡的可能性较大。

图3 大蒜As-1-SST蛋白跨膜结构域的预测Fig.3 Prediction of the transmembrane domain of As-1-SST protein
2.3 大蒜As-1-SST的氨基酸亲水性和疏水性预测
通过DNAMAN 7.0对大蒜As-1-SST基因推导的氨基酸序列进行亲水性/疏水性分析。结果表明(图4),该蛋白的第366位赖氨酸(Lys)亲水性最强;疏水性最强的位点为第41位的亮氨酸(Leu),其次为第32位的亮氨酸(Leu)。
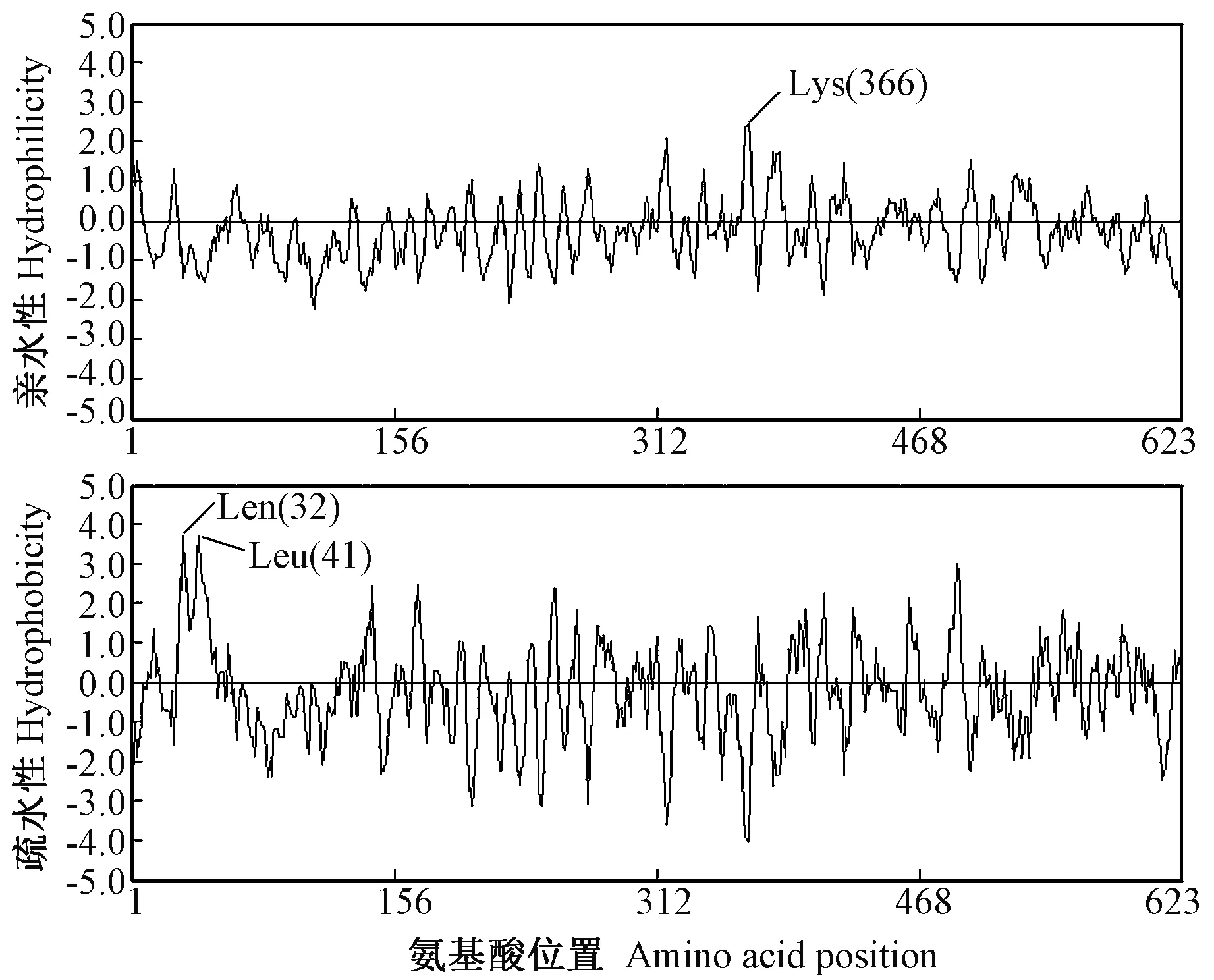
图4 大蒜As-1-SST氨基酸序列的亲水性和疏水性分析Fig.4 Analysis of hydrophilcity and hydrophobicity of amino acid sequences of As-1-SST from garlic
2.4 大蒜As-1-SST的蛋白结构分析
利用SOPMA对As-1-SST蛋白进行蛋白质二级结构预测,结果如图5-A所示。As-1-SST的二级结构主要由α-螺旋(15.27%)、延伸结构(23.63%)、β-转角(4.66%)和无规则卷曲(56.43%)构成。利用Phyre 2软件进行同源建模,并通过PyMOL软件分析蛋白三级结构(图5-B),结果显示As-1-SST蛋白模型构建基于模板c3ugfB(富贵草6-SST/6-SFT),可信度100%,覆盖率85%,且大蒜As-1-SST蛋白的三维结构由6个α-螺旋和34个β-折叠所构成。

图5 As-1-SST蛋白二级、三级结构预测Fig.5 Secondary and tertiary structure prediction of As-1-SST protein
2.5 大蒜As-1-SST的保守域分析与同源性序列比对
在NCBI保守域数据库中将大蒜As-1-SST的氨基酸序列进行BLAST比对(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi),由图6可知,As-1-SST包含2个糖苷水解酶32(GH32)家族的特异位点,且其N-端Pfam携带糖苷水解酶的5个叶片β-螺旋结构域,表明As-1-SST属于糖苷水解酶32(GH32)家族。

图6 大蒜As-1-SST氨基酸序列保守域预测Fig.6 Prediction of conserved domain and amino acid sequences of As-1-SST from garlic
将大蒜As-1-SST氨基酸序列分别与洋葱(AlliumcepaL., CAA06838.1)、太匮龙舌兰(AgavetequilanaL., ABG00265.1)、芦笋(AsparagusofficinalisL., BAM66575.1)、菊芋(HelianthustuberosusL., CAA08812.1)、菊苣(CichoriumintybusL., AAB58909.1)、高粱(SorghumbicolorL. Moench, XP_021314410.1)、洋蓟(Cynaracardunculusvar. scolymus, CAA70855.1)、高羊茅(Loliumarundinaceum, CAC05261.1)、扫帚黍(Dichantheliumoligosanthes, OEL25428.1)、糜子(PanicummiliaceumL., RLN09014.1)、药用蒲公英(Taraxacumofficinale, CAB60153.1)、小米(SetariaitalicaL. Beauv., XP_004951208.1)、黑麦草(LoliumperenneL., AAO86693.1)、大麦(HordeumvulgareL., AFP72238.1)、黑麦(SecalecerealeL., AFK29572.1)、普通小麦(TriticumaestivumL., BAB82470.1)和硬粒小麦(Triticumturgidumsubsp. Durum, ACH73196.1)等植物的1-SST氨基酸序列进行多重比较分析(图7),序列比对的一致性达到64.80%,大蒜As-1-SST氨基酸序列与这17个物种具有较高的同源性,表明不同物种的1-SST氨基酸序列的保守性较高,但在长度和氨基酸组成上存在差异性。结果表明,不同物种1-SST蛋白都具有糖基水解酶32家族的保守结构域,其中大蒜As-1-SST蛋白β-果糖苷酶基序(NDPNG)中N和G存在变异,RDP、EC结构域与其他已报道物种1-SST蛋白结构域完全一致。

注:加红色边框部分表示3个保守区域。Note: The red boxes indicate the three conserved regions.图7 大蒜As-1-SST与其他植物1-SST氨基酸序列的多重比对Fig.7 The alignment of amino acid sequences of 1-SST from garlic and other plant species
对大蒜和其他植物的1-SST氨基酸序列进行理化性质分析。由表1可知,这些植物中的1-SST氨基酸残基数为621~677个,相对分子质量为69.55~73.42 kDa,理论等电点在4.87~5.92之间,酸性氨基酸比例(包括天冬氨酸和谷氨酸)总体略高于碱性氨基酸(包括精氨酸、赖氨酸和组氨酸),脂肪族氨基酸比例相对较高,而芳香族氨基酸比例较低,不同氨基酸序列理化性质存在差异。

表1 不同植物的1-SST氨基酸组成及理化性质分析Table 1 Analysis of amino acid composition and physicochemical properities of 1-SST from different plants
2.6 大蒜As-1-SST的进化树分析
利用MEGA6.0软件中的Neighbor-Joining法将大蒜与其他17种不同植物的1-SST构建同源进化树(图8)。结果显示,大蒜As-1-SST与百合科的洋葱、石蒜科的太匮龙舌兰和天门冬科的芦笋1-SST在进化上属于同一个分支,且与同科同属的洋葱在进化关系上最为接近。而禾本科中普通小麦、硬粒小麦、黑麦、大麦、高羊茅、黑麦草、高粱、扫帚黍、糜子、小米的1-SST属于同一个分支,洋蓟、菊芋、菊苣和药用蒲公英的1-SST同属于菊科分支。

图8 As-1-SST氨基酸序列的系统进化树Fig.8 Phylogenetic tree of As-1-SST amino acid sequence
2.7 大蒜As-1-SST基因在不同组织和逆境条件下的表达分析
通过qRT-PCR对As-1-SST基因在乐都紫皮大蒜不同组织中的表达模式进行分析。结果表明(图9),在正常条件下As-1-SST基因在大蒜根、假茎、叶片和鳞芽中均有表达,其中,在根中表达水平最高,其次是假茎,在鳞芽和叶片中表达水平较低。

注:不同小写字母表示在0.05水平上差异显著。下同。Note: Different lowercase letters indicate significant differences at 0.05 level. The same as following.图9 As-1-SST基因在大蒜不同组织中的相对表达水平Fig.9 Relative expression levels of As-1-SST gene in different garlic tissues
为了进一步研究As-1-SST基因对高原逆境胁迫的响应,对低温和干旱胁迫下的大蒜根、假茎、叶片及鳞芽进行qRT-PCR分析。由图10可知,低温和干旱胁迫均可以显著诱导或抑制As-1-SST基因的表达。

注:A, E:根; B, F:假茎; C, G:叶片; D, H:鳞芽。Note: A, E: Root. B, F: Pseudostem. C, G: Leaf. D, H: Scale bud.图10 低温和干旱胁迫下As-1-SST基因的相对表达水平Fig.10 Relative expression levels of As-1-SST gene under low temperature and drought stress in garlic
低温胁迫处理下,大蒜As-1-SST基因在根中的表达水平与处理0 d相比显著降低,且处理4 h时的表达量仅为对照的19.30%;相反,As-1-SST在假茎、叶片和鳞芽中的表达量均显著高于对照条件下该基因的表达量。低温培养过程中,假茎的As-1-SST表达量随低温处理时间延长呈“升-降-升”的变化趋势,且低温处理4、12和24 h时的表达量显著高于对照,分别为对照的5.75、7.20和1.79倍;叶片中As-1-SST的表达随低温处理时间延长呈先升后降的变化趋势,表达量在低温处理4、12和24 h时均显著高于对照,且在12 h达峰值,为对照的6.77倍;As-1-SST在鳞芽中的表达量在低温处理4 h迅速升高,并保持在较高水平,至24 h时升至最高,为对照的17.37倍。可知低温胁迫显著提高了大蒜假茎、叶片及鳞芽中As-1-SST的表达水平,从低温处理4 h开始,胁迫能够诱导大蒜假茎、叶片、鳞芽进行果聚糖的合成。
与低温处理相比,大蒜各组织As-1-SST对干旱胁迫的响应差别明显。整个处理过程中,除了大蒜鳞芽,其他组织的As-1-SST表达量从未显著高于对照。随着干旱胁迫处理时间的延长,大蒜As-1-SST基因在根和假茎中的表达量呈先升后降的趋势但整体均显著低于0 d。干旱胁迫1 d时,As-1-SST在根中的表达量最低,为对照的16.74%;干旱胁迫3 d时As-1-SST在假茎中的表达量最低,为对照的14.45%。在叶片中,As-1-SST的表达虽然随干旱胁迫处理时间延长呈先升后降的变化趋势,但其表达量除在1 d时与对照无显著差异外,其余均显著低于对照。与以上大蒜组织不同,干旱能够提高鳞芽的As-1-SST表达水平。As-1-SST在鳞芽中的表达随干旱胁迫处理时间延长呈“降-升-降”的变化趋势,干旱胁迫3 d时表达量最高,为对照的5.52倍;而干旱胁迫1和9 d时表达量与对照无显著差异。可知As-1-SST对于干旱胁迫的响应具有明显的组织特异性,干旱处理对大蒜鳞芽中As-1-SST的诱导更加明显。
3 讨论
生长在青藏高原的园艺作物,经常会遭受低温、干旱等多种不利环境因素的胁迫,引起植物组织脱水、细胞膜功能异常、电解质渗漏等现象,逆境最终导致植物减产、局部伤害或全株死亡[24-25]。青海地处青藏高原,气候冷凉,具有大蒜生长及干物质积累的良好气候优势[18]。然而青海春季干旱和冻害的频繁发生,导致浅根作物大蒜的生长发育受到严重影响。果聚糖作为大蒜中干物质含量最高的贮存物质,是大蒜产量形成的关键因素,同时作为一种重要的渗透调节物质,果聚糖的积累有利于增强植物的抗旱及抗寒能力[26-27]。1-SST作为果聚糖代谢途径中的关键酶,在植物果聚糖合成中起重要调控作用。因此,研究1-SST不仅有利于阐明植物果聚糖合成相关基因表达水平及其抵御逆境胁迫的分子机制,也对改善高原逆境下大蒜植株的生存能力具有实际生产意义。
本研究从大蒜中克隆获得一个果聚糖合成关键酶基因As-1-SST,其CDS全长为1 872 bp,编码623个氨基酸,分子量为69.76 kDa,理论等电点为5.19。亚细胞定位预测As-1-SST蛋白定位于液泡的可能性较大,其在细胞中具体位置需进一步试验证明。与其他物种氨基酸序列比对后发现,该基因编码的As-1-SST蛋白N端差异比较明显,但C端保守性较高,说明不同植物的1-SST蛋白功能存在一定的相似性和专一性。本研究结果发现大蒜As-1-SST蛋白的NDPNG发生了2次变异,由GDPNA组成,这与Tita等[28]的研究结果相似,他们发现洋葱的1-SST由ADPNA组成,说明β-果糖苷酶基序(NDPNG)在果糖基转移酶中通常是可变的。保守域分析显示As-1-SST基因所推导的氨基酸属于糖苷水解酶32(GH32)家族。系统进化分析表明,大蒜As-1-SST氨基酸序列与百合科同属的洋葱亲缘关系最近,同源性高达90.69%;其次是石蒜科的龙舌兰和天门冬科的芦笋,说明同起源于百合目的物种之间遗传距离较近。此外,大蒜As-1-SST氨基酸序列与禾本科、菊科等物种的1-SST氨基酸序列处于不同分支,说明不同物种1-SST基因功能可能存在一定的再分化。因此,克隆大蒜As-1-SST基因为后续基因功能验证研究提供了理论基础。
目前,已经从多种植物中克隆了与果聚糖合成相关的1-SST等基因,并发现这些基因在植物抗逆过程中的功能。低温胁迫下,积累了更多果聚糖的黑麦草植物在细胞水平上具有更高的耐冻性[29]。干旱胁迫下,高产果聚糖甜菜株系中1-SST基因表达水平显著上调,渗透调节物质含量上升,显著提高了植株抗旱性[30]。此外,研究表明同一基因在不同组织中的响应逆境的表达量差异显著[31]。张园等[10]研究芦笋(AsparagusofficinalisL.)成株花期不同器官的1-SST基因表达结果发现,在果聚糖积累和合成运输部位,Ao1-SST基因的表达量最高。在龙舌兰植物中,低聚果糖主要积累于叶组织,而高聚果糖主要在茎中积累[32]。上述研究表明,1-SST基因可能在不同植物抗逆过程中均发挥重要作用,然而有关大蒜中1-SST基因响应逆境胁迫的研究鲜见报道。本研究为了进一步研究大蒜各组织以果聚糖为主要贮藏物质的分子机制,对高原逆境胁迫下As-1-SST基因在不同组织的响应情况进行qRT-PCR分析,结果表明在低温胁迫和干旱胁迫下该基因在根、假茎、叶片、鳞芽等不同组织中的响应存在差异;低温胁迫4 h时,能够诱导大蒜除根部以外的大部分组织进行果聚糖的合成,其中该基因在叶片中的表达量是对照的9.17倍,这可能与大蒜在低温胁迫下,叶片最先做出响应有关;然而,干旱胁迫只显著提高了大蒜鳞芽中As-1-SST的基因表达量,在胁迫3 d时达到最高,为对照的5.52倍,说明As-1-SST对于干旱胁迫的响应具有明显的组织特异性。综上可知,As-1-SST基因在大蒜抵御高原逆境胁迫过程中发挥较大作用,本研究为进一步探讨该基因如何具体调控大蒜抗寒和抗旱机制提供了参考。
4 结论
大蒜As-1-SST基因全长1 872 bp,编码623个氨基酸,属于糖苷水解酶32(GH32)家族,与百合科洋葱亲缘关系最接近。qRT-PCR分析发现,As-1-SST在根中表达最高,其次是假茎,在鳞芽和叶片中表达水平较低,具有明显的组织特异性;且在低温胁迫和干旱胁迫下该基因在不同组织中响应存在差异,低温处理4 h时显著提高了假茎、叶、鳞芽中As-1-SST的表达,干旱处理对大蒜鳞芽中As-1-SST的诱导则更加明显,说明As-1-SST基因可能在大蒜抵御低温干旱胁迫的过程中发挥重要的调控作用,但其具体抗逆作用机制还有待进一步研究。
