快速眼动睡眠行为障碍对帕金森病患者认知功能的影响
2021-12-30王振 宁连才 刘宝珠 匡祖颖 陈炳光 曹香燚 温友禄 徐海燕 陈修琼 彭章瑞
王振 宁连才 刘宝珠 匡祖颖 陈炳光 曹香燚 温友禄 徐海燕 陈修琼 彭章瑞
【摘要】目的 分析快速眼動睡眠行为障碍(RBD)与帕金森病(PD)的相关性以明确RBD对PD患者认知功能的影响。方法 回顾性分析123例PD患者的临床资料,根据是否伴有RBD将患者分为PD+RBD组(67例)和PD-RBD组(56例),比较2组各项资料的差异。采用Spearman秩相关分析检验多导睡眠监测睡眠参数与神经心理学相关指标的关系。结果 PD+RBD组病程长于PD-RBD组,总睡眠时间短于PD-RBD组,R期周期性腿动指数高于PD-RBD组(P均 < 0.05)。PD+RBD组蒙特利尔认知评估量表(MoCA)总分低于PD-RBD组,差异主要表现在执行能力、延迟记忆、注意力及抽象能力方面(P均 < 0.05)。PD+RBD组Stroop色词测验完成时间和错误数长/多于PD-RBD组(P均 < 0.05)。PD患者总睡眠时间和睡眠效率与MoCA总分、执行能力及注意力呈正相关,而与Stroop色词测验完成时间及错误数呈负相关(P均 < 0.05)。结论 RBD可能是PD患者认知功能障碍特别是执行功能障碍的重要危险因素。
【关键词】帕金森病;快速眼动睡眠行为障碍;认知功能障碍
Effect of REM sleep behavior disorder on cognitive function in Parkinson’s disease Wang Zhen,
Ning Liancai, Liu Baozhu, Kuang Zuying, Chen Bingguang, Cao Xiangyi,Wen Youlu, Xu Haiyan, Chen
Xiuqiong, Peng Zhangrui. Department of Psychological Behavior, Guangdong 999 Brain Hospital, Guangzhou
510510, China
Corresponding author, Ning Liancai, E-mail: wzc333999@163.com
【Abstract】Objective To analyze the correlation between rapid eye movement sleep disorder (RBD) and Parkinson’s disease (PD), aiming to evaluate the effect of RBD on the cognitive function of PD patients. Methods Clinical data of 123 PD patients were retrospectively analyzed. All patients were divided into the PD+RBD group (n = 67) and PD-RBD group (n = 56). All parameters were statistically compared between two groups. The correlation between sleep parameters of polysomnography and neuropsychological parameters was assessed by Spearman correlation analysis. Results In the PD+RBD group, the course of disease was longer, the total sleep time was shorter and the periodic limb movement index (PLMI) was higher than those in the PD-RBD group (all P < 0.05). The total score of Montreal Cognitive Assessment Scale (MoCA) in the PD+RBD group was lower compared with that in the PD-RBD group, mainly in the domains of executive function, delayed recall, attention and abstraction (all P < 0.05). In the PD+RBD group, the completion time and number of errors in Stroop color-word test were longer and more than those in the PD-RBD group (both P < 0.05). The total sleep time and sleep efficiency of PD patients were positively correlated with the MoCA total score, executive function and attention, whereas negatively correlated with the completion time and number of errors of Stroop color-word test (all P < 0.05). Conclusion RBD is probably a critical risk factor for cognitive dysfunction, especially the executive dysfunction, in PD patients.
【Key words】Parkinson’s disease; Rapid eye movement sleep behavior disorder;
Cognitive dysfunction
帕金森病(PD)是常见的进行性神经退行性疾病之一,与神经系统α-突触核蛋白聚集有关,临床表现主要分为运动和非运动症状。快速眼动睡眠行为障碍(RBD)是PD的非运动症状之一,能够检测出运动前期PD,提示不良预后[1]。有研究表明,RBD与PD患者的认知功能障碍之间存在关联,伴有RBD的PD(PD+RBD)患者比不伴有RBD的PD(PD-RBD)患者认知功能障碍更严重,但也有少量研究表明RBD对某些靶向认知领域没有影响[2-3]。因此,RBD对PD患者认知功能的影响值得进一步研究。本研究组比较了PD+RBD患者與PD-RBD患者客观睡眠参数及神经心理学相关指标的差异,进一步分析了两者的相关性,以明确RBD对PD患者认知功能的影响。
对象与方法
一、研究对象
2017年9月至2019年4月于我院住院的PD患者共123例,记录其年龄、性别、文化程度、病程等相关临床资料。入组标准:①年龄40~80 岁;②符合国际帕金森和运动障碍协会制定的PD最新诊断标准;③文化程度小学及以上,愿意并可配合完成该研究所需的神经心理学测验及多导睡眠监测(PSG)[4]。排除标准:①色盲、文盲、耳聋患者;②由药物、脑炎、乙醇、中毒、感染、脑外伤等引起的脑器质性损伤患者;③有精神行为异常和严重心理问题患者;④多系统萎缩、进行性核上性麻痹、皮质基底节变性等帕金森叠加综合征患者;⑤伴有严重躯体疾病和内科疾病患者。本研究经我院伦理委员会批准(批件号:2020-010-059),所有入组患者均签署知情同意书。
二、RBD评估
RBD诊断符合2014年美国睡眠医学会制定的RBD诊断标准[5]。所有患者住院前期均在睡眠监测室完成夜间PSG监测(尼高利)。监测当夜不予镇静催眠药物,且监测时间超过8 h。客观睡眠参数包括总睡眠时间、睡眠效率、快速眼动(REM)平均密度、睡眠呼吸暂停低通气指数(AHI)、R期颏肌肌电活动指数、R期周期性腿动指数(PLMI)。由一名经验丰富的睡眠技师进行结果判读,根据是否伴有RBD将患者分为PD+RBD组和PD-RBD组。
三、神经心理学评估及其他量表资料
神经心理学评估及其他量表资料由具有专业资质的心理测评医师完成,医师对患者分组与研究目的不知情。使用蒙特利尔认知评估量表(MoCA)及Stroop 色词测验评估患者认知功能,前者≥26分为正常,分值越低,认知障碍越严重。使用汉密尔顿焦虑量表(HAMA)、汉密尔顿抑郁量表(HAMD)评估PD患者焦虑及抑郁情况,得分越高症状越严重。使用Epworth 睡眠量表(ESS)评估患者日间嗜睡情况,得分越高,反映嗜睡程度越重。
四、统计学处理
采用SPSS 22.0分析数据。采用表示正态分布计量资料,非正态分布计量资料采用M(P25,P75)表示,由于病程在2组之间存在差异,因此将病程作为协变量,符合正态分布的连续变量组间比较采用协方差分析,不符合正态分布的连续变量,先使用Ln函数使数据转换呈正态分布,再使用协方差分析。计数资料采用例数(%)表示,组间比较采用χ2检验。采用Spearman秩相关分析检验PSG睡眠参数与神经心理学相关指标的关系。P < 0.05为差异有统计学意义。
结 果
一、一般资料
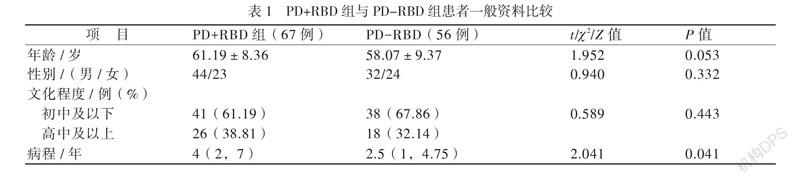
123例PD患者中PD+RBD组67例(54.47%),PD-RBD组56例(45.53%),2组年龄、性别、文化程度均无差异(P均 > 0.05),PD+RBD组病程长于PD-RBD组(P < 0.05),见表1。
二、PSG睡眠参数
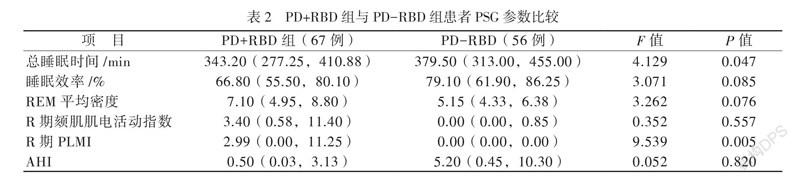
PD+RBD组总睡眠时间短于PD-RBD组,而R期PLMI高于PD-RBD组(P均 < 0.05),见表2。
三、神经心理学相关指标
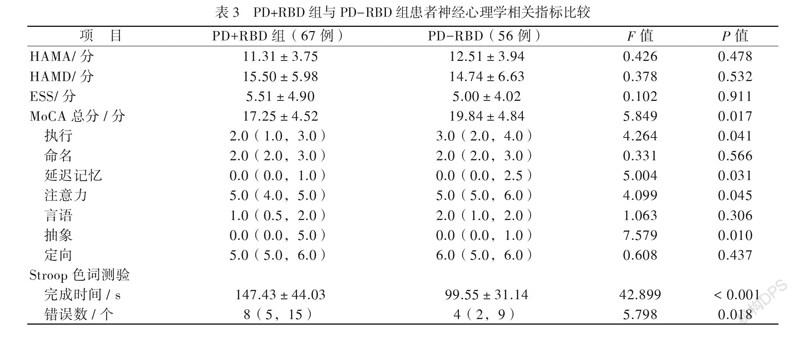
2组ESS、HAMD及HAMA得分均无差异(P均 > 0.05)。认知功能参数方面,PD+RBD组MoCA总分低于PD-RBD组,差异主要表现在执行能力、延迟记忆、注意力及抽象能力方面(P均 < 0.05);Stroop 色词测验完成时间和错误数长/多于PD-RBD组(P均 < 0.05),见表3。
四、PSG相关参数与认知功能相关性分析
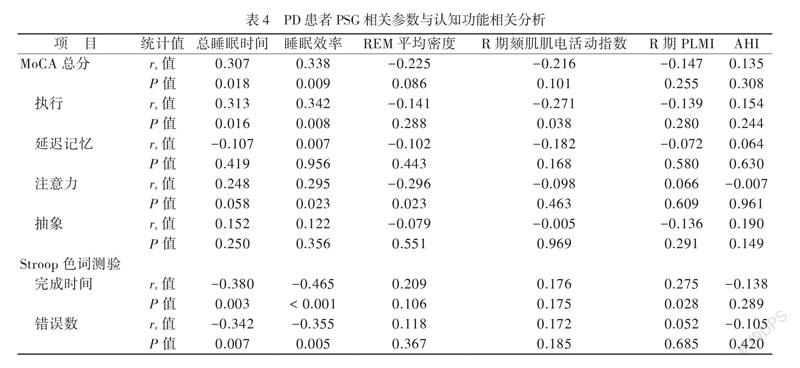
神经心理学评估显示PD+RBD组患者与PD-RBD组患者的认知功能有差异,主要表现在执行能力、延迟记忆、注意力、抽象能力以及Stroop色词测验上。因此进一步分析了PD患者PSG相关参数与认知功能的相关性。结果显示,PD患者总睡眠时间和睡眠效率与MoCA总分、执行能力及注意力呈正相关,而与Stroop色词测验完成时间及错误数呈负相关(P均 < 0.05)。PD患者记忆能力与总睡眠时间和睡眠效率无相关性(P均 > 0.05),PD患者注意力与REM平均密度呈负相关,PD患者Stroop色词测验完成时间与R期PLMI呈正相关(P均 < 0.05),见表4。
讨 论
RBD是一种由REM引起的睡眠障碍,普通人群的患病率约为0.5%~1%,但在PD人群中高达50%。既往研究表明,RBD与PD患者的认知功能障碍存在关联[2-3]。有鉴于此,本研究组根据PSG结果将PD患者分为PD+RBD组和PD-RBD组,分析2组患者客观睡眠参数及神经心理学相关指标的差异,以及RBD对PD患者认知功能的影响。
本研究显示PD+RBD组总睡眠时间短于PD-RBD组,提示PD+RBD组存在客观睡眠障碍,与既往研究一致[6-7]。此外,PD+RBD组R期PLMI高于PD-RBD组,提示PD+RBD患者睡眠障碍可能与频繁的周期性腿动有关[8]。
有研究显示特发性RBD患者存在显著的认知功能障碍,主要表现在执行能力、情景性语言记忆、视空间功能和注意力等领域[9-10]。认知功能障碍也是PD患者非运动症状之一,近期有研究者提出RBD为PD患者发生认知功能障碍的独立危险因素[11]。本研究显示,PD+RBD组MoCA总分低于PD-RBD组,而Stroop色词测验完成时间和错误数长/多于PD-RBD组,提示PD+RBD组认知功能差于PD-RBD组,即RBD影响PD患者认知功能,差异主要表现在执行能力、延迟记忆、注意力及抽象能力方面,与特发性RBD患者认知功能障碍领域一致。此外,有研究表明,PD患者认知功能障碍可能与病程、年龄、文化程度及症状级别等因素有关[12]。本研究中PD+RBD组和PD-RBD组在病程方面存在差异,协方差分析发现病程与分组存在显著交互作用,这说明伴RBD症状的PD患者在年龄相当的情況下,病程潜伏期更长,认知功能表现更差。
张金茹等[13]发现PD患者认知功能与其RBD症状的严重程度有密切关系。为进一步明确RBD对PD患者认知功能的影响,我们分析了PD患者PSG相关参数与认知功能的相关性,结果显示,夜间总睡眠时间及睡眠效率越高,患者认知功能越好,提示充足的睡眠是PD患者认知功能的保护性因素。王苹莉等[14]的研究提示慢性失眠患者存在空间工作记忆和物体工作记忆减退,可能与慢波睡眠各期占睡眠总时间比例的改变和快速眼球运动期占睡眠总时间比例减少有关,本研究显示PD患者延迟记忆与PSG相关参数无相关性,而PD+RBD组延迟记忆得分低于PD-RBD组,前者总睡眠时间低于后者,R期PLMI高于后者,与前人研究结论一致。目前认为,REM在巩固记忆、促进编码、建立计划及稳定认知方面发挥重要作用,REM睡眠的中断可直接干扰记忆功能[15]。
PD伴RBD患者认知功能受损的病理生理机制尚未明确。可能机制包括:神经递质改变、异常脑代谢、皮层活动减慢、基因突变和神经炎症,其中中枢胆碱能递质缺陷受最大关注[16]。含有丰富胆碱能神经元的基底前脑通过与间脑、边缘系统和皮质的广泛联系在认知中发挥重要作用[17]。Postuma等(2019年)认为脚桥核是RBD形成的重要核团,能够调节快速眼动睡眠和肌肉张力,基底前脑与脑干核相互作用,因此,基底前脑胆碱能障碍可能是RBD与PD患者认知功能障碍关系的病理基础[18-19]。
综上所述,本研究结果提示RBD的临床严重程度与执行能力、注意力、记忆力及抽象能力有关,且总睡眠时间减少、R期PLMI病理性增高,从而影响PD患者认知功能,RBD可能是PD患者认知功能障碍特别是执行功能障碍的一个重要危险因素。
参 考 文 献
[1] 于雯雯,李振光,张玺,张金彪,孙海荣. 帕金森病运动前期诊断的临床标记物. 中国神经免疫学和神经病学杂志,2018,25(1):67-71.
[2] Lerche S, Machetanz G, Roeben B, Wurster I, Zimmermann M, von Thaler A K, Liepelt-Scarfone I, Eschweiler G W, Fallgatter A, Metzger F, Maetzler W, Berg D, Brockmann K. Deterioration of executive dysfunction in elderly with REM sleep behavior disorder (RBD). Neurobiol Agin,2018,70:242-246.
[3] Assogna F, Liguori C, Cravello L, Macchiusi L, Belli C, Placidi F, Pierantozzi M, Stefani A, Mercuri B, Izzi F, Caltagirone C, Mercuri N B, Pontieri F E, Spalletta G, Pellicano C. Cognitive and neuropsychiatric profiles in idiopathic rapid eye movement sleep behavior disorder and parkinson’s disease. J Pers Med,2021, 11(1), 51.
[4] 张月琪,王刚. 国际运动障碍疾病协会帕金森病临床诊断新标准(2015)介绍. 诊断学理论与实践,2016,15(2):122-123.
[5] Sateia M J. International classification of sleep disorders-third edition: highlights and modifications. Chest,2014,146 (5):1387-1394.
[6] Boeve B F. REM sleep behavior disorder: updated review of the core features, the REM sleep behavior disorder-neurodegenerative disease association, evolving concepts, controversies, and future directions. Ann N Y Acad Sci,2010,1184:15-54.
[7] Fernández-Arcos A, Iranzo A, Serradell M, Gaig C, Santamaria J. The clinical phenotype of idiopathic rapid eye movement sleep behavior disorder at presentation: a study in 203 consecutive patients. Sleep,2016,39(1):121-132.
[8] 张轩, 王金莹, 叶静怡, 万亚会, 崔林阳, 朱晓冬, 张美云, 程焱, 薛蓉. 快速眼球运动睡眠行为障碍患者的神经心理学评价及其与客观睡眠的相关性. 中风与神经疾病杂志, 2019, 36(5): 406-411.
[9] Massicotte-Marquez J, Décary A, Gagnon J F, Vendette M, Mathieu A, Postuma R B, Carrier J, Montplaisir J. Executive dysfunction and memory impairment in idiopathic REM sleep behavior disorder. Neurology, 2008, 70(15): 1250-1257.
[10] Terzaghi M, Sinforiani E, Zucchella C, Zambrelli E, Pasotti C, Rustioni V, Manni R. Cognitive performance in REM sleep behaviour disorder: a possible early marker of neurodegenerative disease? Sleep Med, 2008, 9(4): 343-351 .
[11] Luppi P H, Clément O, Sapin E, Gervasoni D, Peyron C, Léger L, Salvert D, Fort P. The neuronal network responsible for paradoxical sleep and its dysfunctions causing narcolepsy and rapid eye movement (REM) behavior disorder. Sleep Med Rev, 2011,15(3): 153-163.
[12] Uc E Y, McDermott M P, Marder K S, Anderson S W, Litvan I, Como P G, Auinger P, Chou K L, Growdon J C; Parkinson Study Group DATATOP Investigators. Incidence of and risk factors for cognitive impairment in an early Parkinson disease clinical trial cohort. Neurology,2009,73(18):1469-1477.
[13] 张金茹, 张惠钧, 马丽婧, 王益, 毛成洁, 李洁, 沈贇, 刘春风. 快速眼动睡眠期行为障碍与帕金森患者不同认知领域功能障碍的相关性分析. 中华医学会第十八次全国神经病学学术会议论文集, 2015:566-567.
[14] 王苹莉, 潘才钰, 王永盛, 赵元琛. 慢性失眠患者睡眠结构与记忆受损特点的研究. 新医学,2019,50(9):704-707.
[15] Yarnall A, Rochester L, Burn D J. The interplay of cholinergic function, attention, and falls in Parkinson’s disease. Movement Disorders, 2011, 26(14):2496-2503.
[16] Lin Y Q, Chen S D. RBD: a red flag for cognitive impairment in Parkinson’s disease? Sleep Med, 2018, 44:38-44.
[17] Kotagal V, Albin R L, Müller M L, Koeppe R A, Chervin R D, Frey K A, Bohnen N I. Symptoms of rapid eye movement sleep behavior disorder are associated with cholinergic denervation in Parkinson disease. Ann Neurol,2012,71(4):560-568.
[18] Mantovani S, Smith S S, Gordon R, O’Sullivan J D. An overview of sleep and circadian dysfunction in Parkinson’s disease. J Sleep Res, 2018,27(3):e12673.
[19] 吳婷,刘琳,黎昭,林贤.转突变型A53Tα-突触核蛋白基因的帕金森模型小鼠中脑的全基因组甲基化测序分析.中山大学学报(医学版),2020,41(1):53-59.
(收稿日期:2021-06-30)
(本文编辑:洪悦民)
