饲粮添加硝酸钙对湖羊瘤胃动态发酵和抗氧化能力的影响
2021-12-30刘绘汇范慧玉
孙 康, 刘绘汇, 范慧玉, 刘 婷, 郑 琛
(甘肃农业大学动物科学技术学院,甘肃兰州 730070)
硝酸盐不仅可以用作非蛋白氮的来源, 还可以改变反刍动物胃肠道内环境和血清指标。 反刍动物瘤胃内环境的稳态对其自身健康至关重要。动物在采食含有硝酸盐的饲粮后, 硝酸盐在瘤胃内通过微生物的作用,先被还原成亚硝酸盐,最终生成氨态氮(Lewis 等,1951)。在这个过程中,硝酸盐还原需要消耗氢, 由于丙酸合成中也需要氢的参与, 因此氢的减少会抑制丙酸产生而促进乙酸生成。除此之外,氢的减少也有助于缓解对纤维降解菌的抑制作用(Zijderveld 等,2010)。 硝酸盐代谢的中间产物亚硝酸盐具有较强的氧化能力,可降低机体内抗氧化因子和机体抗氧化能力(Kohn,2002)。 但目前有关硝酸盐的研究大都集中在甲烷减排方面, 对湖羊瘤胃动态发酵和血清抗氧化指标影响的研究较少。因此,本试验将在饲粮中添加硝酸钙, 研究其对湖羊瘤胃动态发酵和血清抗氧化能力的影响。
1 材料与方法
1.1 试验设计与动物 试验采用交叉试验设计。选择安装有永久瘤胃瘘管湖羊6 只, 随机分为2组,每组3 只,每只为一个重复。对照组饲喂基础饲粮,试验组饲喂添加3%硝酸钙的饲粮。试验分2 期进行,每期15 d,其中过渡期10 d,正试期5 d。
1.2 试验饲粮 参照中华人民共和国农业行业标准肉羊饲养标准(NY/T816-2004)进行饲粮配制, 所用饲粮均由甘肃润牧生物工程有限责任公司生产加工。饲粮组成及营养水平见表1。试羊采用单笼饲养,试验开始后自由采食、自由饮水。

表1 饲粮组成及营养水平(干物质基础)
1.3 样品采集
1.3.1 瘤胃液采集 正试期第4、5 天采集食后0、1、3、5 h 和 7 h 的瘤胃液。将试羊瘤胃瘘管塞去除后用烧杯接取瘤胃食糜,然后用4 层纱布过滤,过滤后的瘤胃液装入15 mL 离心管, 随后立即在-80 ℃进行保存,用于挥发性脂肪酸(VFA)和氨态氮的测定。
1.3.2 动态pH 数据采集 参考胡红莲等(2009)的方法测定瘤胃动态pH。 在每期试验正试期前2天, 采用动态pH 监测系统对试羊瘤胃pH 进行24 h 动态监测。在每次进行动态pH 连续监测时,用pH 4.00 和pH 6.86 标准液对电极进行校准,并记录校准值。待电极校准完毕后,将电极通过瘤胃瘘管插入瘤胃内,然后塞好塞子。电极通过导线与瘘管外的pH 变送器信号输入端相连,pH 变送器的信号输出端与记录仪的信号输入端相连接。
本试验用3 个通道进行实时显示, 每期6 只试羊的pH 动态变化分2 d 完成, 并设定每隔 1 min 记录1 次pH。然后将所记录的数据通过动态pH 监测系统专用U 盘上传到电脑, 并运用DTM数据管理软件将U 盘里的数据调出, 并存至Excel 文档内进行分析处理。
1.3.3 血清样品采集 正试期后2 天, 试羊颈静脉采血,使用非抗凝管采集食后 0、1、3、5 h 和 7 h的血液并制备血清。 血清转入2 mL 离心管后置-80 ℃冰箱保存,用于抗氧化指标测定。
1.4 指标测定及方法
1.4.1 瘤胃液中VFA 的测定 瘤胃液5000 r/min离心10 min 后取1 mL 上清液置于1.5 mL 离心管中,加入0.2 mL 25%的偏磷酸溶液(含内标物2-乙基丁酸), 充分混匀后置于冰水浴30 min 以上,然后再10000 r/min 离心10 min,取出离心管后,用移液枪移取上清液于气相小瓶后上机测定。
使用安捷伦 6890N 气相色谱仪和HP19091N-213 色谱柱测定VFA。 色谱分析条件为:进样口温度为220 ℃,分流比为40:1,氮气流量为2.0 mL/min。检测器温度为250 ℃,空气流量为450 mL/min,氮气流量为45 mL/min,氢气流量为 40 mL/min。 程序升温:初温为 120 ℃ 3 min,后以 10 ℃/min 升温至 180 ℃,并保持 1 min。进样量为 0.6 μL。
1.4.2 瘤胃液中氨态氮的测定 参考王世琴(2013)的方法测定瘤胃液中氨态氮含量。 瘤胃液5000 r/min 离心10 min 后移取1 mL 上清液转入10 mL 离心管中, 加入4 mL 0.2 moL 盐酸后摇匀。然后吸取混合液0.2 mL,置于5 mL 离心管内,依次加入A 液 (含有0.08 g 亚硝基铁氰化钠的100 mL 14%水杨酸钠溶液)1 mL 和B 液(含有2 mL 次氯酸钠溶液的100 mL 0.3 moL NaOH 溶液)1 mL,充分摇匀, 静置 10 min。 然后移取 200 μL 混匀液置于 96孔板中, 使用酶标仪测定波长700 nm 下的吸光度值。根据氨态氮标准曲线计算瘤胃液中氨态氮含量。
1.4.3 瘤胃中动态pH 的测定 将每天每只羊所采集的pH 数据进行汇总,计算平均值、最大值、最小值,以及pH 低于 5.60 和5.80 的持续时间及曲线面积。曲线面积是指pH 阈值与低于pH 阈值偏差绝对值累积之和与时间间隔的乘积, 单位为pH·min/d。 并计算每小时平均pH,用于绘制24 h动态pH 变化图。
1.4.4 血清抗氧化指标的测定 使用酶联免疫吸附试验(ELISA)试剂盒(南京建成生物工程研究所) 测定血清中的谷胱甘肽过氧化物酶 (GSHPx)、丙二醛(MDA)、总抗氧化能力(T-AOC)和总超氧化物歧化酶(T-SOD)活力。
1.5 数据处理 所测数据用Excel 整理, 并使用SPSS 22.0 软件对数据进行一般线性混合模型单变量方差分析, 以P ≤0.05 表示组间差异显著,以0.05< P <0.1 表示组间有差异显著趋势。
2 结果与分析
2.1 饲粮添加硝酸钙对湖羊瘤胃液VFA 和氨态氮浓度的影响 由表2 可以看出, 饲粮添加硝酸钙组湖羊瘤胃液中乙酸/总酸的比例和氨态氮的浓度显著升高(P <0.05);丙酸/总酸的比例显著降低(P <0.05)。湖羊食后1 h 瘤胃液总酸的含量显著高于 0 h 和 7 h(P < 0.05);食后丙酸/总酸的比例显著高于0 h, 且处理与时间产生显著的交互作用(P < 0.05);食后乙酸/丙酸比显著低于 0 h,且处理与时间产生显著的交互作用(P <0.05)。处理与时间对湖羊瘤胃液氨态氮浓度产生了显著的交互作用(P <0.05)。 此外,硝酸钙有升高湖羊瘤胃液乙酸/丙酸比的趋势(P =0.068)。
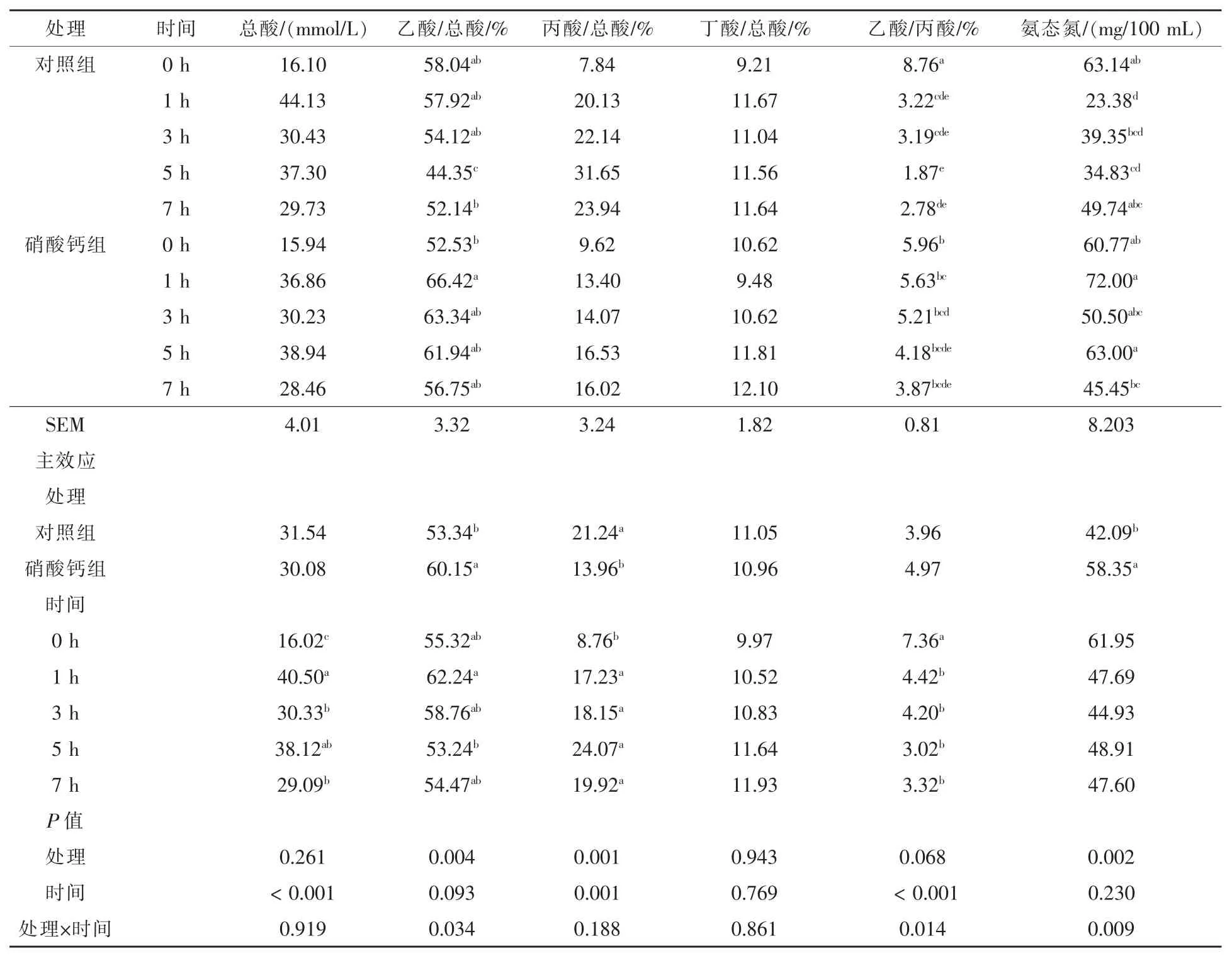
表2 饲粮添加硝酸钙对湖羊瘤胃液VFA 和氨态氮浓度的影响
2.2 饲粮添加硝酸钙对湖羊瘤胃动态pH 的影响 由表3 可以看出, 饲粮添加硝酸钙组湖羊瘤胃动态 pH 的最小值显著降低(P <0.05),但其他动态 pH 两组间无显著差异(P > 0.05)。 从表 3 和图1 可以看出, 硝酸钙使湖羊瘤胃pH 维持在较高水平且pH 低于5.60 和5.80 的时间短于对照组湖羊(P > 0.05)。
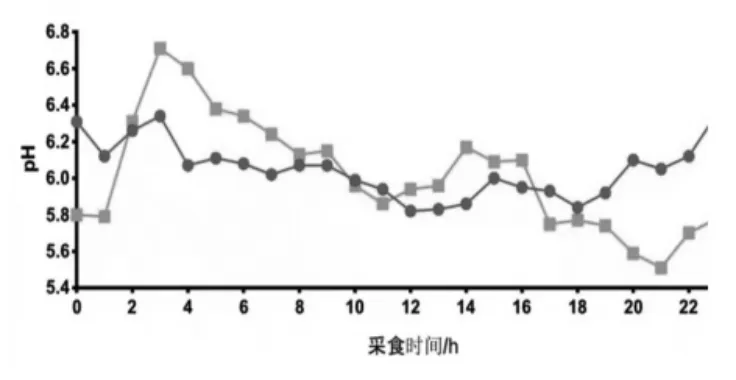
图1 湖羊瘤胃pH 24 h 动态变化

表3 饲粮添加硝酸钙对湖羊瘤胃动态pH 的影响
2.3 饲粮添加硝酸钙对湖羊血清抗氧化能力的影响 由表4 可以看出, 饲粮添加硝酸钙组湖羊血清 T-AOC 活力显著降低(P =0.05);与 0 h 相比,食后(1、3、5、7 h)血清 GSH-Px 活力显著降低(P <0.05),且随采食时间呈现出先降低后升高的趋势,食后5 h GSH-Px 含量降至最低。 处理与时间对湖羊血清抗氧化能力没有产生显著的交互作用(P > 0.05)。
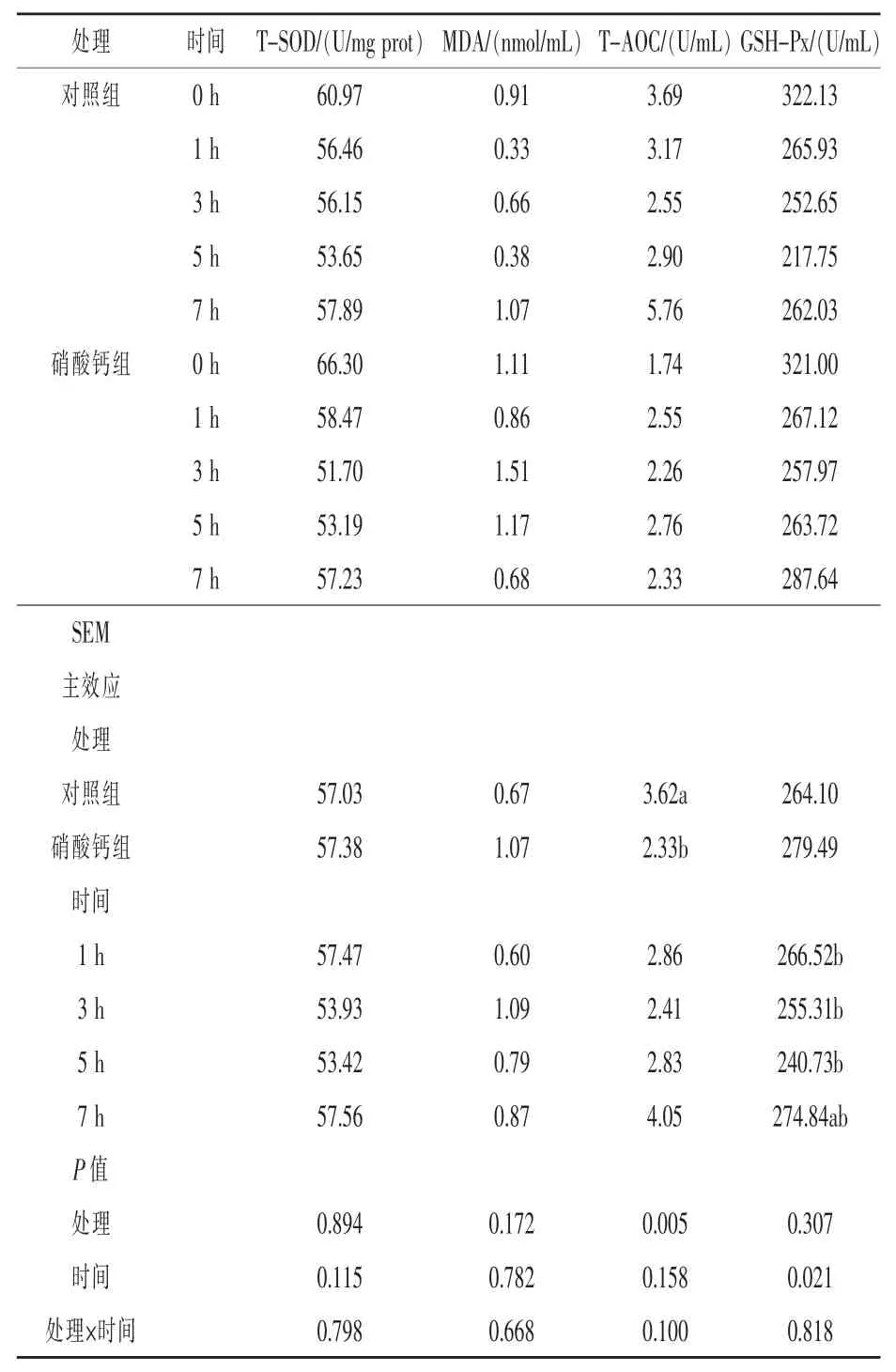
表4 饲粮添加硝酸钙对湖羊血清抗氧化能力的影响
3 讨论
3.1 饲粮添加硝酸钙对湖羊瘤胃液VFA 和氨态氮浓度的影响 反刍动物瘤胃发酵是否正常决定了动物自身的健康生长发育状况, 瘤胃发酵过程中产生的VFA 和氨态氮等参数可以反映反刍动物瘤胃发酵状况。 饲粮中的碳水化合物在反刍动物瘤胃内经过发酵后产生VFA (谭建华等,2012),通过分析VFA 的组成和比例,可以了解瘤胃的发酵模式和发酵程度(郭艳霞等,2020)。林淼等(2014)研究发现,在湖羊饲粮中添加硝酸钾可以显著提高瘤胃氨态氮、 总微生物蛋白和乙酸的含量,降低丁酸含量,使发酵趋于乙酸发酵模式。Sharifi 等(2019)也报道,饲粮添加硝酸盐可以降低绵羊瘤胃液中 VFA 的含量。 在 Asanuma 等(2015)的试验中,山羊饲粮添加硝酸盐显著降低了瘤胃液总VFA,显著提高了乙酸/丙酸比及氨态氮和乳酸的浓度。 Meller 等(2019)也发现,饲喂NO3-的奶牛瘤胃乙酸/丙酸比更高。 Villar 等(2020)研究发现,肉牛饲粮中添加硝酸盐以后对瘤胃液总VFA 无影响,但增加了乙酸的比例。 赵丽萍(2015)的研究也发现,肉牛饲粮添加硝酸盐可提高瘤胃液乙酸比例。 Mamvura 等(2014)的体外试验表明, 发酵底物加入硝酸盐可降低发酵液中总VFA, 但可提高发酵液中氨态氮的浓度。Zhou 等(2011)研究也表明,硝酸钠可升高48 h瘤胃体外发酵液中乙酸/丙酸比,使发酵模式趋向于乙酸型。这些研究结果都与本试验中,硝酸钙可显著升高湖羊食后1、3 h 和5 h 瘤胃液中乙酸/总酸比例,显著提高食后5 h 乙酸/丙酸比的结果一致。 这是由于硝酸盐在瘤胃内经亚硝酸盐生成氨态氮的过程中(Lewis 等,1951),可通过消耗氢而抑制丙酸生成, 并有助于纤维降解菌的增殖(Zijderveld,2010)。 但 Zhang 等(2018)研究发现,用尿素+硝酸盐预处理水稻和小麦秸秆可以提高丙酸的含量;且Ellis 等(2008)认为,硝酸盐可以降低氢分压, 促进还原辅因子 (NADH、NADPH 和FADH)的进一步氧化,进而提高VFA 产量。 然而大部分试验结果表明,硝酸盐对奶牛(van Wyngaard 等,2019;Olijhoek 等,2016)和绵羊(Adejoro等,2020)瘤胃液 VFA 无显著影响。 因此,硝酸钙对湖羊瘤胃发酵的调控作用及其机理还有待进一步研究。
在本试验中, 硝酸钙组湖羊食后 1、3、5 h 瘤胃液中氨态氮浓度显著提高。 硝酸盐作为一类含氮类化合物, 可给反刍动物瘤胃微生物的发酵提供氮源(Wang 等,2018),从而提高瘤胃液氨态氮浓度。林淼等(2014)研究发现,湖羊饲粮中添加硝酸钾可显著提高氨态氮浓度。 Asanuma 等(2015)报道, 山羊饲粮添加硝酸盐可以提高瘤胃液中氨态氮浓度。 刘丽慧等(2017)利用萨能奶山羊瘤胃液进行体外发酵, 也发现硝酸盐提高了发酵液中氨态氮的浓度。 这些试验结果与本试验研究结果一致。但Capelari 等(2016)研究发现,硝酸盐可以降低半连续瘤胃发酵系统中氨态氮的浓度;且Zhao 等(2015)发现,饲粮添加硝酸盐不会影响肉牛瘤胃液中氨态氮的浓度。
3.2 饲粮添加硝酸钙对湖羊瘤胃动态pH 的影响 在本试验中, 饲粮添加硝酸钙组湖羊瘤胃动态pH 的最小值显著降低, 但平均pH 有所提升。瘤胃pH 是反刍动物瘤胃发酵的一项重要指标,其是否处于正常范围内, 会直接影响瘤胃发酵的效果(Nocek 等,2002)。 反刍动物瘤胃正常 pH 一般在5.5 ~ 7.5, 超过这个范围就会对动物产生不良影响。 张艺邀(2018)认为,瘤胃 pH 过低会影响瘤胃微生物菌群,刺激瘤胃黏膜和降低瘤胃蠕动。杨淑青等(2013)也认为,瘤胃pH 过低不利于纤维分解菌的生长,影响其对养分的消化吸收,并且瘤胃长期处于较低pH 环境中会破坏其上皮细胞。 但研究发现, 硝酸盐具有调节反刍动物瘤胃pH 的作用 (Henry 等,2020; 董在坤等,2019;Granja-Salcedo 等,2019;陈志远等,2016;Lee 等,2015)。 硝酸盐在反刍动物瘤胃内水解后,硝酸盐还原菌在硝酸盐还原酶的作用下利用H+将NO3-还原为 NO2-(Iwamoto 等,2002),NO2-随即在微生物的作用下生成NH4+。 在本试验中,对照组湖羊食后瘤胃pH 先降低后上升, 而硝酸钙组湖羊食后瘤胃pH 先升高后降低, 也与NO3-在瘤胃内的氧化还原降解机制一致。反刍动物瘤胃pH 5.2 通常被作为急性酸中毒的临界点,将5.6 和5.8 作为亚急性酸中毒的临界点 (Penner 等,2007;Yang等,2006)。 本试验中,硝酸钙对湖羊瘤胃液 pH 低于5.80 和5.60 的维持时间和曲线面积有降低作用,说明硝酸钙具有缓解湖羊酸中毒的作用。
3.3 饲粮添加硝酸钙对湖羊血清抗氧化能力的影响 动物体内含有大量的超氧阴离子自由基,在正常情况下处于动态平衡状态。 但在动物生长发育过程中, 可由外部和自身等原因引发氧化应激, 动物在代谢过程中会在体内产生大量超氧阴离子自由基, 其超强的氧化性降低机体抗氧化能力 (Yin 等,2013), 从而导致动物机体出现疾病(Sies 等,1997)。 本试验研究结果表明,硝酸钙组湖羊食后5 h 血清MDA 含量提高,食后7 h 血清T-AOC 活力降低,表明饲粮中的硝酸钙不利于湖羊维持正常的抗氧化能力, 可能与3%的添加剂量有关。 赵丽萍(2015)研究发现,肉牛饲粮添加2%硝酸盐不会影响机体抗氧化能力。但有关硝酸盐较高添加水平对动物机体抗氧化能力影响的报道较少,还需要进一步研究。 此外,硝酸盐在反刍动物瘤胃代谢过程中产生的亚硝酸盐具有很强的氧化能力,能够攻击动物机体氧化防御系统,使动物发生中毒现象 (Kohn 等,2002)。 Al-Qudah(2010)的研究也证实了这点,奶牛饲粮添加硝酸盐以后使奶牛出现慢性中毒的现象, 并且血清中抗氧化酶的活性降低。研究还发现,饲粮中添加硝酸盐可以降低血清中抗氧化物质的含量和增加活性氧含量(Xian 等,2012;Tabacova 等,1998)。
4 小结
硝酸钙可以改变湖羊瘤胃发酵类型, 提高瘤胃液乙酸/总酸比例和氨态氮的含量,且处理与时间表现出显著的交互作用; 硝酸钙可使湖羊瘤胃液pH 维持在较高水平;但饲粮中添加3%硝酸钙能降低湖羊的抗氧化能力。
