连术消渴颗粒对2型糖尿病模型大鼠肠道菌群、肠黏膜屏障功能及水通道蛋白的影响
2021-12-14李慧敏李鹏辉吉兰洁
李慧敏,李鹏辉,吉兰洁,闫 镛
(1.河南中医药大学,河南 郑州 450046;2.开封市中医院,河南 开封 475000)
2型糖尿病(Type 2 diabetes,T2DM)是常见的内分泌疾病,预计2045年,全球T2DM患者将达到6.29亿[1]。T2DM发病率高,发病机制复杂,易引起肠道菌群变化及肠道相关并发症,肠道菌群的变化亦可影响T2DM的发生和发展[2-3]。糖尿病患者易并发腹泻,其机制可能与外周血高糖引发肠黏膜屏障损伤及水通道蛋白表达异常有关[4-5]。连术消渴颗粒是闫镛教授治疗T2DM的经验方,临床证实其治疗T2DM疗效较好[6]。本研究拟通过腹腔注射链脲佐菌素(Streptozotocin,STZ)制备T2DM大鼠模型,观察连术消渴颗粒对T2DM模型大鼠糖代谢、肠道菌群、肠黏膜屏障功能及结肠水通道蛋白的影响,从多重角度初步阐释连术消渴颗粒干预T2DM的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 实验动物:60只健康SPF级SD雄性大鼠购自济南朋悦实验动物繁育有限公司,体重200~220 g,动物合格证号1107261911004137、生产许可证号SCXK(鲁)20190003、实验室使用许可证编号SYXK(豫)2015-0005,于22 ℃、50%湿度条件下饲养。
1.1.2 实验药物:连术消渴颗粒由黄连、泽泻、山楂各30 g,苍术、枳实、制半夏、陈皮各10 g,升麻、干姜、甘草各6 g,茯苓20 g,水蛭3 g,大枣3枚组成,由广东一方制药有限公司制成颗粒剂。
1.1.3 实验试剂与仪器:STZ(批号LF20191009,北京六一生物科技公司);D-乳酸(D-lactic acid,D-LA)、连蛋白(Zonulin)ELISA 试剂盒(批号WHB647235、WHB647305,美国Cloud-Clone Corp公司);乳脂球表皮生长因子-8(Milk fat globule EGF factor-8,MFG-E8)(批号ab235638,英国Abcam科技公司);水通道蛋白4(Aquaporin 4,AQP4)、水通道蛋白8(Aquaporin 8,AQP8)、甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-phosphate dehydrogenase,Gapdh)单克隆抗体(批号ab125049、ab133667,英国Abcam公司);ChemDoc XRS型化学发光成像仪(美国Bio-rad公司)、703940型半干转膜仪(美国Bio-rad公司)、1703539型垂直电泳仪(美国Bio-rad公司)。
1.2 实验方法
1.2.1 建模、分组及给药:60只SD大鼠随机分为空白组、模型组、连术消渴颗粒低剂量组、连术消渴颗粒中剂量组、连术消渴颗粒高剂量组及二甲双胍组,每组各10只。空白组正常喂养,其余各组大鼠喂养高脂高糖饲料,大鼠饲养30 d后禁食12 h,腹腔注射STZ,剂量为45 mg/kg,空白组大鼠腹腔注射等量柠檬酸盐缓冲液。1周后,大鼠尾部少量取血,若空腹血糖(Fasting blood glucose,FBG)≥11.1 mmol/L,随机血糖≥16.7 mmol/L提示2型糖尿病造模成功[6]。模型组、连术消渴颗粒低剂量组、连术消渴颗粒中剂量组、连术消渴颗粒高剂量组及二甲双胍组最终分别成模8、8、9、8、9只。连术消渴颗粒低剂量组、连术消渴颗粒中剂量组、连术消渴颗粒高剂量组及二甲双胍组大鼠分别给予连术消渴颗粒2.92、5.84、11.68 g/(kg·d)及盐酸二甲双胍片0.17 g/(kg·d)灌胃,空白组及模型组给予相同剂量的纯净水灌胃,各组大鼠均治疗30 d。
1.2.2 糖代谢相关指标检测:采用江苏鱼跃血糖仪检测各组大鼠血浆FBG水平,采用放射免疫分析法检测各组大鼠空腹血清胰岛素(Fasting serum lisulin,FINS)水平,并计算胰岛素抵抗指数(Homeostasis model assessment for insulin resistance,HOMA-IR)。HOMA-IR=(FBG×FINS)/22.5。
1.2.3 肠道菌群检测:治疗30 d末取各组大鼠粪便0.2 g于无菌培养皿中,加入粪便体积10倍双蒸水稀释,充分震荡后形成均质化悬浊液,依次进行10倍系列稀释至10-7。不同稀释度选择需氧、厌氧培养基进行菌群培养,培养条件参照文献进行,对各组菌落数统计[7]。每克粪便的细菌数=菌落数×10 n×40,结果以每克粪便中的细菌菌落数的对数值Log CFU/g表示。
1.2.4 肠黏膜屏障功能检测:抽取各组大鼠外周血,2000 r/min条件下分离血清,采用ELISA法检测各组大鼠血清中D-LA、Zonulin及MFG-E8含量,操作流程严格按照说明书进行。
1.2.5 水通道蛋白检测:取各组大鼠结肠组织并制备组织匀浆,应用冷研磨法破坏组织,BCA法测定各样本蛋白浓度。各组均取10 μl样本液和5 μl蛋白Marker加入电泳装置中,10% SDS-聚丙烯酰胺凝胶电泳分离蛋白,待电泳结束后将含蛋白SDS-聚丙烯酰胺凝胶转移到PVDF膜,5%脱脂奶粉常温封闭4 h,加入AQP4一抗、AQP8一抗4 ℃封闭过夜,次日取出PVDF膜,PBS液洗膜3次,加入二抗后常温下孵育2 h,取出PVDF膜,PBS液洗膜3次,ECL显像,暗室曝光,扫描胶片,采用凝胶图象处理系统分析结果。实验独立重复3次。目标蛋白相对表达量=目的蛋白的灰度值/Gapdh的灰度值。
2 结 果
2.1 各组大鼠糖代谢指标比较 见表1。与空白组比较,模型组大鼠FINS降低,FBG、HOMA-IR水平均升高,差异有统计学意义(P<0.05);与模型组比较,连术消渴颗粒低剂量组、连术消渴颗粒中剂量组、连术消渴颗粒高剂量组及二甲双胍组FINS水平均升高,FBG、HOMA-IR水平均降低,且呈剂量依赖性,差异有统计学意义(均P<0.05)。

表1 各组大鼠糖代谢指标比较
2.2 各组大鼠肠道菌群比较 见表2。与空白组比较,模型组大鼠粪便培养中大肠杆菌数量增加,双歧杆菌、乳酸杆菌数量降低,差异有统计学意义(均P<0.05);与模型组比较,连术消渴颗粒低剂量组、连术消渴颗粒中剂量组、连术消渴颗粒高剂量组及二甲双胍组大鼠粪便培养中大肠杆菌数量降低,双歧杆菌、乳酸杆菌数量增加,且呈剂量依赖性,差异有统计学意义(均P<0.05)。
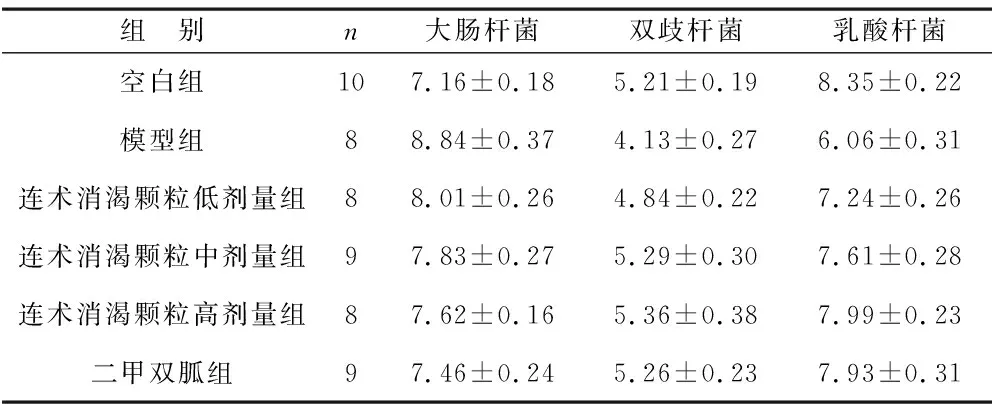
表2 各组大鼠肠道菌群比较(Log CFU/g)
2.3 各组大鼠肠黏膜屏障功能标记物比较 见表3。与空白组比较,模型组大鼠血清肠黏膜屏障功能标记物D-LA、Zonulin含量升高,MFG-E8含量降低,差异有统计学意义(均P<0.05)。与模型组比较,连术消渴颗粒低剂量组、连术消渴颗粒中剂量组、连术消渴颗粒高剂量组及二甲双胍组大鼠血清中D-LA、Zonulin含量降低,MFG-E8含量升高,且呈剂量依赖性,差异有统计学意义(均P<0.05)。

表3 各组大鼠肠黏膜屏障功能标记物比较
2.4 各组大鼠结肠水通道蛋白表达比较 见表4(图1)。与空白组比较,模型组大鼠结肠组织中AQP4、AQP8表达均降低,差异有统计学意义(P<0.05);与模型组比较,连术消渴颗粒低剂量组、连术消渴颗粒中剂量组、连术消渴颗粒高剂量组及二甲双胍组AQP4、AQP8表达均升高,且呈剂量依赖性,差异有统计学意义(P<0.05)。

表4 各组大鼠结肠组织中AQP4、AQP8表达比较
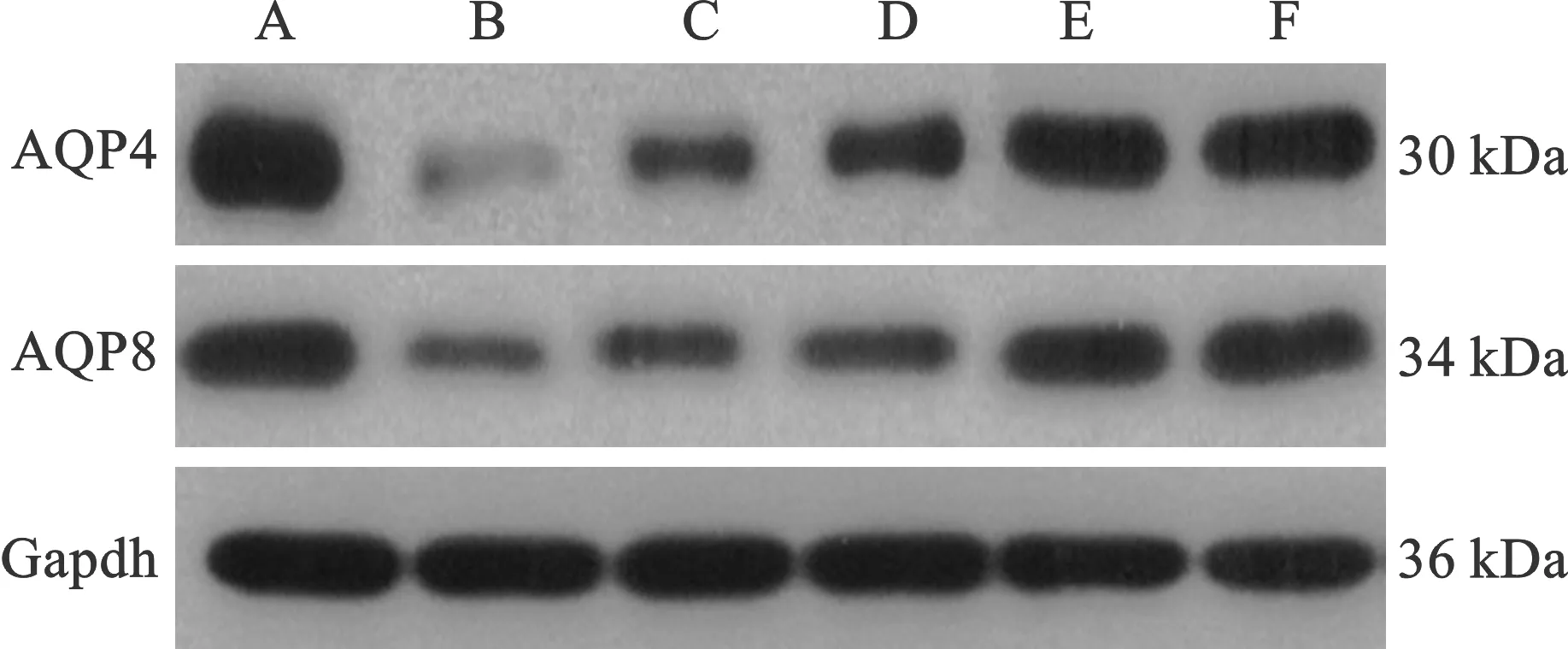
A:空白组;B:模型组;C:连术消渴颗粒低剂量组;D:连术消渴颗粒中剂量组;E:连术消渴颗粒高剂量组;F:二甲双胍组
3 讨 论
糖尿病属于中医“消渴”范畴,由近代医家张锡纯首次明确“消渴”即糖尿病。糖尿病有虚实燥热之别,主要病机为脾胃受损、升降运化失司、湿热瘀结所致,治疗方面立足于中焦脾胃,立法为运脾清热,泻浊化瘀,重铸中焦运化,方可改善机体对营养物质的吸收,濡养五脏六腑,输布百骸精微。连术消渴颗粒是闫镛教授治疗T2DM的经验方,其组成是在“升降散”“黄连温胆汤”治疗消渴病的基础上,结合多年临床经验化裁而来,全方由黄连、苍术、枳实、升麻、制半夏、陈皮、茯苓、泽泻、山楂、水蛭、干姜、大枣、甘草组成,共成运脾、宣导、清热、升阳、通瘀之法,标本兼顾,则脾运、浊化、瘀消,三焦、经络通畅,消渴自除[8]。
肠道菌群数量庞大,约有500~1000种类型,其数量是人体自身细胞的10倍之多,可与宿主以物质的形式进行信息交流及物质交换,是人体后天获得的“器官”,参与宿主的生长、生活、营养、代谢和疾病发展过程[9-13]。肠道菌群可通过结构变化影响宿主对营养的需求及情绪变化,导致体重、糖脂代谢、胆汁酸盐代谢紊乱及免疫失衡,参与T2DM的发病[14]。已有研究证实中药复方可通过调节肠道菌群,对T2DM起到一定的治疗作用[15]。本团队通过腹腔注射STZ建立经典T2DM大鼠模型,发现T2DM大鼠肠道菌群中大肠杆菌数量增加,双歧杆菌及乳酸杆菌数量降低,整体肠道菌群结构变化,这与张海平等[16]研究结果相似。通过不同剂量连术消渴颗粒进行干预治疗后,大鼠糖代谢功能改善,FINS升高,FBG及HOMA-IR均降低,粪便培养大肠杆菌数量降低,双歧杆菌及乳酸杆菌数量增加,呈剂量依赖性,并且高剂量组上述指标改善后水平与空白组相近,说明高剂量连术消渴颗粒治疗T2DM效果较好,可基本改善大鼠血糖升高及胰岛素抵抗状态,其机制可能与改善肠道菌群结构,增强微生物对糖分酵解作用并调节肠道对糖分吸收功能有关。
肠黏膜屏障功能与糖尿病的发生及发展密切相关,二者互为因果,高糖可破坏肠黏膜完整性,而肠黏膜屏障完整性被破坏导致小肠绒毛性水肿,影响降糖药物吸收,从而导致血糖升高[17-18]。D-LA、Zonulin及MFG-E8是目前公认的肠黏膜屏障功能血清标志物,虽然三者产生机制不同,但均可准确反映肠黏膜屏障功能状态[19-20]。本研究发现,T2DM大鼠存在肠黏膜屏障功能损伤,血清D-LA、Zonulin含量升高,MFG-E8含量降低,经连术消渴颗粒治疗后,D-LA、Zonulin及MFG-E8水平均得到改善,说明连术消渴颗粒的降糖效果可能与修复肠黏膜屏障功能有关。因此推测连术消渴颗粒对T2DM大鼠肠黏膜屏障功的改善可能是中药对肠黏膜的直接作用,治疗后增强了肠黏膜屏障的完整性;也可能是连术消渴颗粒调整T2DM大鼠肠道菌群结构,减轻对肠黏膜屏障的破坏,有效阻滞肠内微生物、内毒素、有毒食物及食物抗原的入侵,从而改善大鼠自身胰岛素抵抗状态,达到降糖目的。
《伤寒论·辨厥阴病脉证并治第十二》言:“厥阴之为病,消渴,气上……下之利不止”,津液代谢紊乱是T2DM的特征之一。大肠与肺相表里,主津,是人体水液代谢的重要一环,大肠可吸收食物中的水分,行津液于上焦,清降肺火,又可灌溉肌肤,充实腠理。水通道蛋白是大肠、结肠对水液吸收的主要运载“工具”,既往对T2DM水通道蛋白的研究主要集中在心、肺、肾,结肠中水通道蛋白的报道较少[21]。AQP4、AQP8均在结肠中表达,其中AQP4是目前已知的水转移能力最强的蛋白,高于其他水通道蛋白3~4倍,AQP8有独特的水液重吸收功能[22-23]。本研究结果提示,T2DM大鼠结肠组织AQP4、AQP8表达均明显降低,经高剂量连术消渴颗粒治疗后AQP4、AQP8表达均升高至正常水平。说明连术消渴颗粒可改善T2DM大鼠结肠水液代谢功能,一方面可能通过中药复方直接起效,增加水通道蛋白表达,另一方面可能通过调节大鼠肠道菌群结构、恢复肠黏膜屏障功能而降低血糖,从而对结肠水通道蛋白起到保护作用。
综上所述,连术消渴颗粒可改善T2DM模型大鼠糖代谢,修复肠黏膜屏障功能,提高结肠水通道蛋白表达,其机制可能与改善肠道菌群有关。
