20例非ABO-HDFN血型血清学分析及临床干预结果比较
2021-12-14西安高新医院输血科西安70075陕西省人民医院西安70068
洪 毅,王 华(.西安高新医院输血科,西安 70075;.陕西省人民医院,西安 70068)
胎儿或新生儿溶血病(hemolytic disease of the fetus and newborn, HDFN)是指因母亲与胎儿/新生儿红细胞血型不合,母亲体内产生针对胎儿/新生儿不匹配血型抗原的抗体而引起胎儿/新生儿发生同种免疫性溶血性疾病[1],包括ABO-HDFN 和由意外抗体导致的非ABO-HDFN。通常认为有ABO血型抗体导致的新生儿溶血病程度相对较轻,所需临床干预手段较少;而由意外抗体导致的新生儿溶血病则可能导致严重的后果[2]。患有HDNF 的患儿应及时治疗,治疗越早恢复健康的机会就越大,治疗方法主要有蓝光照射、输注白蛋白、输血以及换血等手段[3]。本研究对20 例由意外抗体导致的新生儿溶血病病例进行回顾性研究,并对不同临床干预手段效果进行了分析,现报道如下。
1 材料与方法
1.1 研究对象 2015年1月~2020年8月期间新生儿科送检,陕西省血液中心血型参比室进行检测并最终证实的非ABO-HDFN 病例共20 例,患儿均足月出生,日龄为出生1h~39日,其中男患儿11 例,女患儿9 例。
1.2 试剂与仪器 抗A,B 定型试剂,IgM-D,IgG-D 和抗球蛋白试剂,抗-C,抗-c,抗-E,抗-e,抗-M,2-Me(上海血液生物医药有限责任公司);A,B 反定型红细胞(北京金豪制药股份有限公司);O 型红细胞(实验室自制);IgM/IgG-D,抗-Jka,抗-Jkb,抗-Dia(Millipore,美国);抗筛细胞(Ortho,美国);抗体鉴定用谱细胞(Sanquin,荷兰);血液基因组DNA 提取离心柱型试剂盒(Roche,德国);人类红细胞RhD 基因分型试剂盒(天津市秀鹏生物技术开发有限公司);Taq 酶(Promega Corporation);DL2000(TaKaRa Bio Inc.)。PCR 仪(SensoquestLabcyle,德国);台式离心机(KA-2200型,日本久保田);台式离心机(L600A, 湖南湘仪离心机仪器有限公司);全自动血细胞洗涤离心机(MC 450,日本日立);水浴箱(GFL,德国)。
1.3 方法
1.3.1 红细胞血型鉴定:按文献[4]方法,采用盐水法对20 例患儿及其母亲进行ABO,Rh,Kidd,MNS 血型鉴定;试管抗球蛋白法进行Rh(D)阴性血型的确认及Dia 血型的鉴定;红细胞RhD 基因分型按天津市秀鹏生物技术开发有限公司试剂盒说明进行。
1.3.2 新生儿溶血病检测:按文献[4]方法,采用试管室温直接离心法对患儿进行红细胞直接抗球蛋白试验,游离试验及放散试验采用试管间接抗球蛋白法进行。
1.3.3 抗体筛查及鉴定:按文献[4]方法,采用抗筛细胞与抗体鉴定用谱细胞通过盐水法和试管抗球蛋白法筛查鉴定患儿母亲血清及患儿红细胞放散液中的意外抗体;2-Me 灭活后的血清进行倍比稀释,用试管间接抗球蛋白法测定抗体效价。在排除是否并发ABO-HDFN 时应该选择意外抗体对应抗原阴性的A/B 型红细胞进行相应试验(放散及抗体效价检测试验)。
1.4 统计学分析 将20 例非ABO-HDFN 病例按照临床最终干预方式[5]的不同分为光疗组、换血组和输血组,采用SPSS19.0 软件进行统计学分析,采用Kruskal-Wallis 检验,P<0.05 为差异有统计学意义。
2 结果
2.1 20例患儿及母亲检测结果 见表1。结果包括患儿血型、溶血三项试验、红细胞放散液抗体特异性鉴定、患儿母亲血型、抗体特异性鉴定及其效价测定。其中10 号患儿为Rh 并发Kidd-HDFN,11号患儿ABO 并发MNS-HDFN,12 号患儿ABO 并发Rh-HDFN,13 号患儿为MNS-HDFN,17 号患儿为Diego-HDFN,其他均为Rh-HDFN。
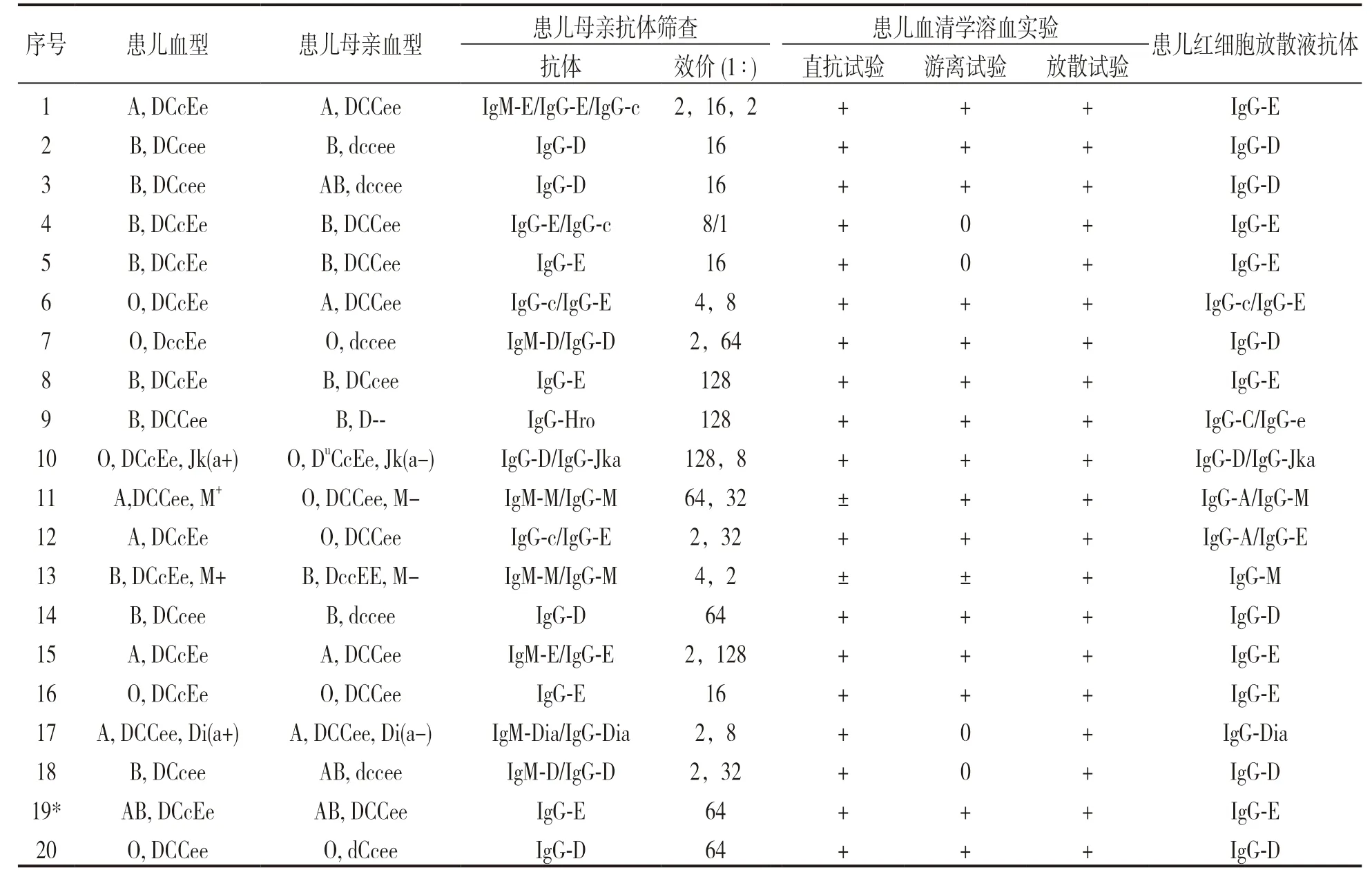
表1 患儿及其母亲血型血清学检测结果
2.2 RhD 基因分型结果 10 号患儿母亲Rh 阴性确认试验结果为Du,根据PCR-SSP 方法检测结果反应格局确定其为D ⅥⅢ型,此型为中国人群常见产生抗-D 抗体的部分D 基因型。
2.3 患儿首次送检血型参比室检测结果与相应临床干预的相关性 见表2。按照临床干预方式的不同,患儿分为光疗组、光疗后换血组(换血组)和光疗后输血组(输血组)。结合表1,光疗组患儿母亲抗体效价较低,均低于16;换血组患儿母亲抗体效价最高,均高于64;输血组患儿母亲抗体效价为2 ~128 之间。
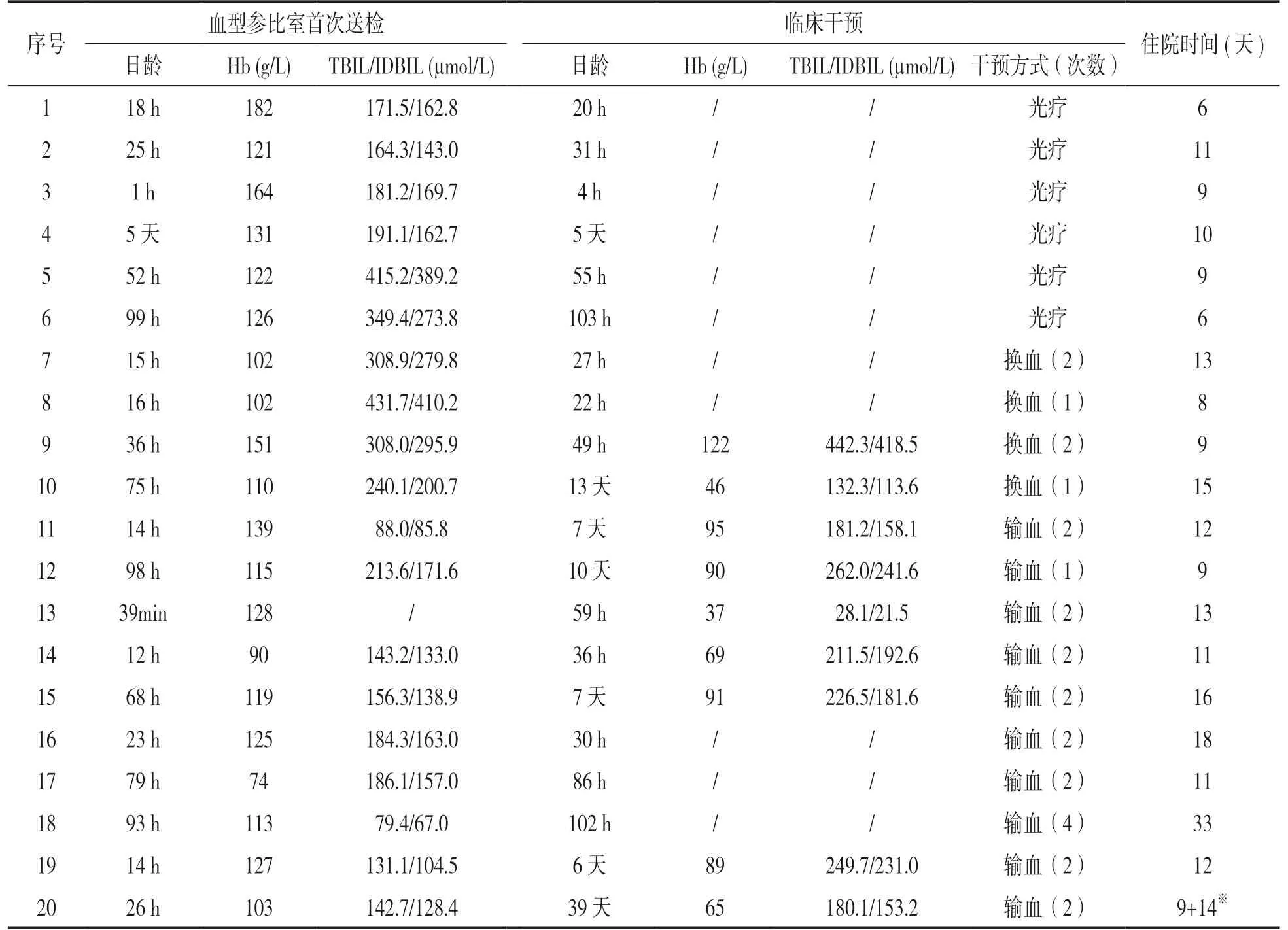
表2 患儿血液检测与干预后检测结果
2.4 三组平均住院天数的比较 光疗组、换血组和输血组三组间比较,输血组平均住院天数最高(15.8±6.94 天),换血组次之(11.25±2.86 天),光疗组最短(8.5±1.89 天)。采用Kruskal-Wallis检验进行统计学比较,差异有统计学意义(χ2=8.046,P=0.018)。
3 讨论
HDFN 是由母体产生的与胎儿血型不相容的IgG型血型抗体破坏胎儿/新生儿红细胞而引起的。其遗传免疫基础是胎儿红细胞可表达由父亲遗传而来的显性血型抗原,当母体缺乏该抗原并发生胎儿红细胞进入母体血液循环的情况时,母体就可能通过免疫应答产生相应的IgG 型血型抗体。因此,以IgG 类性质存在的红细胞血型抗体在理论上都有可能导致新生儿溶血病的发生,其中以ABO 血型系统最为常见,Rh 系统次之,Diego,Kidd,MNS,P1PK,Duffy,Lewis 等系统也有报道[6-9]。IgG 血型抗体导致红细胞的破坏,在妊娠期间可能导致胎儿的贫血,表现为胎儿的发育不良甚至死胎或流产;新生儿期红细胞的持续破坏导致一系列的继发症状,包括新生儿高胆红素血症和新生儿贫血。由于游离胆红素易透过生物膜,具有生物毒性,当脑神经基底核细胞结合游离胆红素时,高胆红素血症新生儿易出现神经系统受损害的症状,包括发热、嗜睡、吸吮反射弱、痉挛以及高死亡率和不良后遗症;新生儿贫血会导致缺氧,并使髓外造血组织代偿性增生,出现肝脾肿大;此外,新生儿清蛋白的大量消耗还会引起水肿等症状。临床调查显示,ABO 血型抗体(IgG-A,IgG-B)引起的HDFN(ABO-HDFN)病情相对较轻,而ABO 血型系统以外的意外抗体引起的HDFN 往往病情较重,需要更多的临床干预。
本研究中的20 例非ABO-HDFN 涉及到4 个血型系统的9 种意外抗体,反映出导致免疫性HDFN的抗体复杂性,血型血清学的检测是提高由意外抗体致非ABO-HDFN 的重要手段,临床应根据检出抗体的特性评估其风险,对患儿采取主动、及时的干预手段具有参考价值。
在我国,IgG-D 引起的Rh-HDFN 最为常见,与ABO-HDFN 不同,Rh-HDFN 在红细胞的破坏机制上与ABO-HDFN 不同,以血管外溶血为主。胎儿红细胞可表达完整的Rh 蛋白,且抗原数量与成人相近。当胎儿/新生儿红细胞与相应的Rh 血型抗体结合后,即被脾脏内的吞噬细胞识别并破坏。由于胎儿/新生儿体内吞噬细胞数量多,而且吞噬细胞的免疫通量大,因此,Rh 血型抗体所致的Rh-HDFN 表现为红细胞持续破坏,低效价的Rh 血型抗体即可导致病情严重的HDFN;其他的血型系统,如Diego,Kidd,MNS,P1PK,Duffy,Lewis 等系统的抗体也均可导致严重的新生儿溶血病。本研究中13 号患儿是由IgG-M 抗体导致的HDFN,尽管母亲血清IgG-M 抗体效价只有2,同时患儿总胆红素和直接胆红素水平并不高,但是血红蛋白水平从出生后128g/L 迅速下降到出生59h 的37g/L,原因为IgG-M 抗体主要破坏的是造血祖细胞[10]。因此一旦鉴定出由意外抗体导致的HDFN,应根据抗体的特性积极、及时采取有效的临床干预手段,包括给予新生儿换血治疗和多次输血。我们研究显示,光疗组患儿病情比较轻,住院时间短;输血和换血两组之间新生儿因病情相似,换血组通过把患儿体内含有抗体的自身血液换出,输入正常血液,达到治疗目的;输血是患儿体内已经致敏的红细胞被意外抗体持续破坏,抗体的消耗比较慢,病程持续时间最长,所以对于意外抗体导致严重的HDFN 患儿,换血治疗明显缓解患儿病情,住院天数缩短。美国输血协会(AABB)认为[11],新生儿换血可以去除体内70%~90%的致敏红细胞和50%左右的总胆红素。我们建议临床对于由意外抗体,特别是多种意外抗体导致的非ABO-HDFN,临床应根据检出抗体的特性及患儿的病情轻重来评估其风险,应积极考虑换血治疗,及时对患儿采取必要的干预手段,对改善患儿预后具有参考价值。
