植物多糖提取、分离纯化及鉴定方法的研究进展
2021-12-11陈红杨许花查勇宋礼高丹丹
陈红 杨许花 查勇 宋礼 高丹丹
摘 要:植物多糖又称植物多聚糖,是广泛存在于生物体中的一种物质,具有抗肿瘤、提高免疫、抗病毒等生物活性,现已广泛运用于食品、保健品和医药等行业。多糖的生物活性与其组成、结构有关,植物多糖分离纯化和结构鉴定是多糖生物活性研究和应用前提。该文主要综述了近年来植物多糖的提取、分离纯化及鉴定的方法,以期为植物多糖的研究提供参考。
关键词:植物多糖;提取;分离纯化;结构
中图分类号 TS255.1文献标识码 A文章编号 1007-7731(2021)22-0032-04
Research Progress in Extraction, Purification and Identification of Plant Polysaccharides
CHEN Hong1 et al.
(1College of Life Science and Engineering, Northwest Minzu University, Lanzhou 730124, China)
Abstract: Plant polysaccharide, also known as plant polysaccharide, is a kind of substance widely existing in biological organism,it have a variety of biological activities, anti-tumor, immune, antiviral, and other functions, are widely used in food, health products and pharmaceutical industries.The bioactivity of polysaccharides is related to the composition and structure of polysaccharides. Therefore, the isolation, purification and structure identification of plant polysaccharides are the premise of their bioactivity research and application. This paper reviews the methods of extraction, purification and identification of plant polysaccharides in recent years, in order to provide theoretical basis for the study of plant polysaccharides.
Key words: Plant polysaccharidde; Extraction; Separation and purification; Construction
植物多糖又称植物多聚糖,是广泛存在于生物体中的一种物质,它是一类由醛糖或酮糖经糖苷键连接而成的天然高分子聚合物,是生物体内重要的大分子物质,是维持正常生命活动的基本物质之一。研究发现,植物多糖具有提高免疫力、抗肿瘤、降血糖、抗氧化、抗凝血、抗辐射、保护肝脏等生物活性作用[1]。
植物多糖的来源广泛,是由几种单糖以一定比例聚合而成,不同的植物多糖其分子构成及分子量各不相同。植物多糖主要由葡萄糖、果糖、半乳糖、甘露糖、阿拉伯糖、鼠李糖、木糖等组成。由于植物多糖具有多种生物活性且毒副作用小,现已被广泛应用于食品、医药、保健行业,受到了越来越多研究人员的青睐。多糖的生物活性与其组成、结构有关,因此,植物多糖分离纯化和结构鉴定是多糖生物活性研究和应用前提。
目前,较为常用的植物多糖提取方法有水体醇沉法、酸碱提取法、微波辅助法、超声辅助法、酶辅助法及近年来快速发展的超临界流体萃取法。常用的分离纯化方法有超滤法、季铵盐络合法及较为高效的大孔树脂层析、凝胶柱层析、离子交换法。植物多糖结构的鉴定常以高效液相色谱法、气相色谱法、凝胶层析法等方法联用,从而达到鉴定单糖组分的目的。本文综述了近年来植物多糖提取、分离纯化及鑒定的具体方法,以期对今后植物多糖的研究提供参考。
1 植物多糖的提取方法
1.1 溶剂提取法 溶剂提取法是提取植物多糖常用的方法,遵循相似相溶的原则,常用水、乙醇等对植物组织穿透力强的强极性溶剂作提取溶剂。其中,热水浸提法可用于各种植物多糖的提取,方法操作简单,且不会对植物多糖的性质造成影响,能最大限度地保留其活性。周宇波等[2]采用水热法以1∶25的料液比在120℃下提取90min得到龙井长叶茶树叶茶多糖110.23mg/g。Periaswamy等[3]加压热水提取褐藻多糖,最佳工艺为:150℃、1.985MPa、料液比1∶36.81、水分70%,提取率为14.93%。
1.2 酶辅助法 酶辅助法是近年来应用广泛的一种高效、温和、简便、环保的提取方法,其利用酶反应的高度专一性将植物细胞壁降解,使多糖从细胞中出来。同时,酶还可分解提取液中淀粉、蛋白质、果胶等非目的产物,常用的酶有纤维素酶,果胶酶,蛋白酶等。黎英等[4]采用复合酶法提取漳平水仙饼茶多糖,在料液比1∶80,果胶酶∶木瓜蛋白酶∶纤维素酶=15∶10∶18,酶添加量3.0%,49℃,pH6.0,酶解90min的条件下最高得率为4.26%。祁文露等[5]采用酶辅助法提取白雪茶多糖,得到最佳工艺条件为:50℃,pH5.0,酶浓度3.0%(纤维素酶∶木瓜蛋白酶=1∶4),提取60min,提取率可达10.81%。Jin等[6]用复合酶法从夏枯草中提取多糖,最佳工艺为∶纤维素酶∶果胶酶∶木瓜蛋白酶=1∶2∶2,酶添加量2%、萃取温度61℃、pH6,产率为11.57±0.48%。
1.3 酸碱提取法 酸碱提取法是以酸或碱溶液作浸提液提取植物多糖。酸提取法是用适宜的酸溶液将含酸性基团的多糖提取出来。碱提取法是利用稀碱液有助于解除植物细胞壁分子间的化学和物理作用,并可转化多糖与蛋白质间的结合方式的原理提取多糖[7]。陈文宁[8]分别采用柠檬酸提取法和碱提取法海带多糖,提取率分别为15.92%、6.05%,且抗氧化活性良好。Bao等[9]用碱性溶液从佛手柑中提取CMSPB80,用95%的乙醇处理3h、热水(1∶15,w/v)提取4h后,0.3mol/LNaOH碱性溶液处理过夜,其得率为0.88%。
1.4 微波辅助法 微波辅助法是利用微波能使细胞内部温度升高,压力增大,导致细胞壁破裂,从而使多糖从细胞中出来,溶解在溶剂中。韩艳丽等[10]采取果胶酶-微波提取的方法,在50℃、700W微波、微波时间60s、加酶量1.0%、pH5.5、酶解2.5h,茶树花多糖提取率达4.82%,发现该法比单独使用果胶酶提取率显著提高。胡选生等[11]用微波辅助法从100目毛酸浆果实中提取多糖,在料液比1∶25,浸提30min,微波(800W)2min,提取率达4.82%。Reza等[12]用微波辅助提取棉花糖根多糖,发现在457.32W、75°C的条件下提取26min,多糖提取率高达14.47%。
1.5 超声辅助法 超声波辅助法是利用超声波在介质传播过程中产生并传递强大的能量引起溶剂质点加速度增大,在溶剂中的空化作用会加速破碎细胞,从而使多糖快速浸出。黄谦等[13]采用酶-水超声浸提法提取茶叶多糖在85℃,超声功率1000W,酶反应3.0h、提取4次,得到多糖的提取率为(5.01±0.08)%。汪梦雯等[14]用超声辅助热水浸提法提茯茶多糖,最佳工艺为:料液比1∶29,浸提93min,超声30min,提取率为3.69%。Sorourian等[15]用超声辅助碱溶液提取香蒲茎多糖,其最佳工艺参数为∶1.5mol/L NaOH溶液,液固比25∶1,50khz提取40min,得率为(12.24±0.08)%。
1.6 超临界流体萃取法 超临界流体萃取法是利用超临界流体处于临界温度和临界压力以上时具有极高的溶解度,能在短时间内轻易渗透到物料的内部,将其中的活性成分萃取出来。该法能最大限度地保持提取物的活性,且不會有溶剂残留,常用CO2作为超临界流体萃取剂[16]。韦晓洁等[17]用超临界CO2萃取广西苦丁茶多糖,最优条件为:萃取压力40MPa,夹带剂流量3.5mL/min、50℃萃取120min,得率7.05%。杨孝辉等[18]用超临界CO2法萃取淮山多糖,在53℃、45MPa压力、夹带剂乙醇浓度68%条件下萃取2.5h,提取率为(0.2807±0.0045)%。
2 植物多糖的分离纯化
2.1 超滤法 超滤法是一种膜分离技术,以压力为推动力,运用膜分离原理将小分子溶质和溶剂除去,从而使大分子物质得到纯化。凡军民等[19]采用超滤法初步分离纯化草菇多糖,将多糖溶液过5ku、10ku透析袋后,采用30ku、50ku、100ku超滤管离心透析,获得分子量为MW>100ku与MW=5~10ku的草菇多糖。廖启元等[20]在截留分子量30000、温度25℃、压力0.10MPa时,超滤处理3.0mg/mL多糖溶液100min脱除猫爪草粗多糖中的蛋白质,达到78.2%多糖保留率和77.1%蛋白脱除率,优于Sevag法和TCA法。Feng等[21]采用超滤法从曲霉芽孢杆菌黏液中分离出3个多糖级分:BSP-U100,BSP-U50,BSP-U10。
2.2 季铵盐络合法 季铵盐及其氢氧化物是一类乳化剂,可与酸性糖形成不溶性沉淀,与中性多糖不能产生沉淀,但若溶液的pH增高或糖的酸度增高,也会与中性多糖形成沉淀。郭琦[22]用季铵盐络合法初步分离枸杞多糖,得到3个组分WLBP1、WLBP2、WLBP3的得率分别为25%、2.5%、30%。Liu等[23]用季铵盐络合法结合超滤法成功纯化粗多糖,比柱色谱法用时更短、分离体积更大、多糖得率更高。
2.3 大孔树脂层析法 大孔树脂层析法是利用大孔树脂对不同成分的选择性吸附作用和分子筛作用,在适宜的吸附和解吸条件下分离纯化多糖。刘树兴等[24]利用AB-8大孔树脂吸附、DEAE纤维素柱分离藜麦多糖,得到多糖QPs-I、QPs-II、QPs-III,后对QPs-I用Sephadex G-100葡聚糖凝胶层析柱纯化得到QPs-I-I。吴艳丽等[25]经Sevag法除蛋白、AB-8大孔树脂脱色、纤维素DEAE Cellulose-52及葡聚糖凝胶SephadexG-100色谱柱分离纯化南瓜多糖,得到5个南瓜多糖组分:CMP-A1、CMP-A2、CMP-B、CMP-C1、CMP-D2。Yang等[26]用AB-8大孔树脂从山茶饼提取物中分离纯化茶籽多糖和茶籽皂素,得到18.7%的纯度为89.2%的茶籽多糖。
2.4 凝胶柱层析法 凝胶柱层析法常用葡聚糖凝胶和琼脂糖凝胶,以不同浓度的盐溶液和缓冲液为洗脱剂,使不同大小的多糖分子分离纯化,但不适宜粘多糖的分离。圣志存等[27]采用DEAE-52纤维素阴离子交换树脂和Sephadex G-100葡聚糖凝胶柱层析分离纯化桑叶多糖得2种纯化多糖组分:MLP-1和MLP-2。余茂元[28]将霍山石斛粗多糖经DEAE-52纤维素阴离子交换柱和琼脂糖CL-6B凝胶柱分离纯化得3种主要多糖组分(DHP 1-2、DHP 2-1、和DHP 2-2)。Niyomploy等[29]将野生姜黄粗多糖中经DEAE-纤维素离子交换柱色谱分级分离、Superdex G-200凝胶过滤柱色谱纯化,得到2个相对丰富的多糖馏分(P11和P21)。
2.5 离子交换法 离子交换法是根据物质的分子量及电荷性质的差异进行多糖组分分离的方法。李怀宇等[30]用DEAE Sepharose Fast Flow阴离子交换层析柱分离纯化三七粗多糖,得到1种中性多糖(PNPS Ⅰ)和4种酸性多糖(PNPS Ⅱ~Ⅴ)。Liu等[31]通过大孔吸附树脂和离子交换色谱法分离并纯化了大球盖菇多糖,得到1种中性多糖SRP-1和1种酸性多糖SRP-2。Gao等[32]研究发现,D730阴离子大孔吸附树脂可有效吸附大豆多糖。
3 多糖的鉴定和结构分析
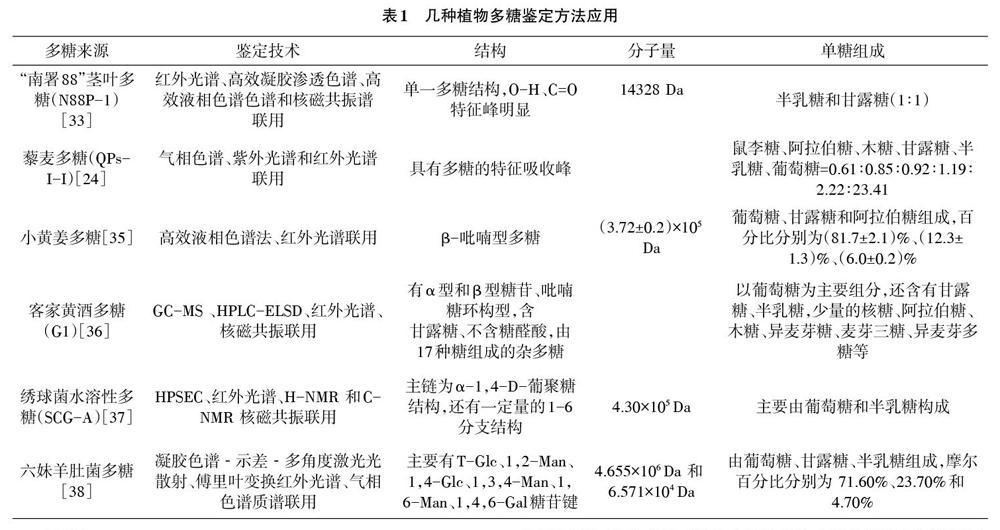
植物多糖的结构鉴定方法有质谱法、红外光谱法、高效液相色谱法、气相色谱法、核磁共振色谱法、高效凝胶色谱法等。多糖结构复杂,故常以高效液相色谱法、气相色谱法、凝胶层析法等方法联用,从而达到鉴定单糖组分的目的。具体见表1。
4 展望
植物多糖具有抗肿瘤、提高免疫、抗病毒等生物活性,现已广泛运用于食品、保健品和医药等行业。植物多糖分离纯化和结构鉴定是多糖生物活性研究和应用前提。随着时代的发展,越来越多的结构鉴定方法不断涌现。目前比较常用的是将几种鉴定方法结合使用,使结构分析细致全面,便于进一步研究植物多糖的生物活性。但实际操作上,使用的样品要求精度高,仪器成本高,不能大规模使用。因此,探寻低成本、高效、全面的鉴定方法,是植物多糖研究发展的方向。
参考文献
[1]尹文辉,梁增澜,张睿,等.银耳多糖分离提取工艺的优化研究[J].食品研究与开发,2020,41(09):93-97.
[2]周宇波,李霞飞,高岳芳,等.水热法提取龙井长叶中茶多糖工艺优化研究[J].西北林学院学报,2018,33(01):207-210,240.
[3]Periaswamy Sivagnanam Saravana,Yong-Nam Cho,Hee-Chul Woo,et al. Green and efficient extraction of polysaccharides from brown seaweed by adding deep eutectic solvent in subcritical water hydrolysis[J].Journal of Cleaner Production,2018,198:1474-1484.
[4]黎英,陈雪梅,张灵,等.复合酶法提取漳平水仙饼茶多糖的工艺优化[J].食品与生物技术学报,2017,36(04):443-447.
[5]祁文露,肖聪,赵艳,等.复合酶法提取白雪茶多糖工艺研究[J].湖北农业科学,2019,58(17):104-108.
[6]Jin C G,Chen R Z,Tan L,et al. Response Surface Optimization of Complex Enzyme Extraction Polysaccharides from Prunella Vulgaris[J].Journal of Changchun Normal University,2016,02:52-56.
[7]宋磊肖,何俊平,贾晓韩,等.板栗多糖的提取、分离纯化方法及其生物活性[J].落叶果树,2018,50(04):32-35.
[8]陈文宁,郑娟霞,月金玲,等.酸与碱处理对海带多糖提取及其抗氧化活性的影响[J].中国饲料,2021(07):17-20.
[9]Bao Peng,Jianing Yang,Weijuan Huang,et al.Structural characterization and immunoregulatory activity of a novel heteropolysaccharide from bergamot (Citrus medica L. var. s arcodactylis) by alkali extraction[J].Industrial Crops & Products,2019,140.
[10]韩艳丽,凡军民,李静,等.果胶酶-微波法提取茶树花多糖的工艺[J].江苏农业科学,2017,45(02):166-168.
[11]胡选生,李丹青,张佩洁,等.微波辅助法提取毛酸浆果实多糖工艺的优化[J].农产品加工,2020(03):44-46,49.
[12]Reza Hashemifesharaki,Epameinondas Xanthakis,Zeynep Altintas,et al. Microwave-assisted extraction of polysaccharides from the marshmallow roots: Optimization,purification,structure,and bioactivity[J].Carbohydrate Polymers,2020,240(3):116301.
[13]黃谦,朱明扬,罗林根,等.基于主成分分析法的茶叶多糖提取工艺优化[J].食品工业科技,2018,39(17):206-211,287.
[14]汪梦雯,刘文婷,任雪宁,等.茯茶多糖提取工艺优化及其体外抗氧化和对益生菌生长的影响[J].陕西科技大学学报,2020,38(01):50-57.
[15]Reihaneh Sorourian,AmirEghbal Khajehrahimi,Mehrnoosh Tadayoni,et al. Ultrasound-assisted extraction of polysaccharides from Typha domingensis:Structural characterization and functional properties[J].International Journal of Biological Macromolecules,2020,160:758-768.
[16]谭兰芳,许文珍,杨跃歌,等.超临界CO2萃取白花蛇舌草粗多糖工艺研究[J].化工管理,2021(06):81-82.
[17]韦晓洁,银慧慧,孟菲,等.超临界CO2流体萃取苦丁茶多糖的工艺优化[J].广西植物,2018,38(05):590-595.
[18]杨孝辉,郭君.响应面法优化超临界CO2流体萃取淮山多糖工艺[J].食品工业科技,2019,40(07):185-189,198.
[19]凡军民,谢春芹,贾君,等.不同分离纯化方法对草菇多糖抗氧化活性的影响[J].食品科技,2017,42(07):205-208.
[20]廖启元,经嘉,王晓阁,等.超滤法脱除猫爪草粗多糖中蛋白质的工艺研究[J].怀化学院学报,2018,37(05):4-8.
[21]Simin Feng,Di Luan,Ke Ning,et al.Ultrafiltration isolation,hypoglycemic activity analysis and structural characterization of polysaccharides from Brasenia schreberi[J].International Journal of Biological Macromolecules,2019,135:141-151.
[22]郭琦. 枸杞多糖的提取,分离纯化,溶液性质及其结构的初步研究[D].西安:陕西师范大学,2012:15-19.
[23]Liu L,Lu Y,Li X,et al. A novel process for isolation and purification of the bioactive polysaccharide TLH-3′ from Tricholoma lobayense[J].Process Biochemistry,2015,50(7):1146-1151.
[24]刘树兴,任益平,李浩恒,等.藜麦多糖的分离纯化及结构初步分析[J].中国食品添加剂,2019,30(10):48-52.
[25]吴艳丽,邵珠领,张宇,等.南瓜均一多糖的分离纯化及其抗氧化活性的研究[J].食品研究与开发,2019,40(23):62-70.
[26]Yang Pengjie,Zhou Mingda,Zhou Chengyun,et al. Separation and purification of both tea seed polysaccharide and saponin from camellia cake extract using macroporous resin.[J].Journal of separation science,2015,38(4):656-662.
[27]圣志存,陈晓兰.安徽产地桑叶多糖分离纯化、结构鉴定与抗氧化活性研究[J].中国食品添加剂,2020,31(01):59-67.
[28]余茂元.霍山石斛多糖分離纯化及其益生作用[D].芜湖:安徽工程大学,2019:10-18.
[29]Niyomploy,Thunyakitpisal,Karnchanatat,Sangvanich. Cell proliferative effect of polyxyloses extracted from the rhizomes of wild turmeric,Curcuma aromatica[J].Pharmaceutical Biology,2010,48(8): 932-937.
[30]李怀宇,钟媛媛,李双,等.三七粗多糖的分离纯化及其对人牙周膜干细胞、小鼠成骨细胞体外增殖活性的影响[J].华西药学杂志,2019,34(05):433-439.
[31]Ying L,Cfh B,Xi F C,et al. Isolation,characterization and antioxidant of polysaccharides from Stropharia rugosoannulata[J].International Journal of Biological Macromolecules,2020,155:883-889.
[32]Wenhong Gao,Yangping Huang,Ruixue He,et al. Synthesis and characterization of a new soluble soybean polysaccharide-iron(III) complex using ion exchange column[J].International Journal of Biological Macromolecules,2018,108:1242-1247.
[33]刘露,侯怡铃,王梅,等.“南薯88”茎叶多糖的分离纯化,结构鉴定及其生物活性的研究[J].食品与生物技术学报,2019,38(02):101-110.
[34]宋丽丽,闻格,霍姗浩,等.小黄姜多糖的分离纯化及其结构特征及抗氧化活性研究[J].食品与发酵工业,2020,46(12):73-79.
[35]刘晓艳,李湘銮,白卫东,等.客家黄酒多糖的分离纯化及结构表征[J].仲恺农业工程学院学报,2020,33(01):38-43.
[36]张迪,王宏雨,肖冬来,等.绣球菌多糖及其体外免疫活性研究[J].福建农业学报,2019,34(09):1093-1099.
[37]王珍珍,官月,刘洋,等.六妹羊肚菌多糖的提取工艺优化及结构表征和抗氧化活性[J].菌物学报,2019,38(09):1548-1558.
(责编:张宏民)
