基于网络药理学和分子对接探讨紫苏籽抗癌抗肿瘤的分子机制
2021-12-07孙晓丽田荣荣
郭 旭,张 东,孙晓丽,田荣荣✉
(1. 北京城市学院 生物医药学部,北京 100094;2. 国家粮食和物资储备局科学研究院,北京 100037)
近年来,癌症已成了威胁全世界人类的常见疾病,患病率和死亡率居高不下。在中国,每10分钟就有55人死于癌症;全球约有50%的胃癌、肝癌和食道癌病例来自中国[1]。因此,制定新的癌症防治策略迫在眉睫。紫苏籽是为唇形科植物紫苏Perilla frutescens(L.) Britt.的干燥成熟果实,始载于《名医别录》[2],在药食同源的植物资源中有很高的地位,作为中药和功能性食品在全世界广泛使用。药典中记载,紫苏籽可降气化痰,止咳平喘,润肠通便,具有抗动脉粥样硬化[3-4]、改善学习和记忆力[5]、改善视觉功能[6]、抗老年痴呆[7-8]、抗菌抗炎[9-10]、抗癌抗肿瘤[11-14]的功效。
传统的药物研发一直遵循着一种药物—一个靶点—一种疾病的模式,无疑这种模式局限了研制药物的思路,实际上临床上许多疾病都是多基因多靶点的,治疗起来十分的复杂,这时网络药理学应运而生。网络药理学是以系统生物学和多学科药理学为基础,提供了一种“多靶点、多效应、复杂疾病”的新型网络模式[15],中医药本身也遵循着整体观和辨证论治,这与网络药理学不谋而合,近年来,基于网络药理学对中药的研究越来越多,也取得了较好的成效[16]。分子对接是应用计算机模拟配体和受体的结合,通过结合能的大小来判断二者结合的可能性,通过可视化软件判断结合方式和位置,预测药物和靶点蛋白相互作用的概率,现在多用于新药的研发,为繁多的实验节省时间[17]。目前对于紫苏籽的研究多集中在功能性食品的开发上,对于其治疗疾病的作用机制和靶点的研究较少,本研究借助网络药理学和分子对接的方法,对紫苏籽发挥作用的靶点和通路进行预测,希望可以对未来紫苏籽进一步研究提供思路和方向。
1 材料与方法
1.1 紫苏籽的活性成分及靶点收集
通过查阅文献[18-21]并且利用中药系统药理学数据库和分析平台(TCMSP)收集紫苏籽的活性成分,获得其口服生物利用度(oral bioavailability,OB)、类药性(drug-likeness,DL)和小肠上皮细胞渗透率(Caco-2 permeability)值及各活性成分对应靶点,汇集靶点,并通过Uniprot数据库(https://www.uniprot.org/)将药物靶点的蛋白名称转换成 GeneCards数据库(https://www.genecards.org/)的基因名称。
1.2 癌症/肿瘤相关靶点的搜集
从人类基因数据库(Gene-Cards,https://www.genecards.org/)中收集与关键词“cancer”和“tumor”相关的靶点,使用 Venn在线软件(http://bioinformatics.psb.ugent.be/webtools/Venn/)将活性成分靶点—癌症和肿瘤相关靶点取交集,获得紫苏籽的潜在抗癌和抗肿瘤靶点。
1.3 活性成分—疾病靶点网络构建及可视化分析
将交集靶点导入Cytoscape3.7.2软件,建立药物—活性成分—靶点—疾病网络图。图中节点(node)代表紫苏籽、活性成分、靶点、疾病,边(edge)分别代表活性成分和靶点或靶点和疾病的交互作用。
1.4 蛋白互作网络(PPI网络)的构建
将筛选得到的潜在抗癌和抗肿瘤靶点导入String(https://string-db.org, version 11.0)在线平台数据库,以研究靶蛋白相互作用,设置物种为“Homo sapiens”,构建蛋白质-蛋白质相互作用网络(PPI网络)。
1.5 GO功能和KEGG通路富集分析
采用DAVID6.8数据库(https://david.ncifcrf.gov/),对紫苏籽潜在抗癌和抗肿瘤靶点进行 GO功能分析,以了解靶点的生物学过程,KEGG通路分析研究药物靶点主要信号通路,DAVID平台列表与背景均设置为“Homo sapiens”,GO富集分析选择生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组成(cellular component,CC)3个模块,通路分析选择 KEGG。
1.6 成分-靶点分子对接
利用 Auto Dock软件进行分子对接,Pymol进行分子对接可视化分析。在紫苏籽抗癌抗肿瘤靶点的 PPI 网络图中选取核心靶点与紫苏籽活性成分进行分子对接,借助PDB数据库(https://www.rcsb.org/)找出靶点蛋白的晶体结构,靶点AKT1(PDB ID:6NPZ)、TP53(PDB ID:3D06)、MAPK1(PDB ID:4ZZN)。所有受体文件均做删除原配体、水分子及加氢加电荷处理,配体分子为紫苏籽活性成分,将整理好的靶点蛋白 3D结构和对应化合物的结构导入Auto Dock进行分子对接。目前尚无明确的活性成分靶点选择的唯一标准,一般认为结合能<0就有自发结合的可能,结合能>0结合时可能需要外界力量促使其结合,结合能越低结合的可能就越大[22],将所得结果使用Pymol进行可视化处理,得到核心靶点蛋白和对应化合物的相互作用关系图。
2 结果与分析
2.1 紫苏籽活性成分及靶点的筛选
口服利用度(OB)和类药性(DL)是药物活性成分筛选常用指标,通过 TCMSP数据库,获得紫苏籽的化学成分87个,以OB≥30%、DL≥0.18为条件进行筛选,共筛选得紫苏籽的活性成分17种,为脂肪酸及其油脂伴随物。利用中药系统药理学数据库和分析平台(TCMSP)检索到紫苏籽主要活性成分的对应靶点,总计883个,删除重复项,共获得288个活性成分靶点。紫苏籽主要活性成分信息见表1。
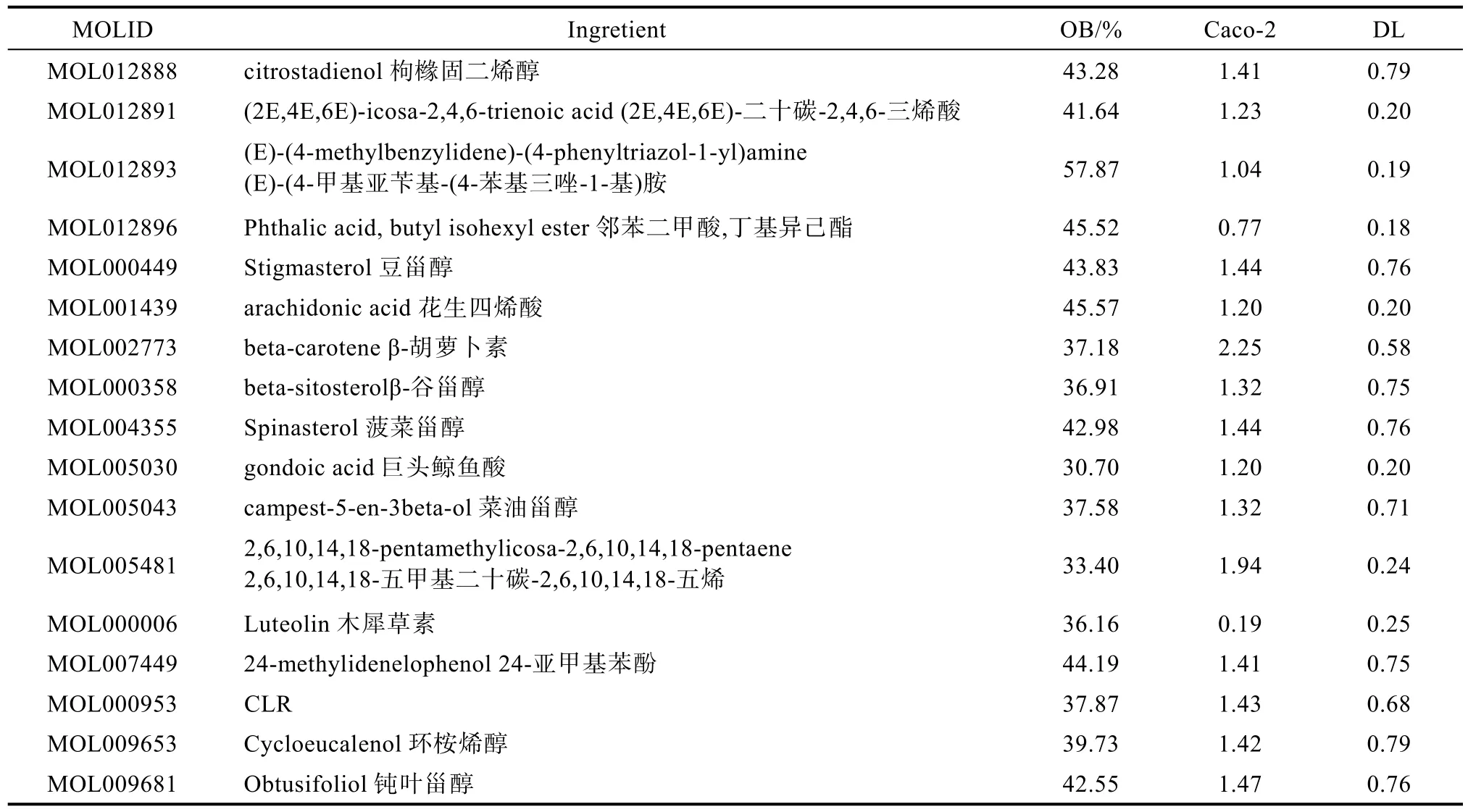
表1 紫苏籽主要活性成分及其参数Table 1 Main active ingredients and parameters of perilla seeds
2.2 紫苏籽活性成分抗癌和抗肿瘤靶点收集
在GeneCards数据库中输入关键词“cancer”和“tumor”进行疾病靶点搜索,以score≥20进行筛选,得到 1 646个。利用 Venn在线软件将紫苏籽活性成分对应的107个药物靶点(删除未找到基因名称的靶点)与癌症及肿瘤相关的1 646个疾病靶点取交集,通过Venn图(如图1)的形式得到 72个紫苏籽潜在抗癌和抗肿瘤靶点(见表2)。

图1 药物靶点与疾病靶点关系图Fig.1 The relationship between drug targets and disease targets

表2 紫苏籽潜在抗癌和抗肿瘤靶点信息Table 2 Information on potential anti-cancer and anti-tumor targets of perilla seeds
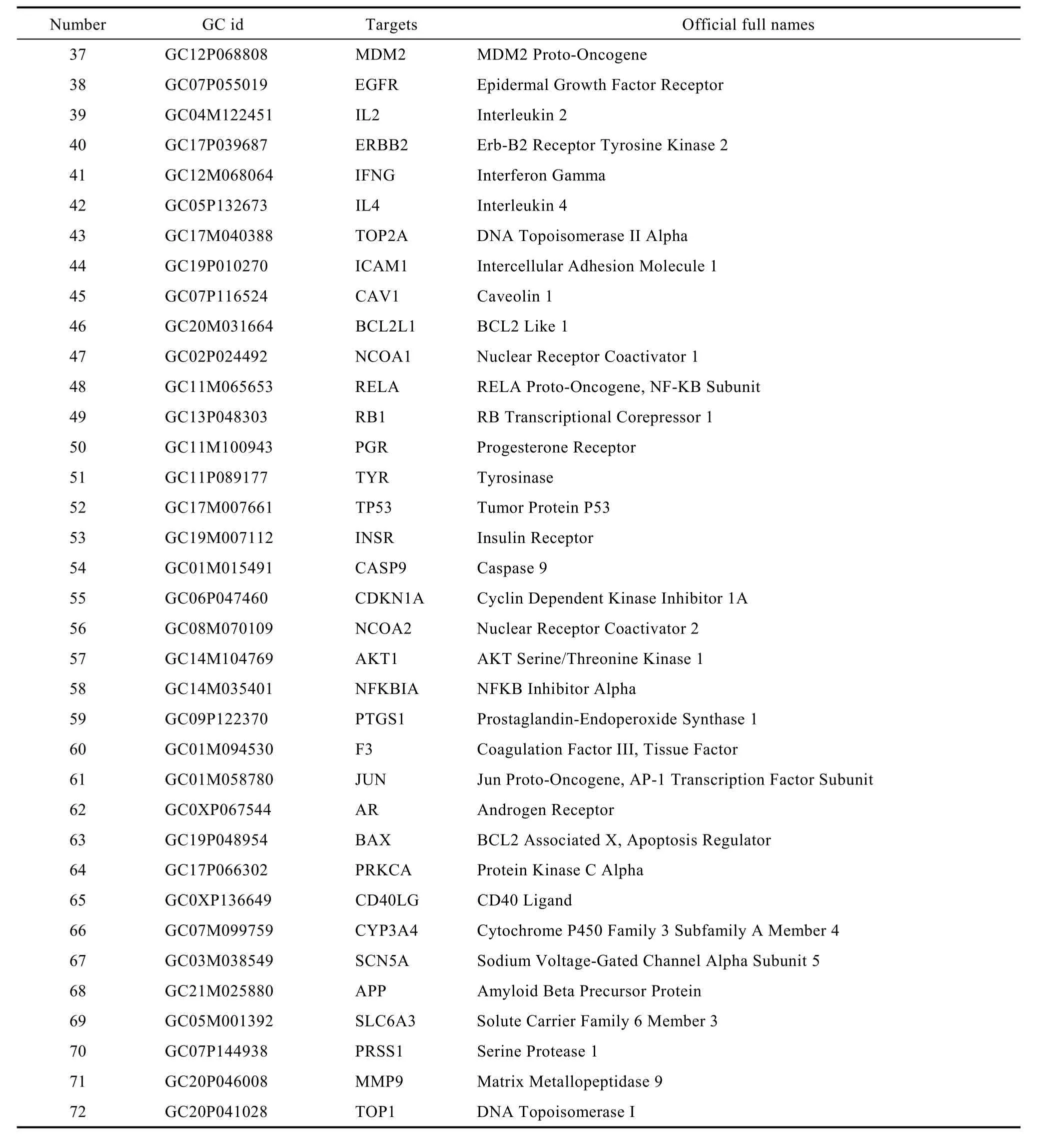
续表2
2.3 紫苏籽活性成分-抗癌和抗肿瘤靶点网络构建
利用 Cytoscape 3.7.2 软件建立药物-活性成分-靶点-疾病的可视化网络图(图2),共有 118个节点、126条边,其中三角形蓝色节点u代表紫苏籽,11个紫色圆形节点代表紫苏籽的活性成分,72个浅蓝色菱形节点代表癌症和肿瘤靶点,粉色方形节点代表癌症和肿瘤,126条边代表节点之间的相互作用。节点的颜色和大小表示该靶点重要性,节点越大颜色越深说明该节点越重要。该网络中化合物的平均度值为 2.14,由高到低依次为木犀草素(degree=43)、β-胡萝卜素(degree=21)、豆甾醇(degree=18)、β-谷甾醇(degree=17)、邻苯二甲酸,丁基异己酯(degree=9)、(E)-(4-甲基亚苄基-(4-苯基三唑-1-基)胺(degree=6)、巨头鲸鱼酸(degree=3)、24-亚甲基苯酚(degree=3)、钝叶甾醇(degree=3)、枸橼固二烯醇(degree=3)。由图可知,木犀草素作用于MET、ADCY2、NUF2、PTGES、CD40LG、INSR、SLC2A4、XIAP、GSTP1、TOP2A、IL4、IFNG、TYR等 41个靶点;β-胡萝卜素作用于 MMP10、GJA1、F3、CASP7、MYC、CTNNB1、CAV1、CYP1A2、CYP3A4、HMOX1、MMP1、CASP8等 19个靶点;β-谷甾醇作用于MAP2、PON1、TGFB1、PRKCA、BAX、OPRM1、SLC6A4、CHRNA2、GABRA5、PDE3A、CHRM4、GABRA2等15个靶点;豆甾醇作用于CHRNA7、GABRA1、ADRA1B、GABRA3、HTR2A、ADRB1、CTRB1、MAOA、LTA4H等 16个靶点。靶点最多的成分是木犀草素。
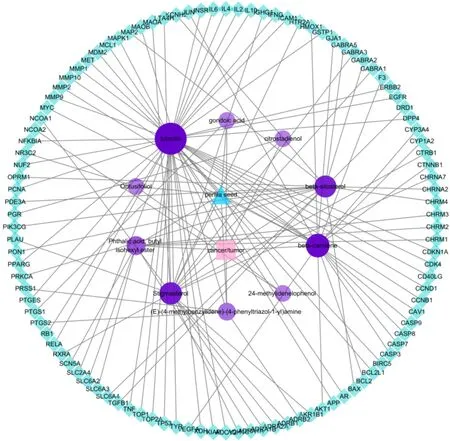
图2 紫苏籽活性成分-抗癌和抗肿瘤靶点网络Fig.2 Perilla seed active ingredients-anti-cancer and anti-tumor target network
2.4 蛋白质相互作用网络构建
应用STRING在线平台对紫苏籽的72个潜在抗癌和抗肿瘤靶点进行PPI蛋白互作网络分析,设置物种为“Homo sapiens”(人类),将蛋白相互作用评分置信度设置为0.900,隐藏离散的靶点,获得 PPI网络图(如图3)。该网络中包含72个节点,241条边,平均节点度为 6.69。根据节点度值大小,关键靶点依次有肿瘤抑制蛋白 p53(TP53)、RAC-α丝氨酸/苏氨酸蛋白激酶(AKT1)、丝裂原激活的蛋白激酶1(MAPK1)、禽肉瘤病毒 17的转化基因(JUN)、肿瘤坏死因子(TNF)、转录因子 p65(RELA)、白介素 6(IL6)、血管内皮生长因子 A(VEGFA)、Myc原癌基因蛋白(MYC)、G1/S-特异性周期蛋白-D1(CCND1)、半胱天冬酶 3(CASP3)、人连环蛋白β1(CTNNB1)、视网膜母细胞瘤蛋白 1多克隆抗体(RB1)、半胱氨酸蛋白酶8(CASP8)、细胞周期素依赖性激酶抑制因子 1A(CDKN1A)、表皮生长因子(EGFR)这些靶蛋白在 PPI 网络中具有重要地位,与其他多个靶点相连,可能与紫苏籽发挥抗癌和抗肿瘤作用关系密切。

图3 紫苏籽潜在抗癌和抗肿瘤靶点的PPI网络Fig.3 PPI Network of potential anti-cancer and anti-tumor targets of perilla seed
2.5 GO功能富集分析
将紫苏籽 72个潜在抗癌和抗肿瘤靶点进行GO 富集分析(见图4),获得607条生物学过程条目,其中P<0.05的生物学过程有330条,富集的前 30个生物学功能依次为对药物的反应(23个靶点)、凋亡过程的负调控(22个靶点)、从RNA聚合酶II启动子转录的正调控(27个靶点)、对雌二醇的反应(12个靶点)、肝再生(8个靶点)、在没有配体的情况下的外在凋亡信号通路(8个靶点)、一氧化氮生物合成过程的正调控(8个靶点)、积极调控细胞增殖(16个靶点)、基因表达的正调控(13个靶点)、对有毒物质的反应(9个靶点)、酶结合(24个靶点)、相同的蛋白质结合(23个靶点)、蛋白质结合(64个靶点)、蛋白质异二聚活性(17个靶点)、转录因子结合(13个靶点)、蛋白质复合物结合(10个靶点)、BH3域绑定(4个靶点)、蛋白质均二聚活性(16个靶点)、细胞因子活性(9个靶点)、泛素蛋白连接酶结合(10个靶点)、膜筏(11个靶点)、胞质溶胶(34个靶点)、核质(30个靶点)、核(42个靶点)、细胞表面(13个靶点)、细胞外空间(19个靶点)、蛋白质复合物(11个靶点)、小窝(6个靶点)、细胞质(39个靶点)、受体复合体(7个靶点)。

图4 紫苏籽潜在抗癌和抗肿瘤靶点GO功能富集结果柱形图Fig.4 Bar graph of GO enrichment results of potential anti-cancer and anti-tumor targets of perilla seed
2.6 KEGG信号通路分析
对紫苏籽 72个潜在抗癌和抗肿瘤靶点进行KEGG通路注释分析,获得 108条信号通路条目,其中P<0.05的通路有102条,富集的前20条通路分析结果见表3,包括膀胱癌(Bladder cancer)、甲状腺癌(Thyroid cancer)、胰腺癌(Pancreatic cancer)、子宫内膜癌(Endometrial cancer)、前列腺癌(Prostate cancer)、小细胞肺癌(Small cell lung cancer)、大肠癌(Colorectal cancer)、胃癌(Gastric cancer)、乳腺癌(Breast cancer)等通路,KEGG富集分析可视化图见图5,其中Rich Factor(富集因子)数值越大代表富集程度越大;Pvalue经过多重校验的P值,用绿色-红色表示,颜色越红代表P值越小,说明富集越明显。

表3 紫苏籽抗癌和抗肿瘤靶点的KEGG通路富集Table 3 Enrichment of KEGG pathway for anti-cancer and anti-tumor targets of perilla seeds

续表3
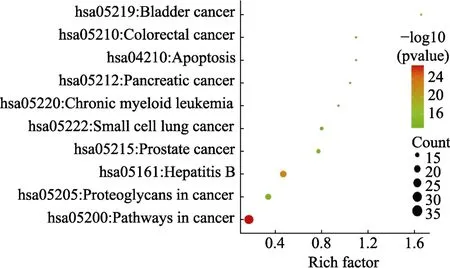
图5 KEGG富集分析可视化图Fig.5 Visualization of KEGG enrichment analysis

2.7 分子对接结果
由表4可知,三个靶蛋白与紫苏籽的三种活性成分木犀草素、豆甾醇和β-胡萝卜素的结合能均小于-5 KJ/mol,以上靶点和活性成分均可自发结合且结合的可能性较高。分子对接的结果还要参考结合常数 Ki和氢键个数来判断最终结合的概率,一般来说,结合常数Ki越小越好,氢键个数越多越好。因此对接活性最好的是木犀草素和TP53,二者的对接模型见图6。

表4 紫苏籽活性成分与抗癌抗肿瘤潜在作用靶点的分子对接结果Table 4 Results of molecular docking between active components of perilla seeds and potential anti-cancer and anti-tumor targets

图6 紫苏籽抗癌的有效靶点在癌症通路中的富集分析Fig.6 Enrichment analysis of effective anti-cancer targets of perilla seeds in cancer pathways

图7 TP53与木犀草素分子对接模型Fig.7 Molecular docking model of TP53 and luteolin

图8 TP53与木犀草素分子对接2D模式图Fig.8 2D model diagram of TP53 and luteolin target-molecular docking
3 讨论与结论
紫苏籽是我国宝贵的药食同源资源之一,其中含有花生四烯酸、木犀草素、β-谷甾醇、豆甾醇、类胡萝卜素等多种丰富的活性成分,这些成分在人体中能够发挥多重作用,达到防病治病的效果。有关研究结果显示,从先天的遗传突变,激素影响到日常生活中的烟草,饮食,辐射等都是诱发癌症的因素之一[23]。其中日常的饮食中摄入脂肪的含量和种类是与患癌风险有一定相关性的,这提示我们可以从饮食方面预防癌症,干预癌症的治疗。紫苏籽的提取物有一定的抗癌抗肿瘤作用,但是其主要活性成分和作用机制尚未得到验证。通过网络分析,获得紫苏籽17种主要活性成分,72个抗癌抗肿瘤靶点,其中木犀草素、β-谷甾醇、豆甾醇、类胡萝卜素与靶点、通路的关联度最高,在紫苏籽活性成分-抗癌抗肿瘤靶点网络中与众多疾病靶点互相连接,由此可知,这些成分是紫苏籽抗癌抗肿瘤的重要基础。通过PPI蛋白网络分析可视化我们可以看到与紫苏籽对癌症肿瘤发挥作用的关键靶点分别为:AKT1、TP53、MAPK1、JUN、TNF、RELA、IL6、VEGFA、CASP3、CTNNB1、CCND1、MYC等,参考查阅文献可知,AKT1[24-25]是与乳腺癌相关的靶点;TP53[26]是与乳腺癌、肺癌、脑瘤和肾上腺皮质癌相关的靶点;MAPK1是与宫颈癌[27]、胃癌[28]、胰腺癌[29]等相关的靶点。
通过分子对接,我们发现木犀草素与 TP53的对接活性最好,自发结合的可能性最大。紫苏籽中的木犀草素属于黄酮类物质,研究表明,黄酮类成分对高血压、炎症、过敏症、癌症等有一定的预防和治疗作用。其中的抗癌特性与细胞活力下降、细胞周期停滞、细胞凋亡的诱导、转移和抑制肿瘤血管的生成有关[30]。木犀草素能够抑制很多类型的癌细胞的增殖。例如,木犀草素能够阻滞人类胃癌和前列腺癌以及黑色素瘤细胞的G1期细胞周期;木犀草素诱导黑色素瘤细胞G1期阻滞与抑制 CDK2活性有关等。Chian等分别给予生理盐水、单纯顺铂、单纯木犀草素或顺铂+木犀草素联合治疗小鼠非小细胞肺癌,发现木犀草素能抑制无胸腺裸鼠皮下生长的非小细胞肺癌细胞系 A549细胞的异种移植肿瘤的生长[31];木犀草素可以结合和抑制DNA拓扑异构酶I和II,这两种酶是修复受损 DNA所必需的,并直接嵌入底物DNA,导致DNA双链断裂。木犀草素的这一作用通过p53介导的p21/waf1表达诱导细胞周期停滞[32],另外 Kang等[33]发现木犀草素可以增加Nrf2和p53之间的相互作用,增加了抗氧化酶和凋亡相关蛋白的表达,进而使得木犀草素有很好的抗结肠癌效果。文献中的信息与网络药理学KEGG信号通路分析所得的结果保持一致。
本研究采用网络药理学和分子对接的方法初步分析了紫苏籽对癌症和肿瘤的治疗作用,预测了紫苏籽抗癌抗肿瘤的潜在靶点以及相关的信号通路和生物过程,揭示了紫苏籽抗癌抗肿瘤是多成分、多靶点、多通路共同作用的结果。中药网络药理学是古代中医药和现代药物发展领域在网络、药理学、生物学以及计算机之间的跨学科领域的发展与融合,通过数据库中大量的数据整合与计算预测,通过网络可视化挖掘出紫苏籽的主要活性成分、抗癌抗肿瘤作用靶点和通路,为紫苏籽的抗癌抗肿瘤研究提供理论依据。本研究对紫苏籽抗癌抗肿瘤的作用机制及未来的实验验证提供了理论依据,以期对后期的药物开发和临床应用提供参考。
备注:本文的彩色图表可从本刊官网(http:// lyspkj.ijournal.cn)、中国知网、万方、维普、超星等数据库下载获取。
