乙脑病毒RT-LAMP快速检测新方法的建立
2021-12-03卓泽文林彦汐李名志杨自兵朱丽婷孔令保江西农业大学生物科学与工程学院330045
卓泽文,林彦汐,李名志,杨自兵,朱丽婷,孔令保, 王 婷(江西农业大学生物科学与工程学院 330045)
流行性乙型脑炎是由乙型脑炎病毒(Japanese Encephalitis Virus,JEV)引起的一种蚊媒性人兽共患传染病[1,2],在我国属乙类传染病,每年夏秋季重点传染病防控、灾后疫情防控都将其列为重点。另一方面,JEV给养猪业造成了很大的经济损失,仔猪、种猪、母猪感染后会导致繁殖障碍、流产甚至死亡[3,4]。近年来,随着养猪集约化程度的提升,大中型养猪企业受养殖量大、物流运输广等因素影响,致使多种病原菌混合感染、新病原菌感染、病原菌突变种感染等情况多发,难以判断致病原因,因此急需一种特异性强、灵敏度高、操作简便、成本较低的诊断方法。
2000年,Notomi T等[5]在《Nucleic Acids Research》上报道了一种环介导等温扩增(LAMP)技术,该方法通过采用具有高链置换活性的Bst DNA聚合酶,针对目的基因上的六段区域设计四条引物,在等温条件下、1h左右,高效、特异地扩增目的基因,反应结果可视化。一直以来,LAMP技术以其特异性强、灵敏度高、反应时间短、设备简单且鉴定便捷及时而受到研究人员青睐[6-11]。此项技术经过20年的发展,在指示剂、辅助剂、储存方法等方面得到了极大的发展[8-16]。特别是Bst 3.0 DNA聚合酶,加入了逆转录酶活性。因此本试验基于实验室保存的相关材料,以JEV P3病毒株为模板,使用Bst 3.0 DNA聚合酶利用RT-LAMP技术进行反应,建立一种新型、灵敏、快速、实用的JEV检测方法。
1 材料与方法
1.1 生物材料
JEV P3病毒株,BHK-21细胞,E.coli DH5α菌株,pET-28a-LTB-NS1重组质粒均由本实验室保藏。
1.2 主要试剂
质粒小提试剂盒购自天根生化科技有限公司;TRIzol RNA分离试剂购自Ambion公司;甜菜碱、钙黄绿素、DMSO购自Solarbio公司;100mmol· L-1MnCl2溶液购自Sigma公司;2k DNA Marker购自康体生命科技有限公司;逆转录试剂盒PrimeScriptTMRT reagent Kit、核酸电泳10× Loading buffer购自TaKaRa公司;Bst 3.0 DNA聚合酶及其缓冲液、100mmol· L-1MgSO4购自NEB公司;2.5mmol· L-1dNTPs购自北京全式金生物技术有限公司;琼脂糖购自GenStar公司;DEPC水购自生工生物工程(上海)股份有限公司;氯仿、异丙醇、无水乙醇购自西陇化工股份有限公司。
1.3 仪器设备
PCR仪——美国Bio-Rad公司;凝胶成像分析系统——上海勤翔科学仪器有限公司;琼脂糖水平电泳仪——上海天能科技有限公司。
1.4 引物设计与合成
根据实验室已有的生物材料,将JEV NS1序列导入在线设计软件Primer Explorer V5 (http: //primerexplorer.jp/e/v5_manual/index.htmL)设计并筛选出一组LAMP引物,引物序列为JEV-F3 5′-GCGGAGTCAGATCTGTCACT-3’, JEV-B3 5’-TTCCGGGGCAAAGAGGAT-3’, JEV-FIP 5’-ACCACACTGAGGTCCACTGCATTCACCAAATGTGGGAAGCCGTAAG-3’和JEV-BIP 5’-TATCGCTCAGCCCCTAAACGCCTTCCCCATGCTTTCCAGCC-3’。扩增片段长度为217bp, 引物由北京擎科生物科技有限公司合成,工作浓度为10μmol· L-1。
1.5 模板的提取及PCR和RT-PCR检测
提取E.coli DH5α-pET-28a-LTB-NS1重组质粒,质粒的提取参照质粒小提试剂盒说明书,并保存在-20℃冰箱;以NS1重组质粒为模板,分别以内引物和外引物做PCR反应,检测引物的特异性。采用TRIZOL法提取JEV P3病毒株核酸,利用cDNA Mix逆转录试剂盒获得JEV cDNA,然后以JEV cDNA为模板,利用设计的内引物和外引物进行PCR反应。
外引物PCR体系为: 2× Cata Amp Taq PCR Mix 10μL,外引物0.4μL,模板0.4μL,补加ddH2O至20μL。反应程序为: 94℃ 5min;94℃ 30s,54℃ 30s,72℃ 30s,30个循环;72℃ 10min,37℃ 10s。内引物PCR体系为: 2× Cata Amp Taq PCR Mix 10μL,内引物0.4μL,模板0.4μL,补加ddH2O至20μL。反应程序为: 94℃ 5min;94℃ 30s,56℃ 30s,72℃30s,35个循环;72℃ 10min,37℃ 10s。反应结束后,用0.8%的琼脂糖凝胶进行电泳,缓冲溶液为TAE溶液。
1.6 LAMP反应体系及反应条件的优化
LAMP反应体系成分包括: 外引物F3/B3、内引物FIP/BIP、dNTPs、Bst 3.0 DNA 聚合酶、10×等温扩增缓冲液Ⅱ(1×缓冲溶液含2mmol· L-1MgSO4)、MgSO4、甜菜碱、模板、ddH2O。Bst 3.0 DNA聚合酶使用说明书推荐的LAMP反应体系中各组分终浓度分别为: 1×等温扩增缓冲液Ⅱ(含2mmol·L-1MgSO4)、6mmol· L-1MgSO4(共 计8mmol· L-1MgSO4)、0.2μmol· L-1外引物F3/B3、1.6μmol· L-1内引物FIP/BIP、0.32U·μL-1Bst 3.0 DNA聚合酶,1.4mmol· L-1dNTPs、DNA或RNA模板>10拷贝。
以Bst 3.0 DNA聚合酶使用说明书推荐的体系为基础,并结合相关文献报道[3,4,14,18,21],以质粒DNA为模板,采取单因素试验,对反应温度(65、66、67、68、69、70℃)、甜菜碱浓度(0.4、0.6、0.8、1.0、1.2mol· L-1)、Mg2+浓度(4、6、8、10mmol· L-1)、Bst 3.0 DNA聚 合 酶 浓 度(0.08、0.16、0.24、0.32U·μL-1)等进行优化,确定最佳的反应体系。
1.7 可视化检测的建立
本试验采用钙黄绿素-MnCl2作为可视化指示剂,钙黄绿素溶于DMSO后再稀释至工作浓度。依据已有的文献报道[14]及反应前后颜色深浅的比较,确定MnCl2的终浓度为0.5mmol·L-1,钙黄绿素终浓度为40μmol· L-1。
1.8 JEV-RT-LAMP检测
BHK-21细胞用含有10%胎牛血清的DMEM培养基培养,铺满密度约80%时接种JEV P3株病毒,约80% 细胞出现病变时收获细胞,提取样本总RNA并立即加入LAMP反应体系进行反应,验证LAMP反应体系的可行性。
2 结果与分析
2.1 引物特异性验证
为了验证针对JEV NS1设计的引物的特异性,分别以NS1重组质粒和JEV P3病毒株的cDNA为模板进行PCR扩增,另外以ddH2O为阴性对照,结果(图1)显示以NS1质粒(泳道2和5)和JEV cDNA(泳道3和6)为模板时扩增得到条带,而阴性对照组(泳道1和4)未出现条带,表明设计的引物与模板均能够很好的匹配。
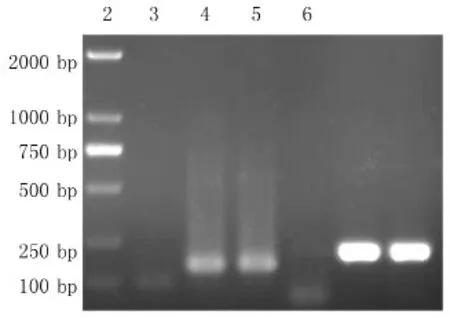
图1 模板材料验证
2.2 LAMP反应体系条件的优化
以JEV NS1重组质粒为模板,ddH2O为阴性对照,采取单因素试验,对反应温度(65、66、67、68、69、70℃)、甜菜碱 浓 度(0.4、0.6、0.8、1.0、1.2mol· L-1)、Mg2+浓 度(4、6、8、10mmol· L-1)、Bst 3.0 DNA聚合酶浓度(0.08、0.16、0.24、0.32U·μL-1)进行优化。反应1h后,80℃ 5min终止反应;置于4℃冰箱冷却10min后用2%琼脂糖凝胶电泳,缓冲溶液为TAE溶液。
根据凝胶电泳结果显示,最佳反应温度为67℃(图2);最佳甜菜碱浓度为0.8mol· L-1(图3);最佳Mg2+浓度为4mmol· L-1(图4);最佳酶终浓度为0.32U·μL-1(图5)。
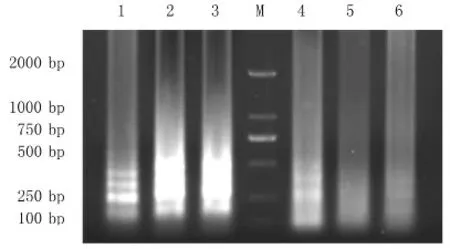
图2 LAMP反应温度优化

图3 甜菜碱终浓度优化

图4 Mg2+浓度优化
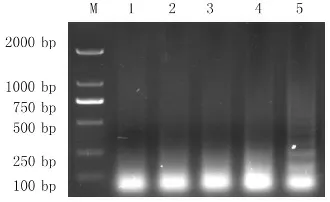
图5 酶终浓度优化
通过上述试验探索确定了LAMP反应的最佳体系。在20μL的体系中,各组分终浓度分别为: 1×等温扩增缓冲液Ⅱ(含2mmol· L-1Mg2+)、0.2μmol· L-1外引物F3/B3、1.6μmol·L-1内引物FIP/BIP、0.8mol· L-1甜菜碱、0.32U·μL-1Bst 3.0 DNA聚合酶、2mmol· L-1MgSO4,2μL dNTPs、0.5μL模板,补加ddH2O至20μL。
2.3 可视化检测的建立
在体系中加入钙黄绿素-MnCl2指示剂,阴性结果为橘黄色,阳性结果为绿色,通过配以绿色背景可以增加色差,辅助判断(图6)。

图6 可视化检测的建立
2.4 JEV-RT-LAMP检测
提取接种JEV P3病毒株的BHK-21细胞总RNA,立即加入LAMP反应体系进行反应,以DEPC水为阴性对照,使用3%琼脂糖凝胶电泳,结果显示LAMP体系能够实现对JEV核酸的一步快速检测(图7)。

图7 JEV病毒核酸RT-LAMP检测
3 讨论
JEV严重危害我国人畜健康,虽然自2007年起,乙脑疫苗加入国家免疫规划,有效地降低了我国乙型脑炎发病率,但由于我国的气候条件、农业生产等诸多因素影响,个别省份的乙型脑炎发病率并未明显下降,在2014年中国疾控中心就表示部分地区乙脑反弹的情况,并且我国JEV的流行株也从基因Ⅲ型转为基因Ⅰ型[17],因此研发一种新型的JEV快速检测试剂十分必要。
而目前商业诊断试剂市场上针对JEV的血清学检测的诊断效果有限,且成本高昂。核酸检测成本较低,但常规RT-PCR和real-time PCR等仍存在着时间长、操作复杂的问题。这些方法都需要配备十分昂贵的相关精密仪器设备,人员也要经过技术培训,限制了它们在病毒快速诊断中的应用,很难在野外、灾区、基层实验室和猪场推广使用。而LAMP技术的提出打破传统核酸扩增技术需要温度循环的常规,十分符合WHO制定的“ASSURED”诊断试剂标准,为核酸扩增技术普及、条件不足的基层开展现场检测提供了方便[3,4]。
JEV属于RNA病毒,传统的LAMP反应使用的Bst DNA聚合酶没有逆转录活性,以往包括近些年的一些研究都是通过混合逆转录酶实现对JEV核酸的检测,如杜鹃[4]等研究者以LAMP技术为核心建立了两步法和一步法两种检测JEV的方法,周玉鹏等[18]也建立了检测基因Ⅰ型和基因Ⅲ型JEV的RTLAMP方法。而Bst 3.0 DNA聚合酶的出现能够直接针对RNA进行逆转录等温扩增,使检测更加便捷高效[19],但相关报道不多。Silva等[19,20]使用Bst 3.0 DNA聚合酶实现对寨卡病毒的RT-LAMP检测,表示Bst 3.0 DNA聚合酶在RNA酶抑制剂存在的条件下依然不影响其活性;高彦萍等[21]使用Bst 3.0 DNA聚合酶实现对马铃薯卷叶病毒的RT-LAMP检测,但凝胶电泳显示梯状条纹并不清晰。因此本研究通过试验,进一步明确了Bst 3.0 DNA聚合酶的高逆转录活性和DNA聚合酶活性。
关于LAMP检测的高特异性和高灵敏度方面,已经有大量文献证实[4-10,12,19,20],在指示剂、辅助剂、储存方法等方面的发展也有大量文献报道[8-10,12-16],本文不在赘述。本试验前期依据Notomi T等[5]在《Nucleic Acids Research》上发表的原始文献设计引物,极易形成引物二聚体,加之65℃左右的恒温不足以打开NS1质粒的双链,LAMP反应过程又极易造成气溶胶污染,对结果判定造成极大干扰。因此我们认为,在准备LAMP实验过程中,引物的设计极为重要,应当避免引物间3′端配对,产生引物二聚体。实验过程中,应当将电泳区与体系的反应与配制区分开,反应完成后置于4℃静置10min后再电泳,这些举措能够减少气溶胶的产生和对实验造成的污染。甜菜碱对LAMP的辅助能力,不同文献评价不一[4,14,21],本试验结果表明甜菜碱对LAMP反应有着积极的作用,能够使反应效率提升。
4 结论
综上所述,本试验建立的新方法通过使用高逆转录活性和DNA聚合酶活性的Bst 3.0 DNA聚合酶,实现乙脑病毒RNA核酸的一步快速检测,为研制一款灵敏度高、特异性强、检测成本低、可在猪场和基层实验室简单操作的JEV快速检测试剂盒提供了重要的参考,也为今后研发针对RNA病毒核酸的高效检测方法提供了经验。
