丝球小奥德蘑白色菌株特异性标记开发*
2021-12-01崔玉进荣成博董永强宋庆港宋忠娟王守现
崔玉进 ,荣成博 ,高 琪 ,董永强 ,3,宋庆港 ,刘 宇,宋忠娟,王守现**
[1.北京市农林科学院植物保护环境保护研究所,北京 100097;2.北京市食用菌工程技术研究中心,北京 100097;3.中国农业大学园艺学院蔬菜系,北京 100094;4.京科智宝(北京)农业科技有限公司,北京 100097]
小奥德蘑属(Oudemansiella) 包括卵孢小奥德蘑 (Oudemansiella raphanipes)、丝球小奥德蘑(Oudemansiella apalosarca)、褐褶边小奥德蘑(Oudemansiella brunneomarginata)、拟粘小奥德蘑(Oudemansiella submucida)、厚褶小奥德蘑(Oudemansiella crassifolia)、鳞柄小奥德蘑(Oudemansiella furfuracea) 等多个种[1-6],子实体菌盖色泽多样,包括褐色、灰色、白色、土黄色等,且富含蛋白质、碳水化合物、多种维生素及矿物质元素,具有抗氧化、抑制肿瘤细胞增殖等作用[7-8]。因此,小奥德蘑属是一类适宜观光采摘、具有健康功能的珍稀食用菌,迄今为止,国内外关于小奥德蘑栽培生产的报道相对较少。国内主要栽培的品种为卵孢小奥德蘑,该品种栽培中存在的主要问题是出菇需覆土,工作量大,重茬问题严重,菌袋后熟时间长,约30 d〜45 d,出菇周期长[9]。丝球小奥德蘑是新驯化成功的一类食药兼优且具有较高商品价值的珍稀食用菌,具有菌丝生长速度快、出菇周期短、不需覆土等优点,充分弥补了卵孢小奥德蘑的不利因素,但目前尚无成熟的广泛栽培品种。丝球小奥德蘑菌株JZB2115081菌株子实体白色,原基多,但菌柄短,易开伞,产量低,不适于生产栽培;JZB2115055菌株具有产量高、味道鲜美等优点,但子实体整齐度不高。为了增加小奥德蘑属优良栽培品种的多样性,选育兼具2种菌株优点的高产、洁白、商品性状好的丝球小奥德蘑杂交新菌株势在必行。
丝球小奥德蘑菌株JZB2115055和菌株JZB2115081菌落特征相似,且锁状联合较少不易观察,增加了杂交菌株的鉴定难度。因此研究拟开发丝球小奥德蘑菌株JZB2115081的特异性扩增标记,准确、快速地对2个菌株的杂交后代进行鉴定,筛选具有菌株JZB2115081特性且兼有菌株JZB2115055优良性状的杂交新菌株,缩短育种周期,为其他食用菌优良菌株的选育提供理论支撑。
1 材料和方法
1.1 材料
1.1.1 试验菌株
菌株JZB2115055和菌株JZB2115081经中国科学院昆明植物研究所郝艳佳博士鉴定均为丝球小奥德蘑(Oudemansiella apalosarca)。采用PDA综合培养基对野外采集的子实体进行组织分离,3 d〜5 d菌丝萌发后转管,置于25℃下避光培养,多次纯化后获得母种,菌丝洁白。
野生和人工栽培的子实体形态见图1和图2,供试菌株具体信息见表1。

图1 菌株JZB2115055与菌株JZB2115081的野生子实体Fig.1 The fruit bodies of strain JZB2115055 and JZB2115081 in nature
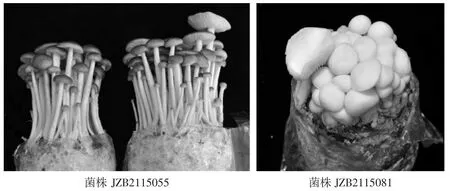
图2 菌株JZB2115055与菌株JZB2115081的人工栽培子实体Fig.2 The cultivated fruit bodies of strain JZB2115055 and JZB2115081

表1 试验所用菌株Tab.1 Strains used in the experiment
1.1.2 培养基
PDA综合培养基:马铃薯200 g去皮,切成1 cm3小块后用开水煮至熟而不烂,用纱布过滤后在液体中加入琼脂20 g,加热完全溶解后再加入葡萄糖20 g、蛋白胨5 g、磷酸二氢钾3 g、硫酸镁1.5 g、VB110 mg,去离子水1 L,将上述物质全部加热溶解后装入三角瓶中,121℃高压灭菌30 min。
LB MILLER琼脂和LB MILLER肉汤购自美国BD公司。
1.2 方法
1.2.1 培养
用PDA综合培养基25℃条件下暗光培养丝球小奥德蘑菌株JZB2115055与JZB2115081菌丝。
1.2.2 丝球小奥德蘑菌株的DNA提取
菌丝长好后,分别刮取2个菌株的菌丝100 mg,采用QIAGEN公司的DNeasy Plant Mini Kit试剂盒提取DNA;用紫外可见光分光光度计检测DNA浓度,将2个菌株的DNA浓度调到20 μg·mL-1〜50 μg·mL-1,并保持一致;-20℃保存备用。
1.2.3 PCR反应体系和反应条件
选择27种ISSR引物分别以2个菌株的DNA为模板进行PCR扩增。所用的ISSR引物的序列详见表2。
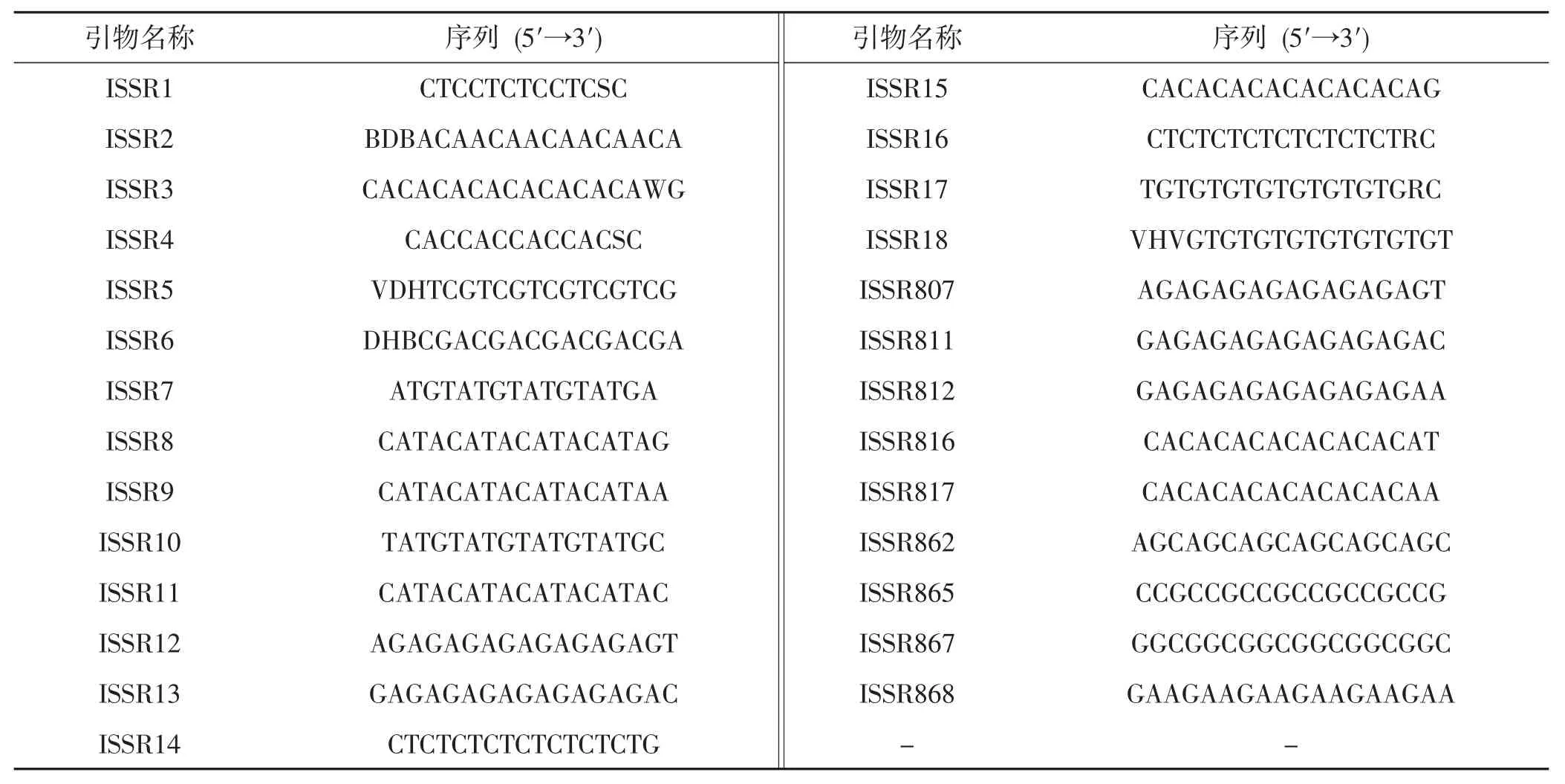
表2 试验所用ISSR引物序列Tab.2 Sequence of ISSR primers used in the experiment
反应总体积为 50 μL,含有 25 μL 2× Taq PCR Master Mix,10 μmoL·L-1引物 (各 2 μL),DNA 2 μL,加灭菌双蒸水补充总体积至50 μL。将反应液按上述体积加入0.2 mL离心管中,混匀放入PCR仪中。PCR扩增条件:94℃预变性4 min,循环参数为94℃变性 30 s,48℃退火 1 min,72℃延伸 1.5 min,共35个循环,72℃延伸7 min。扩增产物进行琼脂糖凝胶电泳,引物ISSR807和ISSR812与2个菌株DNA的PCR体系凝胶电泳见图3和图4。
将菌株JZB2115081的特异性片段进行切胶回收,与pMD19-T载体的连接,连接产物转化大肠杆菌Top10感受态细胞,经蓝白斑筛选和菌落PCR验证连接正确后委托北京诺赛基因组研究中心有限公司测序。
1.2.4 特异性引物开发
获得测序结果后利用DNAman软件设计引物,引物长度为18 bp〜25 bp,委托生工生物工程(上海)股份有限公司合成。引物验证PCR反应的体系为:总体积为 25 μL,含有 12.5 μL 2 × Taq PCR Master Mix,10 μmoL·L-1引物 (各 1 μL),DNA 1 μL,加灭菌双蒸水补充总体积至25 μL。将反应液按上述体积加入0.2 mL离心管中,混匀放入PCR仪中进行PCR扩增。PCR扩增条件为95℃预变性4 min,循环参数为 95℃变性 30 s,55℃退火 30 s,72℃延伸 2 min,共30个循环,72℃延伸10 min。
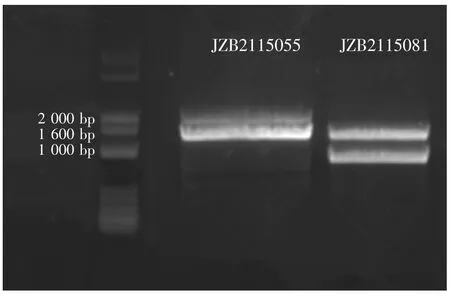
图3 引物ISSR807分别与2个菌株DNA的PCR体系凝胶电泳图Fig.3 PCR amplification results of primer ISSR 807 and DNA of two strains
2 结果与分析
2.1 丝球小奥德蘑菌株JZB2115081特异性序列的获得
27对ISSR引物共筛选出10条丝球小奥德蘑菌株JZB2115081相对于菌株JZB2115055的特异性扩增片段,经克隆测序获得了7条特异性的DNA序列,并以这些特异性序列为模板设计了7对引物,见表3。
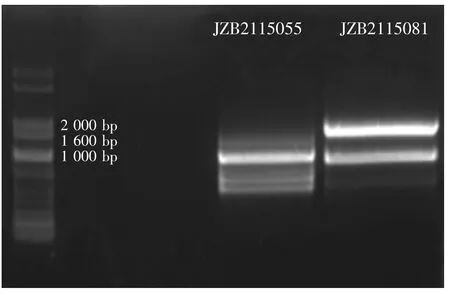
图4 引物ISSR812分别与2个菌株DNA的PCR体系凝胶电泳图Fig.4 PCR amplification results of primer ISSR 812 and DNA of two strains

表3 7对设计得到的引物Tab.3 7 pairs of primers designed
2.2 ISSR筛选丝球小奥德蘑特异性引物
从7对引物中,共得到2对可特异性区分丝球小奥德蘑菌株JZB2115081与丝球小奥德蘑菌株JZB2115055的序列特异性扩增标记,命名2对引物序列分别为8071F/R、8122F/R,见表4。
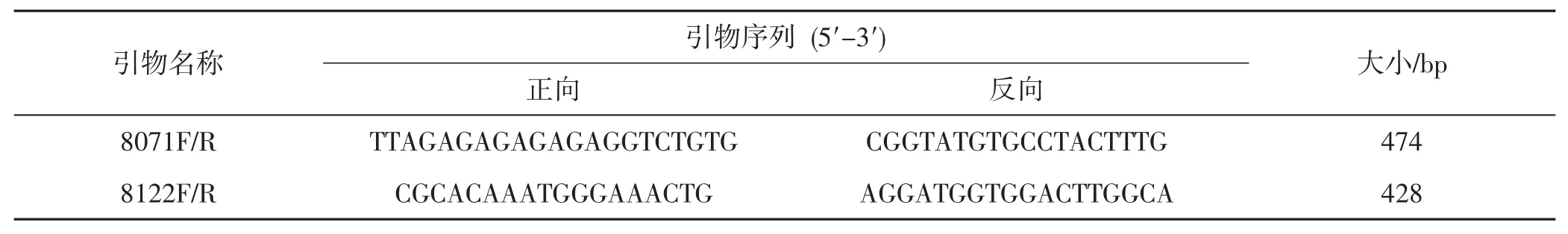
表4 2对特异性引物Tab.4 2 pairs of specific primers
以2个菌株DNA为模板,用8071F/R、8122F/R、ITS、无特异性引物进行扩增后的凝胶电泳图见图5。
如图5所示,上述2对序列特异性扩增标记在以丝球小奥德蘑菌株JZB2115081的DNA为模板扩增后各有一条DNA条带,2条DNA片段大小在400 bp〜500 bp,条带大小分别为474 bp和428 bp。丝球小奥德蘑菌株JZB211505的DNA则无扩增条带。同时以2个菌株DNA为模板,用ITS引物、无特异性引物分别进行扩增来做为阳性对照,2个菌株都有相应的ITS引物条带和无特异性条带,证明提取的DNA效果良好。

图5 2对特异性引物与阳性对照PCR体系凝胶电泳图Fig.5 PCR amplification results of 2 pairs of specific primers and positive control
3 讨论
食用菌常见的育种方法包括杂交育种[10]、选择育种[11]、诱变育种[12]和原生质体融合育种[13]等。其中杂交育种是获取优质新品种方法中比较常用和有效的方法之一,该方法可以迅速获得新的农艺性状并具有简便、高效、目的性强等优势[14]。
目前如何高效筛选出在杂交育种中无明显锁状联合的成功杂交菌株是加快食用菌杂交育种效率的关键环节。传统的鉴定方法要根据菌株的形态特征或生化指标等进行区分鉴定,但该方法耗费时间长且易受环境和个别菌株自身生理差异影响,实际应用过程中存在诸多困难。
随着分子生物学技术的发展,目前已经开发出了多种基于DNA多态性的分子标记辅助食用菌育种。如林范学等[15]运用随机扩增多态(RAPD)技术对来源于2个香菇(Lentinus edodes) 双核菌株的孢子单核体、原生质体单核体及其杂交后代进行分析。结果表明,用9个随机引物共扩增出116条DNA片段,其中82.5%具有多态性。综合分析9个随机引物的扩增谱带,可将所有供试亲本的单核体清楚分开,且单核体聚类分析结果与其来源及遗传背景相吻合。此外,用2个双核亲本菌株的4个不同交配型孢子单核体两两交配,所得的杂交组合也可与双核亲本菌株明确地区分开来。余志晟等[16]应用限制性片段长度多肽 (RFLP) 技术对 12株草菇(Volvariella volvacea)菌株的核糖体、线粒体和基因组总DNA的多态性进行了研究,结果表明供试菌株间遗传差异很小,为草菇的育种提供资料。荣成博等[17]利用特征片段扩增区域(SCAR)技术研究开发了特异性引物对P826-1-2XF/R,从而实现了对丝球小奥德蘑菌株JZB2115055的快速鉴定和保护。简单重复序列区间(ISSR)引物和相关序列扩增多肽性(SRAP)引物在食用菌育种过程亲本亲缘关系的分析中也有应用。武海月等[18]应用ISSR引物、SRAP引物将19个供试榆黄蘑(Pleurotus citrinopileatus)菌株分为四大类,研究表明这19个供试菌株间具有较大的遗传差异,聚类分析图为杂交育种的亲本选择提供分子水平的依据。
小奥德蘑属真菌的研究近些年主要集中于栽培与驯化方面,相关生活史、遗传机理与育种研究鲜见报道,亟待通过育种定向解决实际生产中遇到的问题。本研究开发了JZB2115081菌株的特异性扩增分子标记,以引物ISSR807和ISSR812扩增时,丝球小奥德蘑JZB2115081菌株各出现了一条区别于丝球小奥德蘑菌株JZB2115055的特异条带,获得这组条带的DNA序列,以此DNA序列设计的2对特异性引物对8071F/R、8122F/R。在丝球小奥德蘑菌株JZB2115081中分别可以特异性的扩增出一条大小在400 bp〜500 bp之间的条带,长度分别为474 bp和428 bp,而这2对引物在丝球小奥德蘑菌株JZB2115055中未扩增出目的条带。本引物为开展双单杂交后代的鉴定提供了快速、准确的方法,节省了获得菇型好、颜色洁白、产量高的丝球小奥德蘑优质新菌株的时间,拓宽了相关育种工作的思路,为加快其他品种食用菌的育种进程提供了解决方案。
丝球小奥德蘑菌株除可以在一定程度上丰富我国当前食用菌市场种类多样性外还具有较高的医疗开发潜力,丝球小奥德蘑的菌丝体乙酸乙酯提取物可抑制克鲁斯式念珠菌(Candida krusei)、丝球念珠菌(Candida tropicalis)、光滑念珠菌 (Candida glabrata)活性[19],还可抑制人肾癌细胞(TK-10)、人淋巴细胞的活性和增殖[20]。丝球小奥德蘑在提供食用价值的同时也是一座极具开发潜力的药用资源宝库。
我国幅员辽阔,菌类资源丰富,食用菌市场广阔,目前尚有很多类食用菌未实现人工栽培或未选育出适宜规模化栽培的品种,对于这部分珍稀食用菌品种的驯化和选育也必将成为以后的科研热点。
4 结论
本研究开发的区分丝球小奥德蘑菌株JZB2115081和菌株JZB2115055的特异性标记序列8071F/R、8122F/R,可直接通过PCR扩增鉴定杂交结果,大大加快育种进程,实现了简便快速鉴定菌株杂交结果的目的,为进一步加快实现丝球小奥德蘑白色高产杂交菌株的育种研究提供依据。
