雌激素对一氧化碳中毒小鼠脑白质脱髓鞘的抑制作用及机制研究*
2021-11-27李伟民田小菲田栋安刘子岩田亚汀李美玉张国徽
李伟民 田小菲 田栋安 刘子岩 田亚汀 李美玉 张国徽
迟发型脑病(Delayed Neuropathological Sequelae, DNS)是CO中毒后常见的并发症,临床症状表现为患者认知功能发生障碍及精神疾病等,其发病机制尚不明确,目前认为,CO中毒后脑组织大范围缺氧,并导致血流速度减慢,血液粘滞度增加,脑微循环发生障碍,导致脑白质发生广泛性脱髓鞘[1,2]。脱髓鞘,其特征是髓鞘的丢失和少突胶质细胞的死亡[3]。少突胶质细胞是合成髓鞘碱性蛋白(Myelin Basic Protein, MBP)的主要场所,在脑白质内呈弥散分布,本小组前期研究显示,少突胶质细胞对于CO的耐受性较其它胶质细胞弱[4],特别容易受到CO中毒的影响[5]。少突胶质细胞死亡会导致MBP合成障碍,进而引起脑白质部位脱髓鞘病变,使大脑出现神经系统功能障碍。
雌激素是一种常见的类固醇激素,具有多种作用,包括抗氧化应激、抑制细胞凋亡、调节线粒体功能等[6]。雌激素主要分为E1(Estrone)、E2(Estradiol)和E3(Estriol),其中作用最强的雌激素为E2,又名17β-雌二醇,具有重要的神经保护作用[7-10]。E2能使大脑损伤后的少突胶质细胞快速成熟,对少突胶质细胞促进髓鞘形成起保护作用[11]。E2还可减轻CO中毒后的脱髓鞘损伤,维持髓鞘结构和功能的稳定,在一定程度上阻断了DNS的发生[12]。且雄性体内的睾酮及其转化成的雌激素并不影响外源性雌激素的神经保护作用[13]。
B细胞淋巴瘤/白血病-2和腺病毒E1B19 000相互作用蛋白3(B Cell Lymphoma/leukemia-2 and Adenovirus E1B19 000 Interacting Protein 3, BNIP3)属于 B细胞淋巴瘤/白血病-2(B Cell Lymphoma/leukemia-2, Bcl-2)家族成员之一,是一种线粒体促凋亡蛋白。正常情况下,组织细胞缺氧缺血时BNIP3的表达明显增加[14]。实验证实,CO中毒可引起脑白质部位发生脱髓鞘并且激活BNIP3介导的Caspase依赖性线粒体凋亡途径[3]。雌激素可通过抑制半胱氨酸天冬氨酸蛋白酶3(Cysteinyl Aspartate Specific Proteinase 3, Caspase-3)的活性,进而阻断凋亡信号的级联反应,抑制细胞凋亡[15]。
CO中毒会引起脑白质部位脱髓鞘病变,造成神经系统受损。且目前基础研究的有关结果均揭示了雌激素对神经系统具有保护作用,但对其内在机制尚不明确,同时在雌激素作用方式的选择上也没有较好的参照标准。因此,本研究小组建立CO中毒小鼠模型,分析雌激素的最佳作用方式,并进一步分析雌激素是否通过BNIP3介导的Caspase依赖性线粒体凋亡途径对脑白质脱髓鞘发挥保护作用。
1 材料与方法
1.1 实验动物
雄性C57BL/6小鼠30只,由北京斯贝福生物科技股份有限公司提供(体重25±2g,批号:1103241911014839),饲喂环境:温度28℃,湿度50%。遵照国家实验动物管理条例以及国家实验动物管理与使用指南饲喂及处置。
1.2 主要试剂
SDS-PAGE凝胶制备试剂盒和彩虹180广谱蛋白marker(PR1910)购自Solarbio;5×蛋白上样缓冲液(ZS306)购自ZOMANBIO;RIPA裂解液(P0013B)、BCA蛋白浓度测定试剂盒(P0010)、辣根过氧化酶标记山羊抗小鼠IgG(A0216)和辣根过氧化酶标记山羊抗兔IgG(A0208)均购自上海碧云天公司;ECL化学发光试剂盒(BB-3510)购自BestBio;免疫组化染色试剂盒(SP-0023)购自Bioss;17β-Estradiol(E2758)购自Sigma;BNIP3抗体(ab109362)购自Abcam;MBP抗体(sc-66064)、Bcl-2抗体(sc-492)、Caspase-3抗体(sc-98785)和β-actin抗体(sc-47778)均购自Santa Cruz公司;其它生化试剂均为进口分装或国产分析纯。
1.3 实验方法
1.3.1 CO染毒小鼠模型制作[16]: 适应环境一周后,将小鼠置于密闭的广口瓶中,瓶内加入钠石灰(吸收小鼠呼出的二氧化碳和水分),再给予(2 500-3 000)×10-6mg/L的CO气体40min至小鼠昏迷,整个过程中确保CO浓度稳定(每隔10min采集瓶内气体,测定CO浓度),小鼠染毒后即刻采集眶血,测COHb浓度,达45-60%之间视为染毒成功,之后再将小鼠放回正常饲养环境。本实验CO 染毒小鼠模型全部造模成功。
1.3.2 动物分组及处理: 将30只小鼠用随机数字表法分为6组(n均=5):正常对照组(Control组,密闭在瓶子里,没有给予CO)、CO染毒组(CO组,按1.3.1中CO染毒模型进行处理)、雌激素预防组(E2+CO组,小鼠每日颈背部皮下注射雌激素,持续7天,之后再行CO染毒模型处理)、雌激素治疗组(CO+E2组,CO染毒模型制备成功后小鼠每日颈背部皮下注射雌激素,持续7天)、雌激素预防加治疗组(E2+CO+E2组,CO染毒前和染毒后小鼠每日颈背部皮下注射雌激素,各持续7天)。溶剂组(B+CO+B组,CO染毒前和染毒后小鼠每日颈背部皮下注射缓冲液,各持续7天)。本小组所采用的雌激素给予方法与剂量参考了Cheng等[17]实验,先用无水乙醇将雌激素稀释为50μg/ml的浓度,再用芝麻油稀释至5μg/ml的终浓度。雌激素给药量为30μg/kg/天。
1.3.3 取材: 治疗7天后,所有小鼠以10%水合氯醛腹腔注射麻醉(0.05ml/10g体重),仰卧固定,暴露心脏,灌注针插入左心室,开始灌注生理盐水,同时剪开右心耳放血,待右心耳流出清亮液体后断头,迅速剥离出大脑组织,冰上操作,一半脑组织放入4%多聚甲醛固定液中4℃固定48h,另一半将剥离出的胼胝体部位提取总蛋白,并采用BCA蛋白浓度测定试剂盒进行蛋白浓度测定,备用。
1.3.4 免疫组织化学染色观察髓鞘结构:取多聚甲醛固定液中的脑组织制作石蜡块,蜡块冠状位切片暴露出胼胝体部位,70℃烤片2h,脱蜡至水;PBS洗5min×1次;枸橼酸修复液进行抗原修复;PBS洗5min×1次;3%双氧水孵育20min;封闭用正常山羊血清工作液孵育20min;滴加I抗稀释液(MBP抗体1∶50稀释),4℃孵育过夜;37℃复温1h;PBS洗3min×3次;滴加生物素标记山羊抗小鼠IgG二抗工作液,室温孵育20min;PBS洗3min×3次;滴加辣根酶标记链霉卵白素工作液,室温孵育20min;PBS洗3min×3次;DAB显色,中性树胶封片,显微镜下观察棕黄色染色为MBP蛋白阳性区域,即髓鞘结构。
1.3.5 蛋白免疫印迹检测蛋白含量:使用RIPA裂解液从小鼠脑胼胝体中提取总蛋白;根据BCA蛋白定量试剂盒测定蛋白浓度后制样;按照各自计算的上样量上样,SDS-PAGE分离蛋白并转移到PVDF膜上;脱脂奶粉封闭2h;I抗按比例稀释(MBP抗体1∶500稀释、BNIP3抗体1∶600稀释、Bcl-2抗体1∶500稀释、Caspase-3抗体1∶500稀释和β-actin抗体1∶1 000稀释),4℃条件下孵育过夜;洗涤后,用辣根过氧化酶标记的II抗(1∶1 000稀释)室温孵育2h;经洗涤后,用ECL化学发光试剂盒显影,利用图像分析软件Image J对条带进行分析,用目的条带灰度值与内参β-actin灰度值的比值表示各目的蛋白的相对表达水平。
1.4 统计学处理
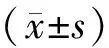
2 结 果
2.1 小鼠脑胼胝体髓鞘结构
如图1所示,Control组髓鞘质地紧密,结构正常,CO组的髓鞘结构明显脱失,E2+CO组的髓鞘脱失现象较CO组有所改善,但仍与Control组有较大差别,CO+E2组和E2+CO+E2组的髓鞘脱失现象较CO组有明显改善,接近于Control组,B+CO+B组的髓鞘脱失现象与CO组相接近。
2.2 小鼠脑胼胝体MBP蛋白表达
与Control组比较,CO组MBP表达明显降低(t=32.511,P<0.05),E2+CO组MBP表达较CO组有所回升(t=-12.895,P<0.05),但仍低于Control组,CO+E2组和E2+CO+E2组MBP表达较CO组明显回升(t分别为-53.085、-79.948,P<0.05),均接近于Control组(t分别为2.523、2.470,P>0.05)。见表1和图2。
2.3 各组小鼠脑胼胝体中BNIP3及其它凋亡蛋白表达水平比较
各组小鼠脑胼胝体中BNIP3水平差异有统计学差异(P<0.05)。与Control组比较,CO组BNIP3表达明显升高(t=-22.150,P<0.05),E2+CO组BNIP3表达较CO组有所降低(t=8.953,P<0.05),但仍高于Control组,CO+E2组和E2+CO+E2组BNIP3表达较CO组明显降低(t分别为16.059、14.086,P<0.05),接近于Control组(t分别为-2.335、-2.365,P>0.05)。见表1和图2。
蛋白免疫印迹法进一步进行CO染毒后cleaved-Caspase-3和Bcl-2的表达检测,结果显示,与Control组比较,CO组cleaved-Caspase-3表达明显升高(t=-30.008P<0.05),E2+CO组cleaved-Caspase-3表达较CO组有所降低(t=12.766,P<0.05),但仍高于Control组, CO+E2组和E2+CO+E2组cleaved-Caspase-3表达较CO组明显降低(t分别为25.405、26.025,P<0.05),接近于Control组(t分别为-1.477、-1.247,P>0.05)。同时,与Control组比较,CO组Bcl-2表达明显降低(t=21.031,P<0.05),E2+CO组Bcl-2表达较CO组有所升高(t=-5.437,P<0.05),但仍低于Control组, CO+E2组和E2+CO+E2组Bcl-2表达较CO组明显升高(t分别为-14.150、-13.197,P<0.05),接近于Control组(t分别为1.296、1.179,P>0.05)。见表1和图2。

表1 蛋白免疫印记检测各组小鼠脑胼胝体相关蛋白的表达情况
3 讨 论
DNS是CO中毒常见的并发症,其最主要的病理改变是脑白质部位发生脱髓鞘。MBP是重要的髓鞘蛋白质之一, 约占髓鞘总蛋白的40%, 其能够保证髓鞘结构的完整性和功能的稳定性,检测MBP表达的改变是反映髓鞘脱失及再生程度的一种重要手段[18],本研究小组前期研究结果显示,CO中毒会引起脑白质部位脱髓鞘病变,并伴随MBP的表达降低。本研究主要分析雌激素对于CO中毒引起的脑白质脱髓鞘病变的保护作用。

注:A,各组小鼠脑胼胝体中各蛋白免疫印迹电泳;B-E,各组小鼠脑胼胝体中BNIP3、MBP、cleaved-Caspase-3、Bcl-2蛋白表达水平直方图;与Control组比较,*P<0.05;与 CO组比较,#P<0.05图2 各组小鼠脑胼胝体中各蛋白表达
本研究通过免疫组织化学和蛋白免疫印迹的方法对不同分组处理的C57BL/6小鼠脑白质进行MBP表达检测,发现CO中毒小鼠脑组织中MBP的表达降低,雌激素对于CO中毒引起的小鼠脑组织中MBP的表达降低有保护作用。本文结果还显示,CO+E2组和E2+CO+E2组的保护作用相似,均比E2+CO组的保护效果更好。故治疗组和预防+治疗组的效果优于预防组,由于预防+治疗组需要给药次数更多,每次给药注射对实验动物也会造成一定伤害,且效果又与单纯治疗组几乎相同,故本研究在分析雌激素对于CO中毒引起的脱髓鞘病变保护作用时,发现单纯给予雌激素治疗效果等同于既预防又治疗的效果,并且此给药方式更加符合对临床患者的治疗情况。
雌激素的保护机制复杂,本研究小组前期发现CO中毒会引起少突胶质细胞发生凋亡[4]。为了进一步分析雌激素是否通过抑制CO中毒引起的细胞凋亡发挥保护作用,对细胞凋亡相关蛋白BNIP3进行了检测。BNIP3属于Bcl-2家族成员之一,是一种线粒体促凋亡蛋白,正常情况下,BNIP3的表达量非常低,当组织细胞发生缺氧缺血时可以使BNIP3的表达明显增强。蛋白印迹实验结果显示,BNIP3在CO中毒后呈现出明显升高的趋势,在给予雌激素治疗后,BNIP3的表达降低,提示雌激素能够抑制CO中毒引起的BNIP3的表达变化。
Caspase-3是BNIP3凋亡通路中的蛋白之一,BNIP3又属于Bcl-2家族成员,本实验结果显示,CO中毒引起了Caspase-3的活化,同时Bcl-2表达降低,当给予雌激素作用后,Caspase-3的活化受到抑制,Bcl-2的表达趋势变化也受到抑制。这些结果均提示,CO中毒后,可使脑白质部位发生脱髓鞘并且激活了BNIP3介导的Caspase依赖性线粒体凋亡途径。据此推测,雌激素是通过抑制凋亡蛋白BNIP3的表达,调控Bcl-2和Caspase-3介导的凋亡通路,抑制细胞凋亡,进而起到了保护髓鞘的作用。
综上所述,雌激素通过抑制BNIP3介导的Caspase依赖性线粒体凋亡途径对CO中毒所导致的脑白质脱髓鞘病变起到了保护作用,并且本研究发现,雌激素的给予方式中,单纯给予治疗措施的给予方式不仅减少了对实验动物的损伤,同时减少了实验过程中的操作,而且其治疗效果不低于既给予雌激素预防又给予雌激素治疗实验组,因此本研究得出单纯给予雌激素治疗为其最佳作用方式,为CO中毒患者的治疗及研究提供了新思路。
◀
