C末端Src激酶在高糖诱导足细胞骨架重构中的作用*
2021-11-27张丽丽任志龙范燕琴
张丽丽 任志龙 范燕琴 黄 静 程 晖 张 璐
糖尿病肾病(Diabetic Nephropathy, DN)是糖尿病常见的微血管并发症。足细胞损伤是蛋白尿形成、DN进展的主要机制。足细胞裂孔隔膜完整性的破坏、足细胞丢失、数量减少是DN蛋白尿的主要特征。
高糖诱导足细胞损伤的确切机制尚不清楚。Dai等[1]发现高糖诱导足细胞骨架紊乱。我们前期的研究提示高糖可介导足细胞损伤,包括细胞凋亡、足突融合及线粒体功能障碍[2-4]。C末端Src激酶(C-terminal Src Kinase,Csk)隶属于非受体酪氨酸激酶家族,其特征性的结构域包括SH2和SH3。多项研究证实Csk具有重要的生物学调节作用,包括细胞间黏附迁移、细胞增殖以及细胞极性[5-7]。我们已有的研究证实Csk通过调节细胞凋亡及细胞骨架重排介导血管紧张素II诱导的足细胞损伤过程[4,8]。本研究通过体内及体外实验,初步探讨Csk在高糖诱导的足细胞骨架重构中的作用。
1 材料与方法
1.1 1型糖尿病小鼠模型构建及分组
8周龄雄性C57BL/6小鼠12只(购自湖北省实验动物研究中心),按照随机数字表法分配到糖尿病组和对照组,每组6只。采用链脲佐菌素(Streptozotocin,STZ)诱导1型糖尿病小鼠模型,制模方法参照Fan等的报道[9]。分别于实验第1天和第6天糖尿病组小鼠经尾静脉分别注射STZ(HY-13753,美国MCE) 75mg/kg和150mg/kg;对照组小鼠经尾静脉注射等量生理盐水。两组小鼠于第7天开始每周测定一次尾静脉血糖(强生稳悦智佳血糖仪)至第12周。血糖水平超过16.7mmol/L的小鼠被认为成模(糖尿病组6只小鼠均成模)。之后脱臼处死两组小鼠,摘取肾脏用于后续实验。该实验程序和方案得到武汉大学人民医院动物实验伦理委员会批准。
1.2 足细胞培养及分组
永生性人足细胞株由英国Bristol大学Moin A.Saleem教授惠赠,武汉大学人民医院肾病研究所保存。常规复苏后,用含10%胎牛血清(美国Gibco, 10100147)、胰岛素铁硒传递蛋白(ITS, 美国Gibco,41400045)的RPMI 1640(美国Hyclon,SH30027)培养基于33℃、5%CO2培养箱中增殖培养7-10天,再用不含ITS的上述培养基于37℃、5%CO2培养箱中分化培养10-14天。分化成熟的足细胞分为正常葡萄糖组(NG组:5mmol/L葡萄糖,24h)、高渗组(MA组:5mmol/L葡萄糖和25mmol/L甘露醇,24h)、高糖组(HG组:30mmol/L葡萄糖,24h)及HG+Csk siRNA组(Csk siRNA转染48h+30mmol/L葡萄糖,24h)。
1.3 Csk siRNA转染足细胞
Csk siRNA及Hiperfect转染试剂均购自德国QIAGEN公司(Csk siRNA: No.102741; Hiperfect: No.301704)。转染前一天将足细胞传代并种植于6孔板中,细胞密度约 3×105个/孔。转染当天取150ng Csk siRNA与15μ l HiPerfect 转染试剂加入无血清培养基中轻柔混匀,逐滴加入6孔板培养基内,置于37℃培养箱内,6h更换一次培养基,共转染48h。
1.4 免疫荧光法检测肾脏Csk表达
新鲜肾组织经多聚甲醛固定-石蜡包埋后制成组织蜡块,采用Leica石蜡切片机切片后,二甲苯-酒精梯度脱蜡,柠檬酸钠缓冲液(pH=6.0)行抗原修复。10%牛血清封闭1h,抗Csk多克隆抗体(1∶50, sc-286,美国Santa Cruz) 4℃孵育过夜,驴抗兔Alexa Fluor488 (1∶100,711-545-152,美国Jacskon Immunoreseach) 37℃避光孵育1h,含DAPI抗荧光淬灭封片剂(P0131,上海碧云天)封片后共聚焦荧光显微镜(FV.500,日本Olympus)观察并摄片。
1.5 Western印迹法检测Csk蛋白表达
(1)提取总蛋白:收集各组足细胞或绿豆大小肾皮质加入RIPA细胞裂解液(P0013,上海碧云天)(丝氨酸蛋白酶抑制剂PMSF∶蛋白分解抑制剂cocktail∶RIPA=1∶1∶100);(2)BCA法测定蛋白浓度,每组取等量样本;(3)电泳:10%SDS-PAGE电泳,湿转至PVDF膜(0.45,Millipore);(4)封闭:5% 脱脂奶粉室温封闭1h;(5)一抗孵育:一抗稀释到合适浓度(Csk,1∶500,sc-286,美国Santa Cruz; GAPDH,1∶2 000,AG019,上海碧云天),4℃孵育过夜;(6)二抗孵育:二抗稀释后 (山羊抗兔荧光二抗1∶5 000,P/N 926-32212;山羊抗鼠荧光二抗1∶5 000,P/N 926-32210,美国LI-COR)室温避光孵育1h;(7)显像及分析:红外成像系统(美国LI-COR Odyssey)显影后应用Gel-ProAnalyzer 4.5软件进行积分吸光度(A)分析。
1.6 实时荧光定量PCR检测Csk mRNA含量
收集各组足细胞或适量肾皮质以Trizol试剂法(15595,美国Invitrogen)提取总RNA,测定RNA浓度,取1μg RNA根据试剂盒 (RR037,TaKaRa,日本)说明书逆转录合成cDNA,以稀释10倍的cDNA为模板进行实时定量PCR反应。应用IDT设计引物序列(网址:https://sg.idtdna.com/pages),引物由北京擎科新业生物技术有限公司合成。Csk上游引物序列为:5’-CTC CAC TAA GTC TGA CGT GTG-3’,下游引物序列为5’-CAT CTT GTA GCC CTT CTC CAC-3’;内参GAPDH上游引物序列为5’-ACA TCG CTC AGA CAC CAT G-3’,下游引物序列为5’-TGT AGT TGA GGT CAA TGA AGG G-3’。以2-ΔΔCt法计算基因相对表达量。
1.7 足细胞F-actin细胞骨架免疫荧光染色
细胞传代后于6孔板中种植细胞爬片,不同分组刺激结束后弃去培养基,用预冷的4℃ PBS缓慢摇洗3次,每次5min,4℃预冷的4%多聚甲醛固定1h,取FITC-phalloidin(5mg/L,P5285,美国Sigma)室温避光孵育30min,常温PBS缓慢摇洗3次,每次5min,用含DAPI的抗荧光淬灭封片剂(P0131,上海碧云天)封片,共聚焦荧光显微镜(FV-500,日本Olympus)观察并摄片。采用F-actin肌动蛋白重组评分(CFS)评价骨架重排:正常应力纤维,计0分;F-actin形成外周环,外周环范围小于1/2胞膜边缘,计1分;F-actin形成的外周环超过1/2胞膜边缘,计2分;F-actin形成完整外周环,计3分。每组计数100个细胞,取平均值作为CFS评分。
1.8 统计学处理
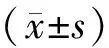
2 结 果
2.1 肾小球Csk表达及分布
免疫荧光结果显示,糖尿病组和对照组小鼠肾小球内均有Csk表达,主要沿毛细血管袢分布;糖尿病组Csk表达明显多于对照组,见图1。Western印迹结果显示,与对照组比较,糖尿病组肾小球Csk蛋白表达水平明显增加 (0.198±0.029 vs 0.441±0.042,t=8.381,P<0.01);实时荧光定量PCR结果显示,与对照组比较,糖尿病组肾小球Csk mRNA表达水平较对照组显著上调,相对表达量为4.175±0.526 vs 1.000±0.001(t=10.45,P<0.01)。见图2。

图1 两组小鼠肾小球内Csk的表达及分布(免疫荧光法,× 400)

注:A为对照组和糖尿病组肾小球Csk蛋白电泳图;B、C分别为对照组和糖尿病组肾小球Csk蛋白、mRNA水平直方图;与对照组比较,*P<0.01图2 两组小鼠肾小球Csk蛋白及mRNA表达水平比较(n均=6)
2.2 足细胞Csk蛋白和mRNA表达水平比较
Western印迹结果显示,MA组与NG组比较,Csk蛋白水平无明显差异(0.1361±0.0093 vs 0.1326±0.0098,t=0.513,P>0.05),HG组 (0.3104±0.0176)明显增加(t=15.160,P<0.01),HG+Csk siRNA组(0.1647±0.0105)则较HG组显著降低(t=12.270,P<0.01),见图3。实时荧光定量PCR与之趋势相同,HG组足细胞Csk mRNA表达水平高于NG组(5.3973±0.3916 vs 1.0031±0.0012,t=19.440,P<0.01),HG+Csk siRNA组Csk mRNA表达水平(2.2913±0.3817)较HG组显著降低 (t=9.838,P<0.05)。见图4。
2.3 Csk siRNA转染对足细胞F-actin分布及其评分比较
NG组和MA组足细胞F-actin沿足细胞呈极性分布,高度有序平行聚集成束贯穿于细胞全长,F-actin评分分别为0.4901±0.1212 和0.4263±0.1291,差异无统计学意义(t=0.624,P>0.05);HG组足细胞F-actin发生重构,排列紊乱,沿细胞膜外周分布,形成外周环,足细胞失去原有的细胞张力,细胞体回缩。F-actin肌动蛋白评分 (2.4350±0.2391)高于NG组(t=12.570,P<0.01);HG+Csk siRNA组足细胞骨架重构改善,未见明显F-actin外周环形成,F-actin评分(1.4854±0.3217)低于HG组,差异有统计学意义(t=4.103,P<0.05)。见图5。

注:与NG组比较,*P<0.01;与HG组比较,#P<0.01图3 各组足细胞Csk蛋白表达水平比较(n均=3)

注:与NG组比较,*P<0.01;与HG组比较,#P<0.05图4 各组足细胞Csk mRNA表达水平比较(n均=3)
3 讨 论
足细胞是终末分化、高度特异性的肾脏固有细胞,是肾小球滤过屏障的重要组成部分[10]。足细胞的形态和功能主要依赖于肌动蛋白细胞骨架系统,后者通过细胞骨架蛋白、肌动蛋白结合蛋白和足突顶区多糖蛋白的共同作用,维持裂孔隔膜的完整性[11]。足细胞足突融合、线粒体功能障碍、细胞凋亡等一系列形态和功能的损害是导致DN发生发展的重要因素之一[12, 13]。因此了解高糖诱导足细胞损伤的分子机制和作用靶点将有助于制定DN的治疗策略。本研究通过体内体外实验发现,糖尿病小鼠肾小球和体外高糖诱导足细胞,其Csk表达均增高,而体外转染siRNA可下调足细胞Csk表达,减轻高糖诱导的足细胞骨架重排和F-actin评分,提示Csk参与高糖诱导的足细胞损伤。

注:与NG组比较,*P<0.01;与HG组比较,#P<0.05图5 各组足细胞F-actin分布及评分(免疫荧光法,×400,n均=3)
Csk是一种高度保守的非受体蛋白酪氨酸激酶,分子量为50 kDa。Csk的一级结构可以分为5个结构域:C端、酪氨酸激酶结构域、Src同源3 (SH3) 、SH2结构域、N端结构域[14]。其核心结构是位于氨基端的 SH2 和 SH3 串联结构域,以及具有底物特异性结合的酪氨酸激酶结构域,可与多种底物蛋白相互作用以发挥Csk的调节作用;Csk缺乏跨膜结构域和N端脂肪酸酰基修饰结构域,因此主要存在于细胞质中。研究发现,Csk通过SH3-SH2结构域可有效地与位于富含胆固醇细胞膜上的支架/适配蛋白(Cbp/PAG, Paxillin, JAM-A, Caveolin-1)等结合[7, 15-17],其细胞定位从胞浆向胞膜转移,通过磷酸化SRC-家族蛋白酪氨酸激酶(SRC-family Protein Tyrosine Kinase, SFK)的酪氨酸Tyr529位点负性调节SFKs的磷酸化和激酶活性,导致SFKs从胞膜脂筏转移。Csk的独特结构和功能使其参与细胞凋亡、骨架重排、细胞周期进程、分化和发育等生物学过程。本课题组前期研究发现血管紧张素II可诱导足细胞Csk表达增加,Csk通过调节负性调节SFKs家族的Fyn激酶的磷酸化改变nephrin蛋白的表达及磷酸化参与足细胞凋亡以及血管紧张素II介导的细胞骨架重排[4, 8]。本研究在前期基础上,进一步发现Csk作为重要的调控分子,还参与高糖介导的足细胞骨架重排。
目前,Csk调控足细胞肌动蛋白骨架重构的具体分子机制仍不清楚。基因敲除Csk,可诱导胚胎成纤维细胞异三聚体G蛋白和G蛋白偶联受体功能异常,完全阻断肌动蛋白应激纤维的形成,而在Csk缺失的细胞中转染Csk表达载体,可重新恢复肌动蛋白应力纤维的形成[18]。研究发现Csk与磷酸化的Paxillin相互作用,与神经细胞突触结构的稳定性和信号转导密切相关。而Paxillin主要存在于局部黏附区,参与连接肌动蛋白细胞骨架的微丝和微管结构[14]。这提示Csk对细胞骨架应力纤维系统稳定性的维系有着不可或缺的作用。Maldonado等[19]发现整合素αvβ3 可以增强Csk的胞膜定位,后者通过磷酸化Src,负性调控Src的活性,进而活化Rho相关卷曲螺旋蛋白激酶(Rho-associated Coiledcoil Containing Protein, ROCK)促进丝切蛋白(Cofilin)磷酸化,导致肌动蛋白细胞骨架重构和神经元轴突收缩。而本课题组前期研究已证实,Csk-SFKs通路参与了足细胞的病理损伤过程,因此推测Csk亦可能通过调节下游SFKs激酶活性参与高糖诱导的足细胞肌动蛋白细胞骨架系统的稳定性,其相关研究有待进一步开展。
综上所述,本研究证实高糖刺激可直接诱导足细胞细胞骨架重排,并推测Csk可能参与高糖诱导的足细胞骨架重排,其具体分子调控机制和对足细胞的生物学作用仍有待进一步探讨。
◀
