针刺对脑出血大鼠脑组织神经细胞铁死亡的影响
2021-11-26李明月戴晓红匡炳霖于学平滕伟于薇薇马慧慧陈秋欣曹洪涛温鑫邹伟
李明月,戴晓红,匡炳霖,于学平,滕伟,于薇薇,马慧慧,陈秋欣,曹洪涛,温鑫,邹伟*
(1.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;2.黑龙江中医药大学,黑龙江 哈尔滨 150040)
虽然自发性脑出血病例在脑卒中占比不超过20%,但其仍然与各种类型脑卒中的高病死率和发病率关系密切[1]。因此早期识别脑出血,积极发现脑出血后神经细胞死亡的病理机制和干预方法对于改善脑出血疾病的现状至关重要。铁死亡于2012年首次被提出,是一种铁依赖性的脂质过氧化的损伤过程,近几年研究发现铁死亡是脑出血后神经细胞死亡的重要方式[2]。脑出血后血肿溶解,血红蛋白释放大量游离铁,进而引起大量活性氧生成,并诱发脂质过氧化反应,造成质膜破坏,铁死亡发生[3]。另外铁死亡另一重要特征是有典型的线粒体形态改变,即线粒体体积缩小,双层膜密度增强,线粒体嵴减少或缺失,线体体外膜增厚,甚至破裂[4]。针刺在改善出血大鼠肢体功能缺损方面效果显著[5],同时针灸在抑制脑出血后大鼠神经细胞死亡方面也起到至关重要的作用[6]。然而针刺能否通过抑制神经细胞铁死亡改善出血后大鼠的神经功能是本研究的重点。
1 材料与方法
1.1 实验动物与分组
由黑龙江中医药大学动物实验中心提供健康清洁级SD雄性大鼠96只,体质量为(280±10)g。大鼠在温度(22±2)℃范围内,相对恒定湿度(50±5)%条件下自由饮水、进食,适应性喂养1周后方可入组。将所有大鼠随机分为假手术组、模型组、针刺组、抑制剂组(DFX)。每组大鼠再按1 d、3 d、7 d 3个时间点随机分成3个亚组,每个亚组8只。造模前12 h禁食,6 h禁水。
1.2 主要仪器与试剂
立体定位仪(成都仪器厂,STW-1);牙钻(上海齿科机械厂,307-6);针灸针(华佗牌,0.35 mm×40 mm);丙二醛(MDA)测定试剂盒(WLA048a,万类生物,中国);透射电子显微镜(HITACHI H-7650日立,日本)。
1.3 脑出血模型制备
大鼠称重后,按照60 mg/kg比例腹腔注射1%戊巴比妥钠麻醉大鼠。大鼠被成功麻醉后,头部备皮,在备皮处用碘伏常规消毒,后以俯卧位固定于立体定位仪上。取两耳尖连线中点切口,钝性分离皮下骨膜,充分暴露前囟点及冠状缝,以立体定位仪定位坐标点,以前囟点为中心,向右侧3.5 mm,向后侧0.2 mm,用1.0 mm直径牙钻钻孔至硬脑膜表面。同时剪断距尾端3 cm处的鼠尾,取血50 μL后将微量注射器固定于立体定位仪上,并沿钻孔处垂直缓慢进针至基底节处注血,速度为20 μL/min,留针5 min后缓慢出针。断尾处消毒包扎,局部喷洒庆大霉素并用牙科水泥密封,眼科针缝合。造模后采用Berderson评分法[7]对各组大鼠进行神经功能评分。评分在1~3分大鼠纳入本实验。
1.4 干预方法
模型组采用自体血注入法制备脑出血大鼠模型,造模后不做任何处理。假手术组接受与模型组相同的各项操作,微量注射器于相同位置进针,注入等量生理盐水,但不注血。针刺组造模后给予针刺治疗,选穴部位参照《实验动物穴位图谱》,取大鼠百会穴、患侧曲鬓穴,由百会向曲鬓穴透刺,以0.35 mm×40 mm针灸针快速刺入,进针深度15 mm,施以快速捻转平补平泻手法,捻转速度为200 r/min,持续捻转5 min,后间隔5 min,反复操作共3次。抑制剂组按照100 mg/kg剂量给予肌肉注射去铁胺每日1次。
1.5 指标检测
1.5.1 神经功能评估
在造模后的1 d、3 d、7 d时间点应用Ludmila Belayev评分法[8-9]进行神经功能评估。该评分法由姿势反射和放置试验两部分组成。放置试验又分为视觉、触觉、本体感觉试验。其中每项按照神经功能缺损程度评分0~2分,各项分值相加最高12分,此时神经功能缺损程度最重。
1.5.2 透射电镜观察线粒体形态
将保存在2.5%戊二醛中的待测样本取出,经0.1 mol/L磷酸漂洗液漂洗后,用1%锇酸固定液固定3 h。将固定好的样本依次经过50%、70%、90%乙醇、90%乙醇和90%丙酮(1∶1)混合液、90%、100%丙酮脱水15~20 min,重复3次。经包埋、固化后的样本使用超薄切片机进行切片,用3%醋酸铀-枸橼酸铅双染色,蒸馏水洗净晾干后读片。
1.5.3 神经元特异性核蛋白(NeuN)表达
将保存在固定液中的脑组织样本取出,常规脱水、透明、透蜡、包埋制成5 μm厚度的切片。取出烤好的切片,依次放入二甲苯Ⅰ,二甲苯Ⅱ,无水乙醇Ⅰ,无水乙醇Ⅱ,95%、85%、75%乙醇中浸泡脱蜡至水;抗原修复、过氧化氢孵育、山羊血清封闭后进行一抗孵育,4 ℃过夜;然后在37 ℃条件下滴加二抗,孵育20 min;滴加辣根过氧化物酶标记工作液,37 ℃环境下孵育30 min;DAB显色;苏木素复染细胞核,切片经过反蓝后,再依次浸入浓度为75%、85%、95%的乙醇中脱水;封片;镜检;于400倍镜下拍照。取其均值作为该组阳性细胞数。
1.5.4 丙二醛(MDA)含量检测
根据MDA试剂盒说明进行样本和试剂滴加,经过吸光度测定后进行MDA含量测定。
1.6 统计学分析
所有数据均应用IBM SPSS26.0统计软件进行分析。结果组间比较采用One-way ANOVA和Tukey’s检验,以P<0.05认为差异具有统计学意义。
2 结果
2.1 针刺对脑出血大鼠神经功能的影响
在各个时间点假手术组大鼠未见明显神经功能缺损。与假手术组比较,模型组大鼠1 d即表现出明显神经功能缺损(P<0.05),3 d神经功能缺损最重(P<0.05),7 d神经功能缺损有所恢复(P<0.05)。针刺组与抑制剂组大鼠在各时间点神经功能缺损程度较模型组明显减轻,结果具有统计学意义(P<0.05)。针刺组与抑制剂组大鼠神经功能评分在各时间点比较无显著性差异(P>0.05),见表1。
表1 各组大鼠神经功能Ludmila Belayev评分结果分)
2.2 针刺对脑出血大鼠神经细胞线粒体形态的影响
各时间点假手术组神经元胞体中线粒体形态未见明显改变。模型组1 d神经元胞体中可见散在线粒体体积变小,线粒体嵴减少,线粒体外膜破裂,神经元内细胞器略减少,神经元胞体内可见类似脂质样物质。模型组3 d神经元内细胞器明显减少,可见线粒体膜破裂,神经元将近死亡。模型组7 d神经元胞体中线粒体形态有所缓解,但仍可见线粒体体积缩小,线粒体嵴减少和线粒体破裂。针刺组1 d与抑制剂组1 d神经元线粒体形态改变不明显,以肿胀为主。针刺组3 d与抑制剂组3 d较模型组3 d线粒体形态改变均减轻,可见散在线粒体形态变小,伴有线粒体双层膜密度增厚及线粒体嵴减少或线粒体膜破裂,同时可见不同程度肿胀的线粒体。针刺组7 d与抑制剂组7 d线粒体形态基本趋于正常,偶有散在肿胀线粒体,见图1~3。
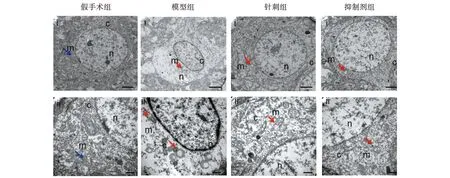
注:Scale bars:(i)2 μm;(ii)500 nm;黄色箭头代表正常线粒体;红色箭头代表线粒体形态变小,外膜增厚或破裂;m.线粒体;n.细胞核;c.细胞浆。 图1 各组大鼠脑组织1 d时线粒体超微结构
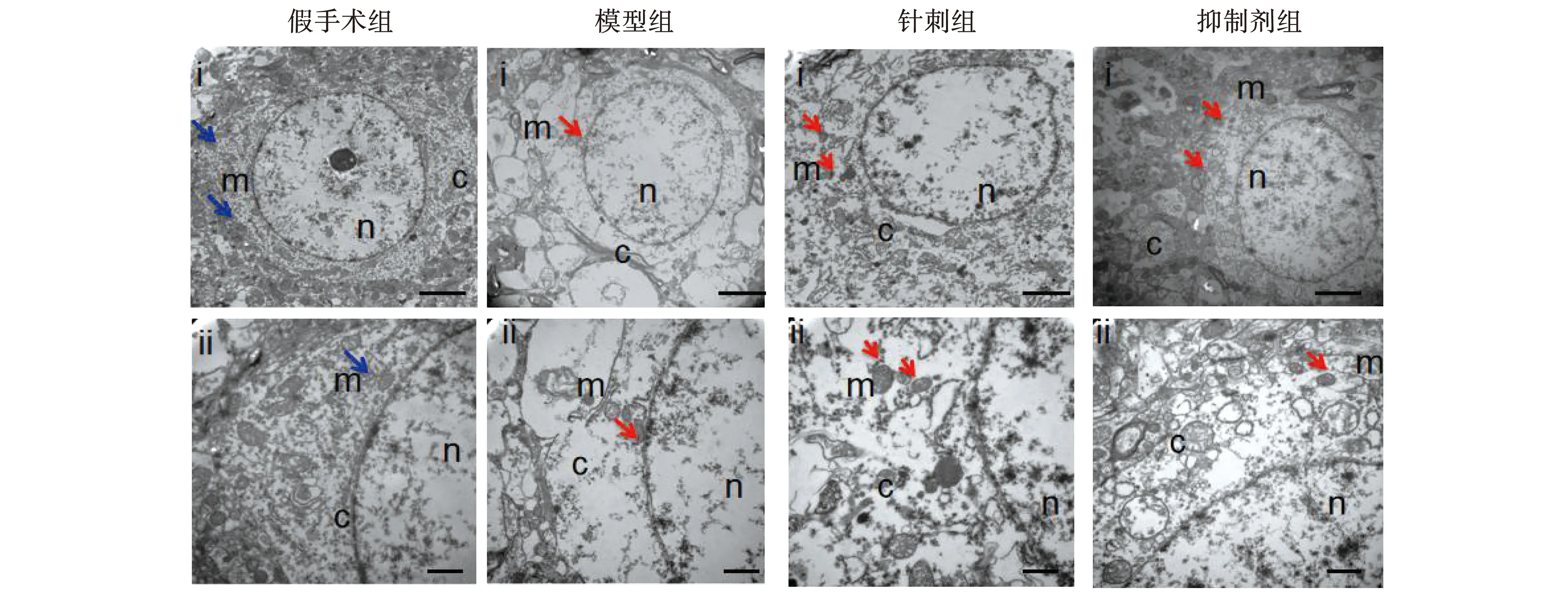
注:Scale bars:(i)2 μm;(ii)500 nm;黄色箭头代表正常线粒体;红色箭头代表线粒体形态变小,外膜增厚或破裂;m.线粒体;n.细胞核;c.细胞浆。图2 各组大鼠脑组织3 d时线粒体超微结构
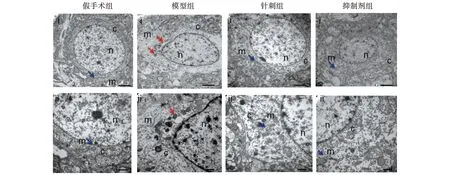
注:Scale bars:(i)2 μm;(ii)500 nm;黄色箭头代表正常线粒体;红色箭头代表线粒体形态变小,外膜增厚或破裂;m.线粒体;n.细胞核;c.细胞浆。 图3 各组大鼠脑组织7 d时线粒体超微结构
2.3 针刺对出血脑组织NeuN表达的影响
假手术组NeuN阳性细胞数相对较高,各时间点未见显著差别(P>0.05)。与假手术组比较,NeuN阳性细胞数在模型组各时间点均显著减少(P<0.05)。与模型组比较,NeuN阳性细胞数在针刺组及抑制剂组各时间点均显著增多(P<0.05),见图4,表2。
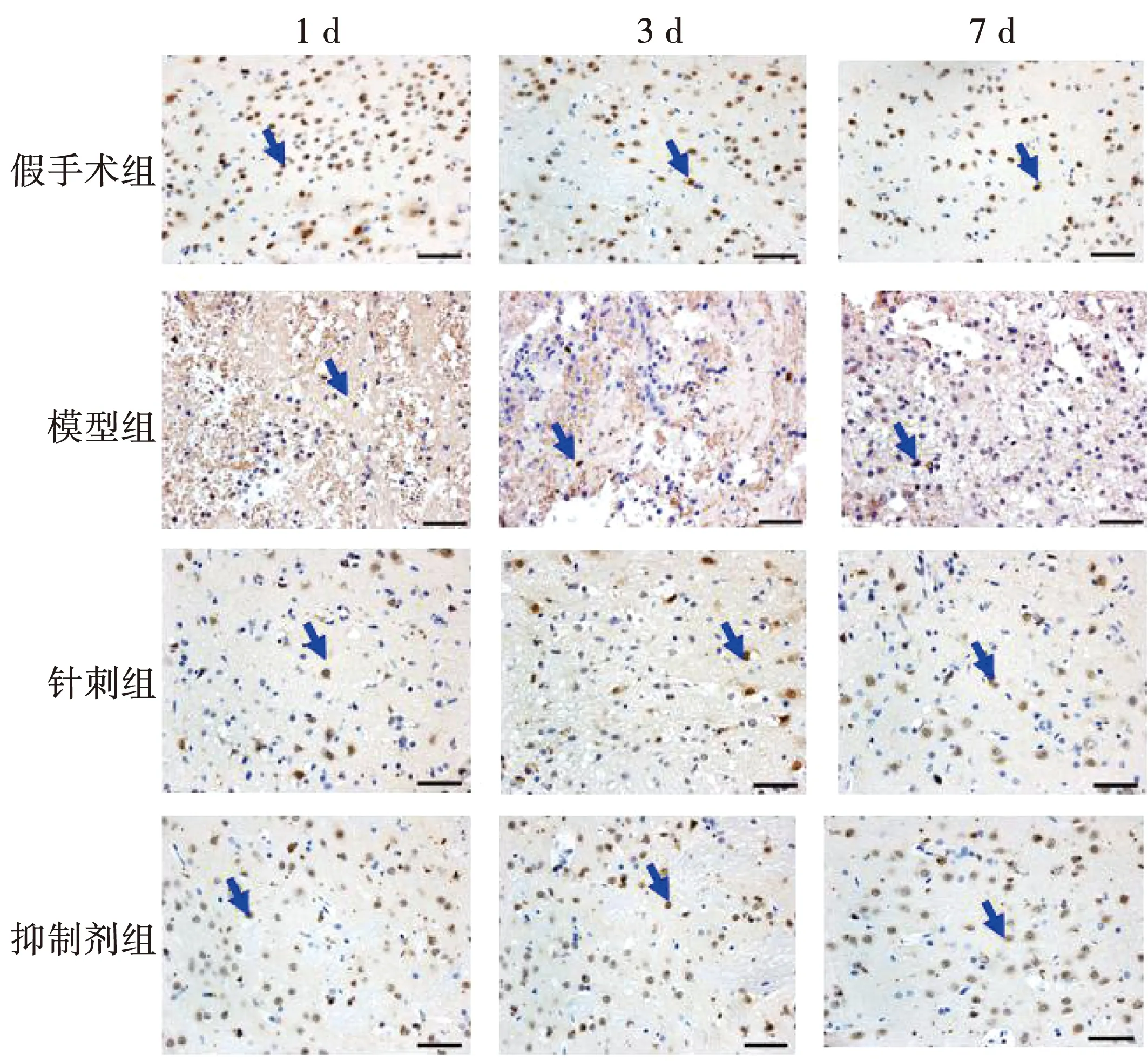
注:Scale bars:100 μm;蓝色箭头为NeuN阳性细胞表达。图4 各组大鼠脑组织不同时间点NeuN表达比较
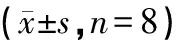
表2 各组大鼠脑组织NeuN相对表达量测定结果
2.4 针刺对出血脑组织MDA含量影响
与假手术组比较,模型组在出血后1 d、3 d、7 d MDA含量均显著升高(P<0.05)。其中模型组1 d与3 d MDA含量,模型组3 d与模型组7 d MDA含量比较差异显著(P<0.05),说明脑出血后MDA含量在3 d达到高峰。针刺组大鼠各时间点MDA含量较同时间点模型组明显减少,结果具有统计学意义(P<0.05)。针刺组与抑制剂组大鼠MDA含量在各时间点比较,无显著性差异(P>0.05),见表3。
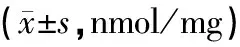
表3 各组大鼠脑组织MDA测定结果
3 讨论
铁死亡是由铁依赖性脂质过氧化驱动的一种程序性细胞死亡过程。细胞内的很多代谢途径,如铁代谢、脂质代谢、氨基酸代谢以及细胞呼吸等(即线粒体三羧酸循环和电子传递链)都是可以通过产生脂质活性氧[10]而与铁死亡发生关联。文献表明铁死亡的发生一定会伴有不同程度的线粒体形态和功能的改变[11],包括线粒体嵴的减少,线粒体体积的减小甚至线粒体的破裂等[12-13]。在一定程度上铁死亡的发生也与线粒体形态改变程度,能量供应和新陈代谢的损害严重程度有关。GAO等[14]在研究中发现半胱氨酸缺乏会导致线粒体膜电位超极化和脂质过氧化物积累,而抑制线粒体三羧酸循环和电子传递链可减轻线粒体膜电位过极化,减轻脂质过氧化物积累使细胞免于铁死亡。目前线粒体功能失调已经被认为是与铁死亡相关的神经系统疾病的一个重要的生化特征[15]。而在脑出血后血肿溶解释放大量游离铁,可以驱动细胞活性氧的产生,线粒体作为氧化磷酸化的主要调节因子,是细胞内活性氧产生的主要来源。而线粒体活性氧(mitochondrial ROS,mitoROS)产生的主要来源是细胞内自由的具有氧化还原性的铁池。研究表明一旦mitoROS聚积,便可与线粒体膜中的多聚不饱和脂肪酸(PUFA)发生反应,导致脂质过氧化、线粒体DNA(mitochondrial DNA ,mtDNA)损伤,以及电子传递链复合物mtDNA编码亚基的缺陷[16]。铁死亡诱导剂爱拉斯汀(Erastin)已经被证实会使mitoROS积累,线粒体通透性转换孔开放,线粒体膜电位改变以及线粒体ATP耗竭、线粒体碎裂[17]。
在本实验中我们发现模型组1 d开始神经元胞体中即可见散在线粒体双层膜密度增加,线粒体体积变小,线粒体嵴减少。模型组3 d神经元死亡明显,神经元胞体中可见线粒体嵴消失,线粒体破裂,以及神经元死亡。模型组7 d神经元胞体中线粒体形态有所缓解。而在不同时间点针刺组与抑制剂组较模型组线粒体形态改变均较轻,可见散在线粒体形态变小,线粒体嵴减少,偶有线粒体外膜增厚及破裂,多数以肿胀线粒体为主。可见针刺在一定程度上减轻了神经细胞铁死亡相关的线粒体形态损伤。另外在本实验中我们观察了神经元特异性核蛋白(NeuN)的表达,发现在脑出血后,NeuN阳性细胞数在各时间点均显著减少(P<0.05),3 d减少最显著(P<0.01),说明在脑出血后存活神经元减少,3 d时存活的神经元最少。与模型组比较,NeuN阳性细胞数在针刺组及抑制剂组各时间点均显著增多(P<0.05),可见针刺与铁死亡抑制剂均可在一定程度上,减轻神经元铁死亡发生。同时本实验还进一步观察了MDA水平。发现脑出血后各时间点MDA水平均显著升高(P<0.05),3 d最高。而针刺组与抑制剂组大鼠各时间点MDA含量较同时间点模型组明显减少。由此我们推测针刺可能在影响神经细胞铁死亡脂质过氧化方面起到积极作用。
头针针刺在改善脑出血后神经功能方面已经得到广大医学工作者的认可[18]。其中“百会”透“曲鬓”针刺法在减轻脑出血后继发性病理损伤过程起到举足轻重的作用,其中包括抑制神经细胞死亡信号传导[19]。百会向曲鬓穴透刺,可以激发督脉、手足阳经经气流注于足少阳胆经。阳主动,一身之阳气的激发可以有助于神经细胞的激活,神经功能的修复[20]。另外通过针刺对大鼠脑出血后不同时段脑内血肿中心等区域神经细胞放电情况研究发现[21],针刺能够缩短出血后神经元诱发放电潜伏期,增加放电频率,改善细胞状态,缓解神经细胞的病理损害过程,并且针刺在清除血肿引起的神经细胞抑制性泛化方面也起到积极作用。另外针刺也可以降低家兔脑出血组织脂质过氧化产物LPO含量[22]。在本实验中,我们使用Ludmila Belayev评分评价各组大鼠的神经功能缺损情况,发现模型组自出血后1 d开始即出现神经功能缺损,在随后的时间点缺损程度逐渐递增,直至7 d有所缓解。而经过针刺和抑制剂治疗后的大鼠在各时间点神经功能缺损程度较模型组明显减轻。由此推测针刺可能通过抑制出血后脑组织神经细胞铁死亡促进神经功能修复。
本研究虽然初步证实了针刺对出血后脑组织神经元铁死亡的相关线粒体形态、NeuN表达和MDA水平的影响,但由于线粒体在铁死亡中的具体作用还存在争议[23],针刺是否通过改善线粒体形态就能抑制铁死亡的发生以及发生铁死亡的神经细胞是如何引起线粒体形态改变的具体机制还有待于进一步研究。另外本研究主要针对线粒体的形态进行了观察,还有一些线粒体代谢相关的调节因子如线粒体脂代谢调节因子(ASCF2和CS)、谷氨酰胺代谢相关因子即(mitochondrial glutaminase 2,GLS2)[24]、TCA周期相关因子(即FH)等也会增强对铁死亡的敏感性[14]。后续会深入基因水平进行研究,进一步明确针刺对神经细胞铁死亡影响的作用机制。
