体外培养对小鼠囊胚的发育潜能及DNA损伤的影响研究
2021-11-20马媛杨洋陈书强王晓红
马媛,杨洋,陈书强,王晓红*
(1.中国人民解放军空军军医大学唐都医院妇产科生殖医学中心,西安 710038;2.西安市第四医院生殖医学中心,西安 710004)
辅助生殖技术(ART)是指以治疗不孕不育症为目的而采取的在体外操作配子及胚胎的治疗手段或方法,主要包括胚胎体外培养、体外受精、胚胎冷冻解冻技术等。但是,由于体外环境和体内的生理环境具有极大的不同,目前体外条件仍无法完全模拟体内环境。况且,胚胎早期尚不具备屏障和保护功能。因此,体外培养环境会给配子及胚胎造成环境应激,影响胚胎的发育潜能。本课题组既往研究发现,胚胎体外培养可影响小鼠囊胚的发育,降低囊胚的着床率,影响后期胎鼠的宫内生长[1]。而造成囊胚发育及胚胎存活率下降的相关机制目前尚不明确。
在生命活动进行时,维持基因组稳定需要DNA精确的复制和遗传。DNA的完整性是保障胚胎发育、胚胎种植甚至子代健康的基础[2]。如果DNA遭受到内源性或外源性刺激,可引起DNA损伤,从而导致细胞凋亡,细胞周期阻滞以及DNA损伤修复等。其中,DNA双链断裂(DNA double-strand break,DSB)对基因组完整性以及后续的细胞存活具有严重的影响[3]。既往研究显示,ART中多个步骤会导致DNA损伤,进一步影响配子的质量、胚胎发育甚至胎儿发育[4-6]。故本研究从DNA损伤为出发点,研究体外培养环境对小鼠囊胚DSBs的影响,为体外培养技术影响囊胚发育的潜在机制研究提供思路与方向。
材料与方法
一、实验动物
清洁级ICR小鼠购自西安交通大学医学部实验动物中心(批号:61001700003690)。雌鼠4~6周龄,雄鼠3~6月龄,普通小鼠饲料喂养。
二、主要试剂和仪器
1.试剂:胚胎培养采用KSOM培养液(Millipore,美国),微量胚胎cDNA线性扩增使用REPLI-g WTA Single Cell Kit(Qiagen,德国);荧光聚合酶链反应试剂盒购自日本Takara公司,γH2AX一抗为兔单克隆抗体(ab81299)购自英国Abcam公司,免疫荧光二抗为驴抗兔抗体(A21206)购自美国invitrogen公司,Hoechst 购自美国Sigma公司(Hoechst 33258 solution)。
2.仪器:实体解剖镜(厦门,Motic),CO2培养箱(Thermo,美国),培养皿(35 mm)(Nunc,丹麦),超净台(Labconco,美国),荧光定量PCR仪(Bio-Rad,美国),激光共聚焦显微镜(Olympus,日本)。
三、研究方法及分组
1.小鼠模型建立及胚胎收集:雌鼠随机分配为两组,每组各6例。(1)自然交配组(Natural conception组,NC组):将发情雌鼠与雄鼠1∶1自然合笼,次日检查阴栓,见栓即为交配成功,当日计为0.5 d,于3.5 d处死见栓雌鼠取双侧子宫,PBS冲洗获得囊胚;(2)体外培养组(In vitro culture组,IVC组):将发情雌鼠与雄鼠1∶1自然合笼,次日检查阴栓,见栓当日处死见栓雌鼠,于输卵管取受精卵,用0.3%透明质酸酶消化受精卵周围颗粒细胞,然后将消化分离的受精卵多次冲洗,转入KSOM溶液中培养,于培养的3.5 d收集囊胚期胚胎。最终每组各获得囊胚60枚用于后续分析。
2.实时定量PCR检测:选择每组囊胚20枚进行微量胚胎cDNA线性扩增,严格按照说明书要求操作。根据实时定量PCR试剂盒说明配制反应体系,反应总体系为20 μl:SYBR Green 10 μl,PCR特异上、下游引物按1∶1混合后取1.5 μl,cDNA模板1.5 μl,灭菌蒸馏水7 μl。扩增条件:95℃ 3 min;95℃ 15 s,60℃ 30 s,72℃ 30 s,35个cycle;72℃ 2 min。以GAPDH为内参,进行PCR反应,引物序列来自PrimerBank,详见表1、2。每次检测设定3个复孔,每个样本重复3次。以上在每个PCR循环的延伸期采集荧光信号,PCR反应完成后利用温度梯度变性获得溶解曲线供PCR产物定性分析。根据PCR扩增曲线,得到每个样本的循环周期数(Cq值),使用 2-ΔΔCt法计算各组中目的基因的表达情况。

表1 囊胚发育潜能相关基因引物序列
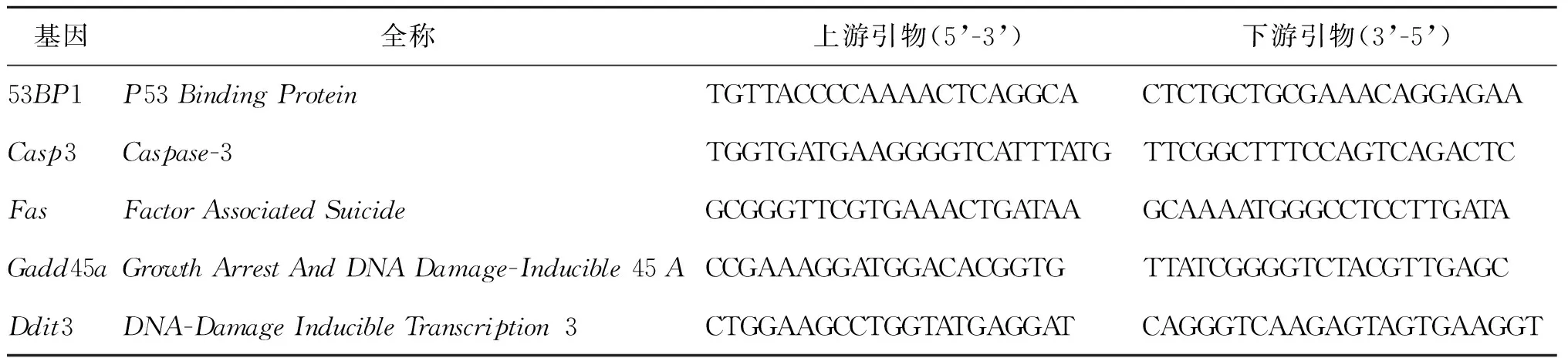
表2 DNA损伤相关基因引物序列
3.胚胎免疫荧光检测及分析:采用免疫荧光法检测每个囊胚γH2AX的表达情况,从而分析其DNA损伤的程度。以下每两个操作步骤之间均需用含有0.1%聚乙烯醇(PVA)的PBS洗涤囊胚3次。收集两组囊胚各40例,4%多聚甲醛室温固定2 h,加入0.2%Triton-X打孔30 min,封闭液室温封闭2 h,加入一抗(1∶2 000稀释)4℃孵育过夜;次日,将囊胚加入488标记的抗兔荧光二抗(1∶500稀释),避光孵育2 h,用含有10 μg/ml Hoechst 的PBS室温避光染核30 min,PBS洗涤干净后,封片,荧光显微镜照相。荧光亮度采用软件Image J进行分析,选取目标区域,分析该区域平均光密度水平,并计算出同一样本Hoechst染核的平均光密度。γH2AX的平均光密度值与核的平均光密度值的比值即为本样品的实际平均光密度值。
四、统计学分析

结 果
一、体外培养对囊胚早期发育的影响
通过对囊胚中多能因子和早期细胞定向分化因子的表达分析发现,与NC组比较,IVC组的多能因子Pou5f1、Nanog基因表达下降(P<0.05),滋养层细胞分化相关分子Tead4的基因表达上调(P<0.05),滋养层细胞分化相关分子Cdx2、Eomes和Elf5的基因表达均显著下降(P<0.05),调控原始外胚层分化的基因Gata6、Sox17、Fgfr2以及Fgfr4在IVC组表达下降(P<0.05)。与NC组比较,IVC组中Lif基因也显著下降(P<0.05)(表3)。

表3 两组囊胚中发育潜能基因表达比较(-±s)
二、体外培养对囊胚DNA损伤的影响
与NC组的γH2AX相对荧光密度(0.558±0.560)比较,IVC组的γH2AX相对荧光密度(0.614±0.092)显著升高(P<0.05)(图1、2)。
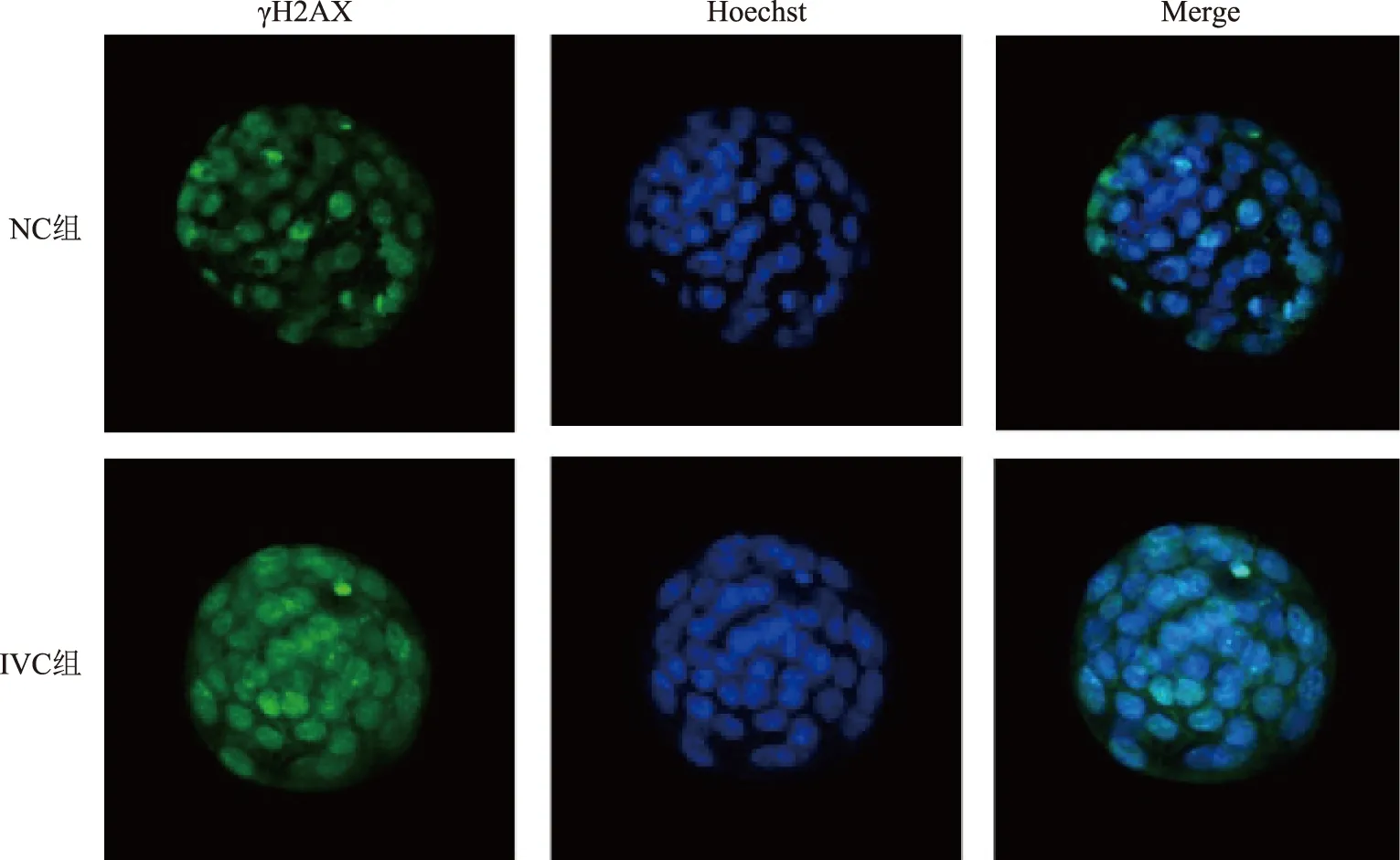
γH2AX:γH2AX染色;Hoechst:细胞核染色;Merge:γH2AX与Hoechst重合后的显像图1 两组囊胚免疫荧光检测图像(×200)
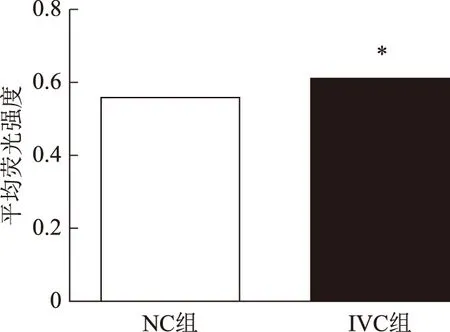
注:与NC组比较,*P<0.05图2 体外培养对囊胚中γH2AX表达的影响
三、体外培养对囊胚DNA损伤相关基因表达的影响
与NC组比较,IVC组的DNA损伤相关基因Fas、Gadd45a和Ddit3的表达显著上升(P<0.05)(表4)。

表4 体外培养对囊胚DNA损伤相关基因表达的影响(-±s)
讨 论
在胚胎发育早期,一些影响胚胎生长发育及分化的调控基因的突变,可以导致胚胎发育异常,决定胚胎的命运。本研究发现,体外培养环境可影响小鼠囊胚多个命运决定因子的表达。这些因子中,Pou5f1、Nanog和Sox2可以维持囊胚内细胞团细胞的多能性,使小鼠囊胚内细胞团进一步分化成上胚层和原始内胚层[7];而Cdx2、Eomes和Elf5可调控囊胚分化。Cdx2有利于保持囊胚期外滋养层细胞的完整性[8]。Eomes参与滋养层细胞的命运走向,当敲除Eomes基因后,胚胎可以发育成形态看似正常但发育停滞的囊胚[9]。Elf5可进一步加强Cdx2和Eomes的转录[10]。Gata4、Gata6、Sox17以及Fgfr2和Fgfr4是外滋养层细胞特异性转录因子,可以调控原始外胚层的分化[11]。Tead4定位于原始外胚层中的线粒体,主要作用于原始外胚层中代谢的建立[12]。另外多分化因子Lif可以支持卵裂期细胞和囊胚发育,促进胚胎着床[13]。本研究发现,IVC组的多能因子、滋养层细胞分化相关基因、原始外胚层分化调控基因等多个囊胚命运决定因子的基因表达发生显著改变;既往研究表明,对山羊和猫的胚胎进行体外培养,也出现了早期胚胎命运决定因子的变化[14-15]。以上研究提示,单纯体外培养环境即可影响囊胚的早期命运。
DNA的精确复制和遗传对维持基因组稳定具有重要作用。如果早期胚胎在DNA复制和遗传过程中发生损伤,可能影响胚胎及子代发育。既往有研究提示ART技术可导致DNA损伤[2,4,6]。与ART相关的DNA损伤是影响配子质量和胚胎发育的重要因素[16]。体外培养技术是ART中重要的组成部分,故本研究进一步对经过体外培养的小鼠囊胚DNA损伤及相关损伤修复因子的表达进行分析。
H2AX是哺乳动物细胞中核心组蛋白H2A的亚型,当发生DSB时,H2AX蛋白发生磷酸化形成γH2AX。因此,对γH2AX的识别成为检测DSBs的理想手段[3]。本研究中采用免疫荧光法对两组胚胎中γ-H2AX的表达进行分析从而间接显示两组胚胎DNA的损伤程度,结果显示IVC组γH2AX相对荧光密度显著升高。以上结果提示,体外培养可导致囊胚中DNA双链断裂损伤的发生风险增加。在DSBs过程中,一些因子可在细胞凋亡、染色质重排、DNA修复等过程中发挥作用。Gadd45a参与细胞周期调控、DNA损伤修复、细胞凋亡及信号转导等过程[17]。Fas系统是死亡受体信号转导途径的重要凋亡途径之一,Casp3是Fas介导细胞凋亡信号传导通路中的核心蛋白,是细胞凋亡性死亡的最终执行者[18]。Ddit3参与内质网应激参与的凋亡通路[19]。经过对比发现,与NC组相比,IVC组的DNA损伤相关基因Fas、Gadd45a和Ddit3的表达显著上升。提示体外培养环境可在导致DNA双链断裂损伤,并在多个方面发挥作用,可能诱导细胞凋亡和染色质重排,最终影响囊胚的发育。
关于ART技术导致DNA损伤的研究发现,体外受精-胚胎移植的小鼠胎儿脑组织中DNA损伤修复基因表达显著改变[6],玻璃化冷冻技术可以导致小鼠卵母细胞DNA损伤加剧[4]。以上研究包括本项研究均提示ART技术与DNA损伤具有密切关系,关于其对后续胎鼠发育的影响仍需要进一步研究。
综上,本研究结果显示,体外培养可导致小鼠囊胚多能因子及早期胚胎命运决定基因表达水平发生改变,影响小鼠囊胚发育潜能。这与IVC组小鼠囊胚DNA损伤增加、DNA损伤相关基因的表达异常具有潜在联系。
