醌氧化还原酶的异源表达及其在偶氮染料脱色方面的研究
2021-11-19刘谦谦唐梓静李天真李宝库朱蕾蕾
刘谦谦 唐梓静 李天真 李宝库 朱蕾蕾
(1. 河北大学药学院,保定 071002;2. 中国科学院天津工业生物技术研究所 工业酶国家工程实验室,天津 300308)
随着现代化工行业的发展,染料在纺织厂、印染厂和造纸厂中被广泛使用[1]。今天大多使用的染料都是经还原、氧化、缩合、硝化或者磺酸化等合成得到,通常含有复杂的芳香环结构[2]。全球每年大约有8×105-9×105t不同的染料被生产,并在纺织品、皮革、纸张、塑料、化妆品和食物染色中广泛使用[3-4]。偶氮染料以一个或多个R1-N=N-R2键存在,其中偶氮染料在每年生产的染料中所占比例为60%-70%,是使用比较广泛的一类染料[5-6]。大约有90%的染料进入污水处理场,存在未处理完全的染料排放到河流中,不仅污染水质,而且破坏光线的穿透等,对水体及周边的生态系统造成危害,并威胁人类的生命健康[2,7]。利用安全、低成本的高效脱色微生物来处理染料废水变得越来越受人们关注[8]。氧化还原酶类对染料分子有破坏作用,能够达到脱色的效果。
NAD(P)H∶醌氧化还原酶1(NAD(P)H∶quinone oxidoreductase,NQO1,EC 1.6.99.2)是一种黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)依赖型蛋白,可以利用NAD(P)H作为辅因子催化包括醌类、醌亚胺类、硝基化合物和偶氮类染料等一系列底物的双电子还原[9-11]。其还原反应以乒乓机制进行,NAD(P)H和底物交替占据相同的结合位点的重叠区域,并参与双氢离子的转移,首先NAD(P)H进入活性位点还原FAD形成FADH2,然后底物进入活性位点被FADH2还原[12]。NQO1在抗氧化防御中发挥至关重要的作用,其通过还原内源性醌类如维生素E、辅酶Q10产生稳定的氢醌类化合物而发挥重要的抗氧化作用[13-14]。其次NQO1也是一个20S蛋白酶体相关的蛋白,其可以稳定肿瘤抑制因子p53、p73,从而发挥抗肿瘤作用[15-16]。同时,NQO1还能激活醌类化疗药物,成为治疗癌症的潜在药物靶点[17]。有报道称,来自大肠杆菌(E. coli)的偶氮还原酶(AzoR)和来自浑球红细菌(R. sphaeroides)的偶氮还原酶(AZR)能够催化偶氮染料的还原,且同时具有醌还原酶活性。也有研究表明,添加醌类氧化还原介质,如2-羟基-1,4-萘 醌(2-hydroxy-1,4-naphthoquinone,HNQ)、 蒽醌-2-磺酸盐(anthraquinone-2-sulfonate,AQS)、蒽醌 -2,6-二 磺 酸 盐(anthraquinone-2,6-disulfonate,AQDS)能促进偶氮染料的还原[18-19]。Cui等[20]在有氧情况下利用E. coli CD-2的全细胞,在不添加氧化还原介质条件下,只有8.5%甲基橙被脱色;而在甲萘醌存在的情况下,8 h时的脱色率达到40%以上。利用NQO1在体外进行偶氮染料的脱色研究较少。
本研究将人来源的NAD(P)H∶醌氧化还原酶(hNQO1)在大肠杆菌中成功进行异源表达,并进行蛋白纯化,考察hNQO1对3种偶氮染料刚果红和苋菜红及活性黑5的脱色研究,旨为偶氮染料的脱色及降解提供一种新的研究思路。
1 材料与方法
1.1 材料
1.1.1 菌 株 大 肠 杆 菌E.coli BL21 Gold(DE3)pET28a-hNQO1;大肠杆菌 E.coli BL21 Gold(DE3)pET28a均由所在实验室保存。
1.1.2 主要试剂和培养基 主要试剂:酵母粉(yeast extract),胰蛋白胨(tryptone)购自英国 OXOID公司;异丙基 -β-D-硫代半乳糖苷(isopropyl-β-dthiogalactoside,IPTG)购自天津乐宝生物科技有限公司;BCA蛋白质浓度测定试剂盒购自上海生工生物工程股份有限公司;硫酸卡那霉素(kanamycin sulfate),甲萘醌(menadione)购自上海阿拉丁生化科技股份有限公司;刚果红(Congo red)购自上海源叶生物公司;苋菜红(amaranth)购自北京国纳宸宇科技有限公司;活性黑5(reactive black 5)购自Sigma Aldrich;1,4-二羟基蒽醌(1,4-Dihydroxyanthracene-9,10-dion),甲基对苯醌(2-Methlcyclohexa-2,5-diene-1,4-dione)购自上海毕得医药科技有限公司;1,4-萘醌(1,4-Naphthoquinone)购自上海迈瑞尔化学技术有限公司;蒽醌(anthraquinone)购自国药集团化学试剂有限公司;蒽醌-2-磺酸钠盐(sodium anthraquinone-2-sulfonate)购自上海吉至生化科技有限公司。其他常规试剂均为国产分析纯。
LB培养基:10 g NaCl,5 g酵母粉,10 g胰蛋白胨,121℃ 20 min灭菌使用;固体培养基添加1.5%的琼脂糖。
1.1.3 主要仪器和设备 低温高速离心机;移液枪;TeCan酶标仪;摇床;微孔板振荡器;超声破碎仪等。
1.2 方法
1.2.1 菌体培养 将E. coli pET28a-hNQO1划线于LB固体平板(含50 μg/mL硫酸卡那霉素),挑单克隆接种于3 mL/管的LB培养基(含50 μg/mL硫酸卡那霉素)中,37℃,220 r/min过夜培养16-20 h。将种子液以1%接种量接种至100 mL LB液体培养基(含50 μg/mL 硫酸卡那霉素)中,37℃,220 r/min条件下培养至OD600为0.7-0.8,添加0.5 mmol/L IPTG,10℃,220 r/min,培养24 h诱导蛋白表达。4℃,4 000 r/min离心20 min,弃掉上清液收集菌体,-20℃保存备用。
1.2.2 蛋白纯化 用磷酸钠缓冲液(0.1 mol/L Na2HPO4-NaH2PO4,pH 6.2)重悬菌体,冰浴条件下超声破碎细胞,12 000 r/min离心30 min,收集上清液并于0.22 μm滤膜过滤,使用Ni Sepharose 6 Fast Flow His标签蛋白纯化填料自填装镍柱纯化。
蛋白纯化步骤:用5倍柱体积的去离子水冲洗Ni2+填充层析柱,再用5倍柱体积含有20 mmol/L咪唑的裂解缓冲液(150 mmol/L NaCl,50 mmol/L Hepes,pH 7.0)平衡Ni2+层析柱,随即将过膜后的破碎上清加入层析柱中,使目的蛋白与层析柱充分结合;先用5倍柱体积含有20 mmol/L咪唑的裂解缓冲液(150 mmol/L NaCl,50 mmol/L Hepes,pH 7.0)进行洗脱杂蛋白,再用5倍柱体积含有50 mmol/L咪唑的洗杂缓冲液(150 mmol/L NaCl,50 mmol/L Hepes,pH 7.0)洗脱杂蛋白,最后用含有300 mmol/L咪唑的洗脱缓冲液(150 mmol/L NaCl,50 mmol/L Hepes,pH 7.0)洗脱目的蛋白得到hNQO1纯酶。利用10 kD超滤管去除咪唑并浓缩置换磷酸钠 缓 冲 液(0.1 mol/L Na2HPO4-NaH2PO4,pH 6.2),去除咪唑后,将hNQO1蛋白加入0.6 mmol/L FAD冰上孵育1 h,再使用超滤管置换缓冲溶液,并去掉表面游离的FAD,超滤结束后备用。
1.2.3 hNQO1纯化后的蛋白浓度测定 以牛血清白蛋白(bovine albumin,BSA)为标准蛋白,按照BCA蛋白浓度测定试剂盒说明书测定蛋白浓度。
1.2.4 hNQO1热稳定的测定 用磷酸钠缓冲液将hNQO1蛋白稀释到0.165 mg/mL,取出50 μL hNQO1分别在30、35、40、50和60℃条件下加热30 min,加热完成后,冷却到室温,离心再分别加入100 μL 100 mmol/L pH 6.2磷酸钠缓冲液,以及50 μL 4 mmol/L NADH,于波长340 nm处室温下测定吸光度(反应机理:hNQO1催化NADH→NAD+,在波长340 nm处检测NADH的下降来进一步表征酶的活性)。以最高酶活为100%,计算相对酶活力。
1.2.5 不同的介体小分子对刚果红脱色影响的反应体系 在200 μL反应体系中分别加入0.07 mg/mL hNQO1纯酶,0.5 mmol/L NADH、0.2 mmol/L刚果红,0.05 mmol/L介体小分子(1,4-萘醌、蒽醌-2-磺酸钠盐、甲基对苯醌、1,4-二羟基蒽醌、蒽醌、甲萘醌),100 mmol/L pH6的Tris-HCl缓冲液。在30℃条件下反应6 h,反应0 h和6 h分别使用酶标仪在434 nm处检测吸光度值。以0 h测得的吸光度值作为起始值,计算刚果红的脱色率。
1.2.6 不同浓度的1,4-二羟基蒽醌对刚果红脱色影响的反应体系 在300 μL反应体系中分别加入0.075 U/mL hNQO1、0.5 mmol/L NADH、2 mmol/L刚果红,不同浓度的1,4-二羟基蒽醌(0.02 mmol/L、0.05 mmol/L、0.1 mmol/L、0.15 mmol/L、0.2 mmol/L、0.5 mmol/L),100 mmol/L pH6的 Tris-HCl缓冲液。在30℃条件下反应2 h,取反应液20 μL加180 μL Tris-HCl缓冲液于96孔板中,使用酶标仪在434 nm处检测吸光度值,计算刚果红的脱色率。
1.2.7 hNQO1全细胞对刚果红脱色影响的反应体系 在400 μL反应体系中加入菌体密度(OD600)约为10的hNQO1全细胞或pET28a空载体全细胞,2 mmol/L刚果红,0.1 mmol/L 1,4-二羟基蒽醌,0.1 mol/L的醋酸钠作为反应缓冲液。在40℃下反应6 h,反应完成后12 000 r/min离心2 min,取出200 μL在96孔板中使用酶标仪在434 nm下检测吸光度值的变化。反应结束检测完后,去除上清溶液,加入相同浓度的上述各溶液,在同样条件下进行第二和第三次反应。
1.2.8 hNQO1全细胞对苋菜红脱色影响的反应体系 在500 μL反应体系中加入菌体密度(OD600)约为10的hNQO1全细胞或pET28a空载体全细胞,2 mmol/L苋菜红,0.1 mmol/L 1,4-二羟基蒽醌,0.1 mol/L的醋酸钠作为反应缓冲液。在40℃下反应6 h,反应完成后12 000 r/min离心5 min,取出20 μL反应液加180 μL 0.1 mol/L醋酸钠缓冲液于96孔板中使用酶标仪在520 nm处检测吸光度值的变化。
1.2.9 hNQO1全细胞对活性黑5脱色影响的反应体系 在500 μL反应体系中加入菌体密度(OD600)约为10的hNQO1全细胞或pET28a空载体全细胞,2 mmol/L活性黑5,0.1 mmol/L 1,4-二羟基蒽醌,0.1 mol/L的醋酸钠作为反应缓冲液。在40℃下反应6 h,反应完成后12 000 r/min离心5 min,取出20 μL反应液加180 μL 0.1 mol/L醋酸钠缓冲液于96孔板中使用酶标仪在596 nm处检测吸光度值的变化。
1.2.10 hNQO1对刚果红、苋菜红、活性黑5等偶氮染料脱色率的计算 以不加菌体的吸光度值为起始值,观察染料脱色的情况,根据下列公式计算脱色率。
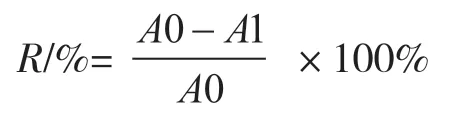
式中:R为染料脱色率(%);A0、A1为脱色反应前后溶液的吸光度值。
2 结果
2.1 hNQO1的表达和纯化
对E. coli BL21(DE3)pET28a-hNQO1挑取单克隆,进行诱导表达后,利用SDS-PAGE检测hNQO1蛋白的表达情况。结果如图1-A所示,在全细胞和破碎上清液中均含有目的蛋白条带,说明hNQO1经IPTG诱导后,在E.coli BL21(DE3)中能够大量地表达,蛋白质实际分子量约为30.8 kD。采用镍柱亲和层析纯化hNQO1蛋白,其SDS-PAGE结果如图1-B所示,纯酶样品在35 kD-25 kD处出现明显条带,与理论分子质量30.8 kD结果相一致。

图1 异源表达 hNQO1 的 SDS-PAGEFig.1 SDS-PAGE of hNQO1 heterologously expressed
2.2 hNQO1热稳定的测定
将hNQO1在一系列温度下(30、35、40、50和60℃)加热30 min后,进行残余酶活测定,结果如图2所示,在30-40℃内,hNQO1较稳定,进一步升高温度,其酶活迅速下降。所以,后续实验在30℃或40℃条件下进行。
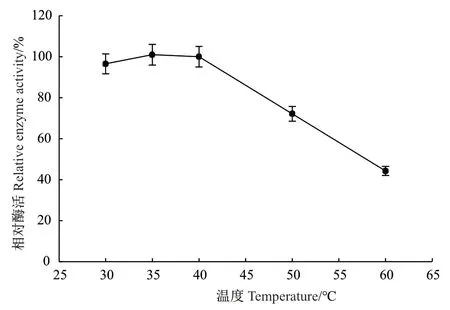
图2 热稳定性对酶活力的影响Fig. 2 Influence of thermal stability on enzyme activity
2.3 偶氮染料及醌类小分子化合物的选择
为研究hNQO1对偶氮染料的脱色作用,选择了刚果红、苋菜红及活性黑5等偶氮染料进行脱色研究(表1)。以醌类小分子化合物(表2)作为介体,辅助醌氧化还原酶对偶氮染料的脱色。介体小分子可以加速初级电子供体向终极电子受体传递,在偶氮染料的脱色过程中起到桥梁作用。具体作用机理为:醌类小分子化合物通过醌还原酶还原成氢醌,氢醌在经过纯化学作用使偶氮染料还原,实现偶氮化合物的脱色。

表1 染料名称及其最大吸收波长Table 1 Dye names and their maximum absorption wavelengths
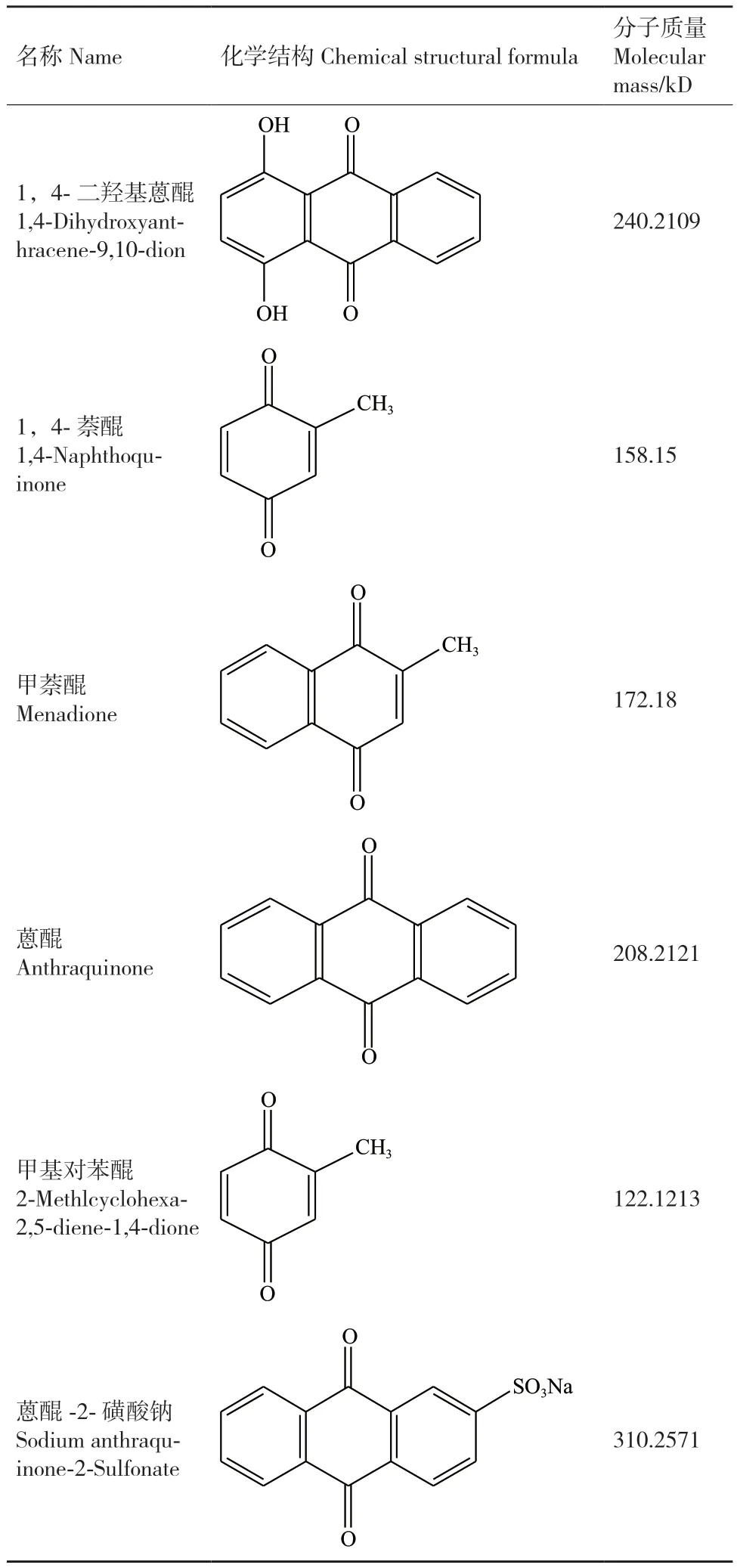
表2 小分子介体的名称及结构Table 2 Names and structures of small molecular mediators
2.4 不同的小分子对hNQO1纯酶脱色刚果红的影响
首先选择0.05 mmol/L为介体小分子(1,4-萘醌、蒽醌-2-磺酸钠盐、甲基对苯醌、1,4-二羟基蒽醌、蒽醌、甲萘醌)在反应体系中的浓度。在反应体系中,分别添加0.05 mmol/L的上述不同的介体小分子,分别以加酶与不加酶作为对照,在30℃条件下反应6 h后,使用酶标仪在434 nm处检测吸光度的变化,记录在不同介体小分子下,hNQO1对刚果红染料的脱色情况(图3)。介体小分子为1,4-二羟基蒽醌时,hNQO1(0.07 mg/mL)对刚果红脱色率为35.5%。所以,与其它介体小分子相比,1,4-二羟基蒽醌辅助hNQO1使刚果红染料脱色效果较好。
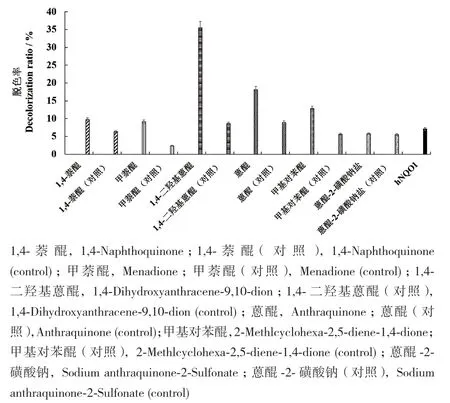
图3 不同介体小分子对hNQO1脱色刚果红影响Fig. 3 Influence of different medium small molecules on the decolorization of hNQO1 Congo red
2.5 不同浓度的1 4-二羟基蒽醌对hNQO1纯酶脱色刚果红的影响
在上述5种介体小分子对hNQO1脱色刚果红染料的影响中,选择以1,4-二羟基蒽醌为目标在反应体系中测试其不同浓度(0.02 mmol/L、0.05 mmol/L、0.1 mmol/L、0.15 mmol/L、0.2 mmol/L、0.5 mmol/L) 对脱色率的影响,在30℃条件下反应2 h,使用酶标仪在434 nm处检测吸光度的变化。如图4所示,介体小分子1,4-二羟基蒽醌在0.1 mmol/L时,hNQO1对刚果红脱色率为29.2%,脱色效果较好,随着小分子浓度的增加可能会存在析出,脱色率差别不大。因此,选择0.1 mmol/L 1,4-二羟基蒽醌进行后续试验。
2.6 重复利用hNQO1全细胞对刚果红进行脱色的研究
经过上述的研究,成功筛选出最佳的介体小分子—1,4-二羟基蒽醌。在1,4-二羟基蒽醌小分子的存在下,pET28a全细胞作为对照,与hNQO1全细胞分别对刚果红进行脱色,我们首先选择了菌体密度(OD600)为2、2.5和10进行刚果红脱色,在434 nm处检测吸光度,相比较菌体密度为10条件下最好(数据未显示)。所以,我们进一步尝试在1,4-二羟基蒽醌存在的反应体系中重复多次利用hNQO1全细胞(菌体密度为10)对偶氮染料进行脱色。如图5所示,在40℃反应6 h后,hNQO1全细胞对刚果红的脱色率为94.0%,而pET28a全细胞对刚果红的脱色率为62.6%。第一次反应结束后,离心去除上清液,二次加入刚果红及介体小分子进行脱色,再次在40℃下反应6 h发现,pET28a全细胞对刚果红的脱色率只有9.5%,而hNQO1全细胞对刚果红的脱色率为79.7%。第三次加入刚果红进行脱色,40℃条件下反应6 h后,发现pET28a全细胞对刚果红的脱色率为5.1%,hNQO1全细胞对刚果红的脱色率为20.3%。菌体3次利用的结果显示,hNQO1全细胞对刚果红的脱色效果较好。

图5 重复利用hNQO1全细胞对刚果红染料脱色的研究Fig. 5 Decolorization of Congo red dye by reusing whole cells of hNQO1
2.7 hNQO1对苋菜红及活性黑5进行脱色的研究
为进一步探究hNQO1对偶氮类染料的脱色效果,选择了其他两种染料:苋菜红、活性黑5进行脱色实验。如图6所示,在1,4-二羟基蒽醌小分子的存在下,pET28a全细胞作为对照,与hNQO1全细胞(菌体密度为10)分别对苋菜红、活性黑5进行脱色,在40℃反应6 h后,hNQO1全细胞对苋菜红染料的脱色率为18.8%,对活性黑5染料的脱色率为16.4%。

图6 hNQO1全细胞对苋菜红、活性黑5等两种偶氮染料的脱色Fig. 6 Decolorization of two azo dyes such as amaranth and reactive black 5 by whole cells of hNQO1
3 讨论
偶氮染料因分子结构含有一个或多个R1-N=N-R2键而命名,因其复杂的结构,很难利用传统的污水处理系统去降解,本研究利用NAD(P)H∶醌氧化还原酶对3种偶氮类染料(刚果红、苋菜红和活性黑5)进行脱色实验,测试不同介体小分子对脱色的影响,选出最佳介体小分子1,4-二羟基蒽醌。hNQO1全细胞对偶氮染料刚果红的脱色率最高为94.0%,且全细胞多次利用后仍存在20.3%的脱色效果。此外,初步探索了hNQO1对苋菜红、活性黑5的脱色,为偶氮类染料的脱色降解提供了一种新的思路。Hong等[21]利用AQS和ADQS作为氧化还原介体考察了Shewanella decolorationis S12对苋菜红的脱色,在8 h后脱色率75%左右。Rahman等[22]利用假单胞菌Pseudomonas euroginosa在好氧情况下对刚果红染料进行脱色,在pH 9,温度为26℃的情况下,反应5 d脱色率达87.64%。上述研究分别对偶氮染料苋菜红及刚果红进行了脱色研究发现,文献中所提到的对刚果红进行的脱色,反应5 d脱色率达87.64%,与本文中对刚果红的脱色率有所差别,本研究通过反应体系的优化最终实现hNQO1全细胞对刚果红最高为94.0%的脱色率,且hNQO1具有较好的稳定性,其全细胞多次利用后对刚果红仍有20.3%的脱色效果。
周觅等[5]在考察E.coli JM109和E.coli YB全细胞对苋菜红的脱色时,48 h脱色率为12%。Wang等[23]在一家纺织厂周围的土壤样品中分离得到Bacillus sp. YZU1菌株(具有偶氮还原酶特性)对多种活性染料具有较强脱色能力(包括偶氮染料),在40℃,pH 7.0条件下对活性黑5的脱色效果最佳。本研究初步探索了在1,4-二羟基蒽醌存在下,反应6 h后,hNQO1全细胞对苋菜红染料的脱色为18.8%,对活性黑5的脱色率为16.4%。一方面后续通过对反应体系的优化,希望能够进一步提高其脱色率;另一方面,与刚果红脱色相比,hNQO1对苋菜红、活性黑5的脱色效果不是十分明显,原因可能是苋菜红、活性黑5与刚果红在结构方面有差异,苋菜红、活性黑5等偶氮染料的脱色与苯环上的取代基的性质、位置、数量有关,甲氧基、磺酸基、硝基、甲基和羧基等基团的存在可能会使染料分子更难脱色[1],同时,高极性取代的磺化偶氮染料较难进入胞内被还原[24]。
4 结论
本研究成功将hNQO1在大肠杆菌中异源表达,并进行蛋白纯化,通过对酶的热稳定性分析发现,其在30-40℃范围内稳定性很好。筛选了6种不同的介体小分子对hNOQ1脱色刚果红的影响发现,1,4-二羟基蒽醌具有最佳的辅助hNQO1对偶氮染料刚果红的脱色效果,hNQO1对偶氮染料苋菜红及活性黑5有微弱的脱色作用。
