冰温酶解贮藏对低盐脱水牡蛎滋味的影响
2021-11-17张毅万金庆杨帆童年
张毅,万金庆,2,3*,杨帆,童年
(1.上海海洋大学 食品学院,上海 201306; 2.上海水产品加工及贮藏工程技术研究中心,上海201306; 3.农业农村部水产品贮藏保鲜质量安全风险评估实验室(上海),上海 201306; 4.安徽宜康高新农业科技有限公司,安徽 六安 237200)
牡蛎是世界上捕捞量最大的贝类,同时也是中国重要的经济贝类之一[1]。因其滋味鲜美、营养丰富而受到关注。呈味氨基酸和核苷酸及其关联物是牡蛎滋味的重要评价指标,但这些指标因养殖区域的不同而受到一定的影响[2]。林海生等[3]研究得出呈味核苷酸主要以腺苷酸(AMP)、肌苷酸(IMP)和次黄嘌呤核苷(HxR)为主,但呈味物质会因地域和品种的不同而呈现差异。有研究表明,酶解可以增强近江牡蛎OstrearivularisGould的滋味[4]。而酶解作为一种简单高效的方法,广泛应用于牡蛎活性肽的生产制备。近年来,Qian等[5]利用酶解制备太平洋牡蛎Crassostreagigas多肽,发现其具有较好的抗氧化活性,可能是天然抗炎成分的潜在来源。Wang等[6]得出类似结论,并指出相比温度、pH和水解时间,酶与底物含量的比(E/S)是酶解反应最关键的条件。现已证实,牡蛎多肽具有抗氧化、抑菌、抗疲劳、抗癌、免疫调节及增强性功能等活性[7]。
酶解作为一项绿色加工手段常用于海珍品的精深加工,现有酶解工艺通常用于牡蛎肽制备,通过牡蛎匀浆后添加高比例的酶(超过2 000 U/g),在最适条件下进行酶解,离心取上清液,采用柱层析或者是膜过滤器截留方式得到牡蛎肽溶液,最后冻干完成牡蛎多肽的制备[5,8-9]。该工艺具有加酶量高、酶解时间短的特点,作为一种水产品精深加工方式完全改变了牡蛎原有的食用习惯,且成本较高、提取工艺相对复杂。鲜活牡蛎蛋白质含量约为9%,酶解反应水解度(DH)在30%左右[10],因此,获得单位质量的牡蛎肽通常需要大量原料进行生产,不可避免造成原料浪费。本研究中,拟利用低盐脱水牡蛎冰温贮藏期长的特点,采用低酶(25 U/g)注射结合冰温酶解,以保持牡蛎原有食用习惯的前提下增加其多肽含量,并考察冰温酶解过程中游离氨基酸及呈味核苷酸的变化,以期达到酶解增鲜的目的,为开发高附加值海珍品提供理论依据。
1 材料与方法
1.1 材料
试验试剂: 总巯基(-SH)测试盒(北京索莱宝科技有限公司)、超微量 Ca2+-ATPase试剂盒(南京建成生物工程研究所)、稳定型Lowry法蛋白浓度测定试剂盒(生工生物工程(上海)股份有限公司)、平板计数琼脂(国药集团化学试剂有限公司)、中性蛋白酶(上海麦克林生化科技有限公司)、风味蛋白酶(上海兰拓生物科技有限公司);氢氧化钠、氢氧化钾、高氯酸、三氯乙酸、氯化钠(国药集团化学试剂有限公司),为分析纯。
主要仪器设备: LHS-150HC恒温恒湿箱(上海一恒科学仪器有限公司)、SLFPTAD型多功能酶标仪(上海基因有限公司)、pH计(上海仪电科学仪器股份有限公司)、TGL-16M型台式高速冷冻离心机(湖南湘仪实验室仪器开发有限公司)、全自动凯氏定氮仪(Kjeltec 8400,丹麦 FOSS)、电子舌(ASTREE,法国 Alpha MOS)、基酸全自动分析仪(L-8800,日本 Hitachi)、高效液相色谱仪(W2690/5,美国 Waters)、冰温干燥装置[11](实验室自行研制)(图1)。
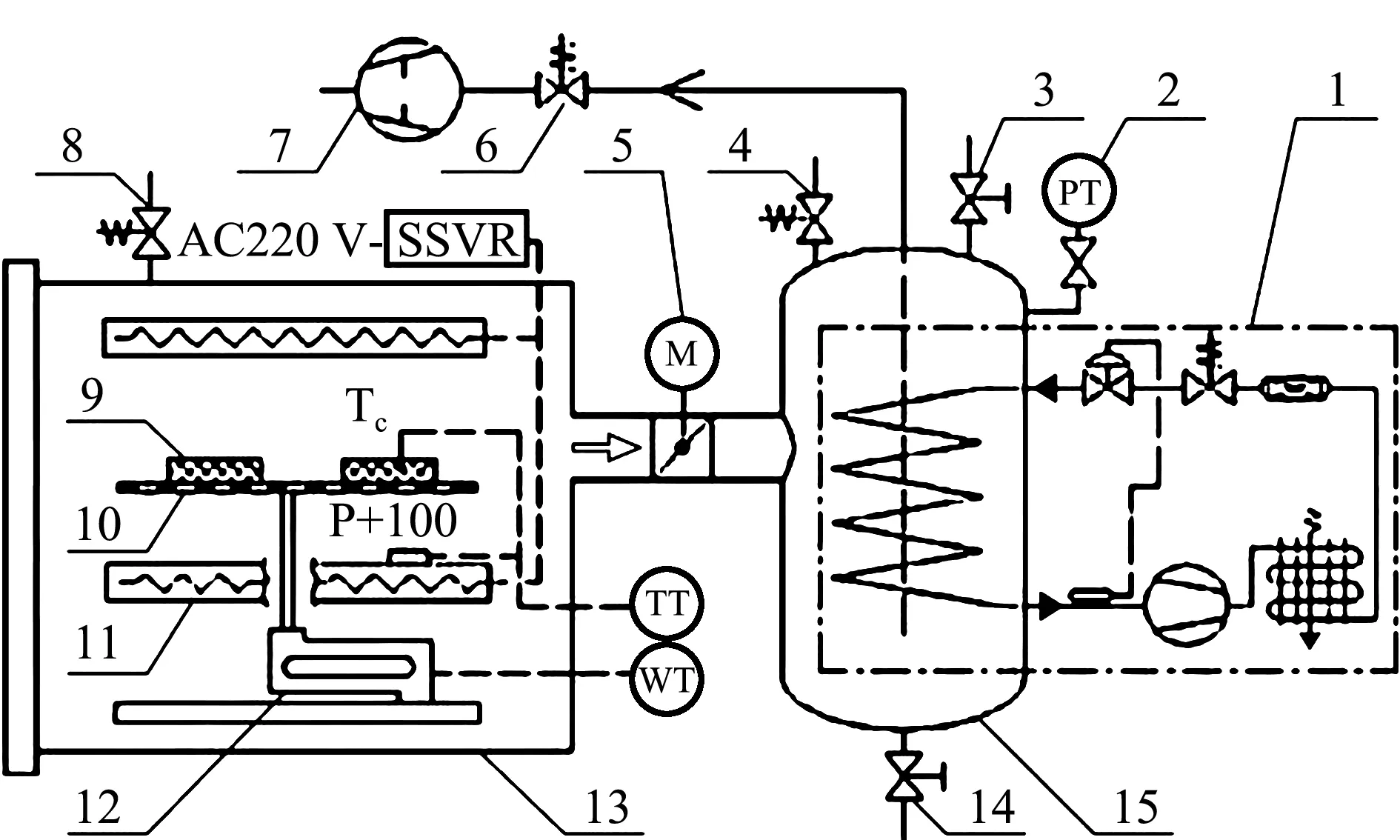
1—冷阱制冷机组;2—真空压力变送器;3—手阀;4—放气阀;5—电动蝶阀;6—止油阀;7—真空泵;8—漏气阀; 9—物料;10—托盘;11—电加热板;12—重量传感器;13—真空箱;14—排水阀;15—冷阱。
1.2 方法
1.2.1 样品处理
原料处理:新鲜太平洋牡蛎购自上海市南汇新城镇农贸市场,去壳质量为(25.0±5.0)g,含水率为80%±2%。开壳取肉后按含盐量1%进行饱和食盐水注射[12],以牡蛎肉中注射25 U/g风味蛋白酶和中性蛋白酶作为试验组,以注射等量蒸馏水作为对照组。具体操作以去壳质量为25.0 g的牡蛎为例进行说明。
盐水注射:室温20 ℃下食盐溶解度为36 g/100 g水,密度为1.33 g/cm3,36 g食盐溶解于100 g水后体积约102.3 mL,25.0 g牡蛎按照1%含盐量计算需要注射食盐0.25 g,则需要注射饱和食盐水体积V1,根据下式
计算得V1=0.71 mL。
酶液注射:试验所用中性蛋白酶的酶活性为50 000 U/g,风味蛋白酶的酶活性为100 000 U/g。取2.0 g中性蛋白酶和1.0 g风味蛋白酶分别用蒸馏水定容至100 mL,此时酶活性为1 000 U/mL,则25.0 g的牡蛎需注射酶液V2,根据下式
计算得V2=0.63 mL。
注射均使用2.5 mL无菌注射器对牡蛎进行操作,以闭壳肌几何中心和沿鳃丝方向约5 mm的牡蛎组织作为注射点,缓慢注射,闭壳肌周围均匀渗液,牡蛎组织缓慢充盈视为注射均匀。
1.2.2 试验设计 试验设3组,分别为注射蒸馏水的对照组(D组)及注射风味蛋白酶(F组)和中性蛋白酶(Z组)的酶解组。 原料经注射处理后进行冰温脱水(-2.0 ℃±0.5 ℃)处理[12],通过质量传感器在电脑界面实时显示牡蛎含水率,待含水率下降至目标含水率(60%±1%)时终止脱水。脱水后的样品进行单个封装,冰温(-2.0 ℃±0.5 ℃)贮藏,每3 d进行一次指标测定。
1.2.3 pH测定 参考Chen等[12]的方法略有改进。测定前将样品在室温下放置30 min,然后切碎取肉糜5.0 g,加入蒸馏水45 mL均质30 s,4 000 r/min 离心10 min,取上清液进行pH测定,每3 d测量一次。
1.2.4 挥发性盐基氮(TVBN)、总巯基含量测定及K值计算 依据《食品中挥发性盐基氮的测定》(GB 5009.228—2016)中的分析方法测定TVBN含量。参照试剂盒说明书操作测定总巯基含量。K值计算公式为
其中:ATP为三磷酸腺苷,ADP为二磷酸腺苷,AMP为腺苷酸,IMP为次黄嘌呤核苷酸,HxR为次黄嘌呤腺苷,Hx为次黄嘌呤,单位均为μmol/g。
TVBN和K值通常用来评价水产品的新鲜程度,牡蛎贮藏过程中通常以TVBN值为20 mg N/100 g作为劣变界限[13]。K值低于20%认为是一级鲜度,20%~60%属于二级鲜度,否则视为腐败[14]。
1.2.5 Ca2+-ATPase活力测定 粗酶液的制备参考陈海强等[15]的方法略有改进。准确称取牡蛎肉糜2.0 g,加入4 ℃预冷蒸馏水18 mL,冰水浴匀浆10 s,取匀浆液2 mL,加入98 mL生理盐水混合均匀,根据超微量Ca2+-ATPase测定试剂盒操作步骤进行。酶活力定义:每小时每克样品中ATP酶分解ATP产生1 μmol无机磷的量为1个ATP酶活力单位(U)。
1.2.6 TCA-溶解肽和游离氨基酸含量测定 取3 g样品沸水浴灭酶10 min,加入27 mL 5%(质量分数)的TCA溶液,匀浆1 min,置于4 ℃冰箱1 h,低温离心(4 ℃,12 000 r/min)10 min。以牛血清蛋白(BSA)作为标准品,采用Lowry等[16]的方法进行测定,结果以mg/g牡蛎样品表示。
参考Wang等[17]的方法略有改进。称取2.0 g样品沸水浴灭酶10 min,加入15 mL 5%(质量分数)的三氯乙酸溶液,匀浆,超声处理5 min,4 ℃静置2 h,低温离心(4 ℃,10 000 r/min,10 min),取上清液5.0 mL,用氢氧化钠溶液(分别为6、1 mol/L)调节pH为2.0,10 mL容量瓶定容,摇匀后用0.22 μm水相滤膜过滤打入氨基酸全自动分析仪进样瓶进行测定。
1.2.7 呈味核苷酸及其关联化合物含量测定 参考徐美禄等[18]的方法略有改进。取5.0 g牡蛎肉沸水浴灭酶10 min,加入10 mL 10%(质量分数)的高氯酸溶液匀浆,超声处理5 min后进行离心(4 ℃,10 000 r/min,15 min),取上清液,用5%(质量分数)的高氯酸5 mL洗涤沉淀,相同条件下离心,合并两次上清液。使用氢氧化钾溶液(分别为6、1 mol/L)调节pH为6.5,50 mL容量瓶定容,摇匀后用0.22 μm水相滤膜过滤打入进样瓶进行测定。
试验采用GL Inertsil ODS-3色谱柱(4.6ID×250 mm)等梯度洗脱,柱温为30 ℃,流速为1 mL/min,进样量为10 μL,紫外检测波长为254 nm。流动相:A为甲醇,B 为0.02 mol/L磷酸二氢钾和磷酸氢二钾溶液(pH 5.8)。
1.2.8 味道强度值(taste activity value,TAV)和味精当量(equivalent umami concentration,EUC)的计算 TAV体现某呈味物质对呈味的贡献[19],其计算公式为
TAV=C/T。
其中:C为样品中某呈味物质含量(mg/g);T为该呈味物质阈值。
味精当量(EUC)[20]表示呈味核苷酸混合物与鲜味氨基酸二者协同作用所产生的鲜味强度,是以谷氨酸钠(MSG)的含量来表示100.0 g样品中总呈鲜物质的量,其计算公式为
EUC=∑(aibi)+ 1218∑(aibi)·∑(ajbj)。
其中:EUC为味精当量(g MSG/100 g);ai为鲜味氨基酸Asp和Glu的含量(g/100 g);bi为Asp和Glu相对于MSG 的鲜度系数(其中Glu=1.0,Asp=0.077);aj为呈味核苷酸GMP、IMP、AMP的含量(g/100 g);bj为呈味核苷酸相对于IMP的鲜度系数(其中IMP=1.0,GMP=2.3,AMP=0.18);1218为协同作用系数。
1.2.9 电子舌分析 参考从娇娇等[21]的方法略有改进,主成分分析(PCA)由AlphaSoft V12.0软件完成。取5.0 g牡蛎肉沸水浴灭酶10 min,加入25.0 mL超纯水,匀浆,超声处理5 min,4 ℃静置30 min,离心(4 ℃,12 000 r/min,15 min),过滤,沉淀重复进行以上操作一次,合并两次上滤液定容至100 mL待用。电子舌进样杯进样量为5.0 mL,加75 mL超纯水定容,每秒采集一次数据,采集时间120 s,取第120 s响应值,每个样品平行取3个样。
酶解过程中,辨别指数(DI值)表征不同样品滋味轮廓区分度,样品数据点无重叠时DI值为正,值越大区分度越高;有重叠时DI值为负,绝对值越高越不易区分[22]。
2 结果与分析
2.1 冰温酶解过程中牡蛎pH的变化
从图2可见:贮藏过程中3组牡蛎的pH均呈下降趋势,其值为6.40~6.00;D组(对照组)pH呈波动下降,整个过程受到两种因素叠加影响;F和Z组由于外加蛋白酶的作用,pH从第3天开始迅速下降,第12天时降到最低点,分别为6.05和6.08,随后升高趋于稳定。
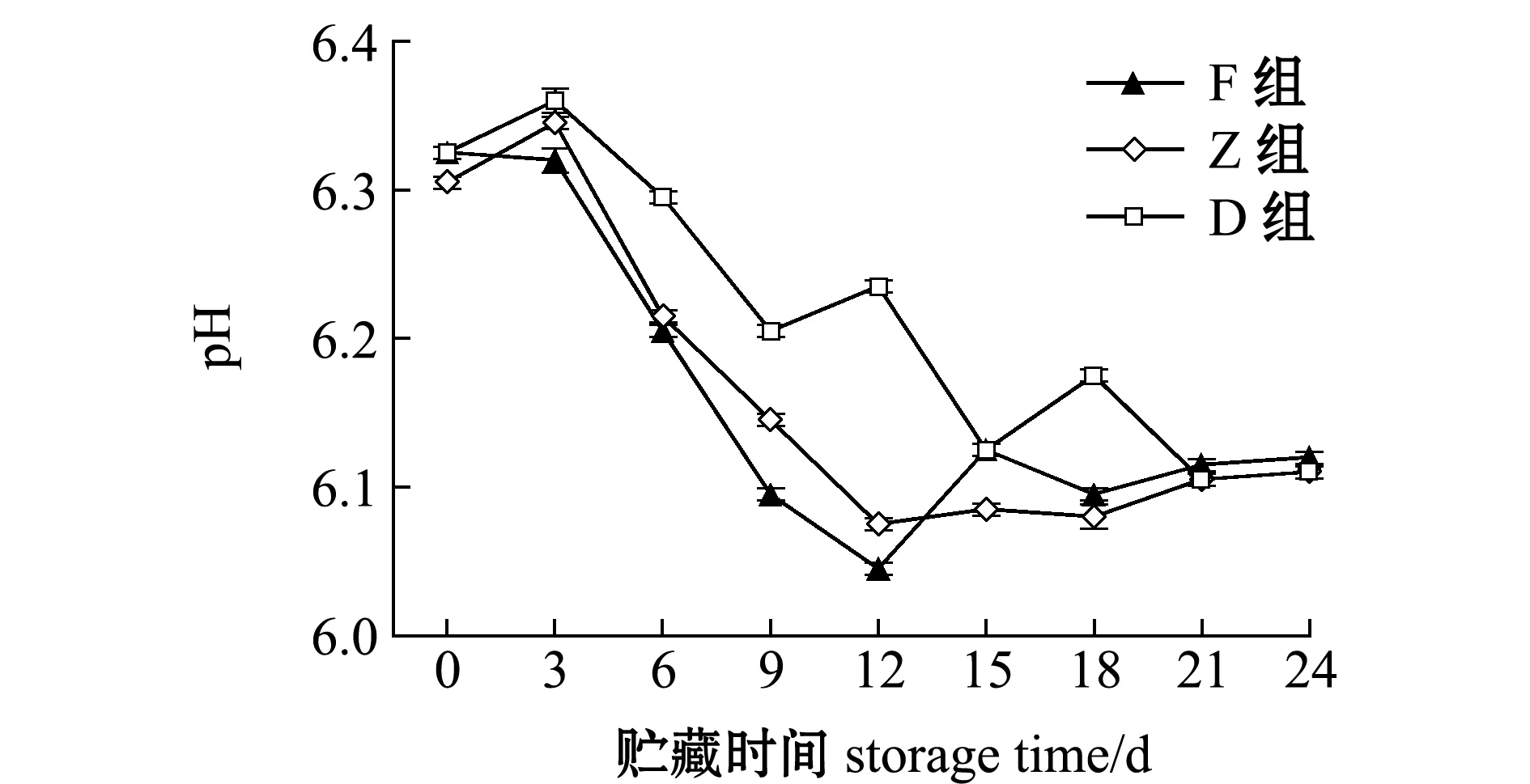
图2 牡蛎酶解过程中pH的变化
2.2 冰温酶解过程中牡蛎K值及TVBN的变化
从图3可见,冰温酶解第0天时,F、Z和D组的TVBN含量分别为6.00、6.20、5.52 mg N/100 g,酶解18 d后F和Z组达到劣变界限,TVBN含量为20.95、21.32 mg N/100 g,D组24 d时达到劣变界限,TVBN含量为20.39 mg N/100 g。
F、Z和D组的K值在酶解过程中均满足二级鲜度(20%~60%)要求,第24天时K值分别为51、57和41,酶解后期K值迅速上升(图3)。Pearson相关性分析表明,K值与TVBN含量极显著相关(P<0.01),F、Z和D组中的K值与TVBN含量二者的相关性系数r分别为0.946、0.938和0.961,相关性均较高,但对新鲜度评价并不完全同步。综合K值和TVBN含量分析,F和Z组贮藏期大致在18 d,比D组少6 d。
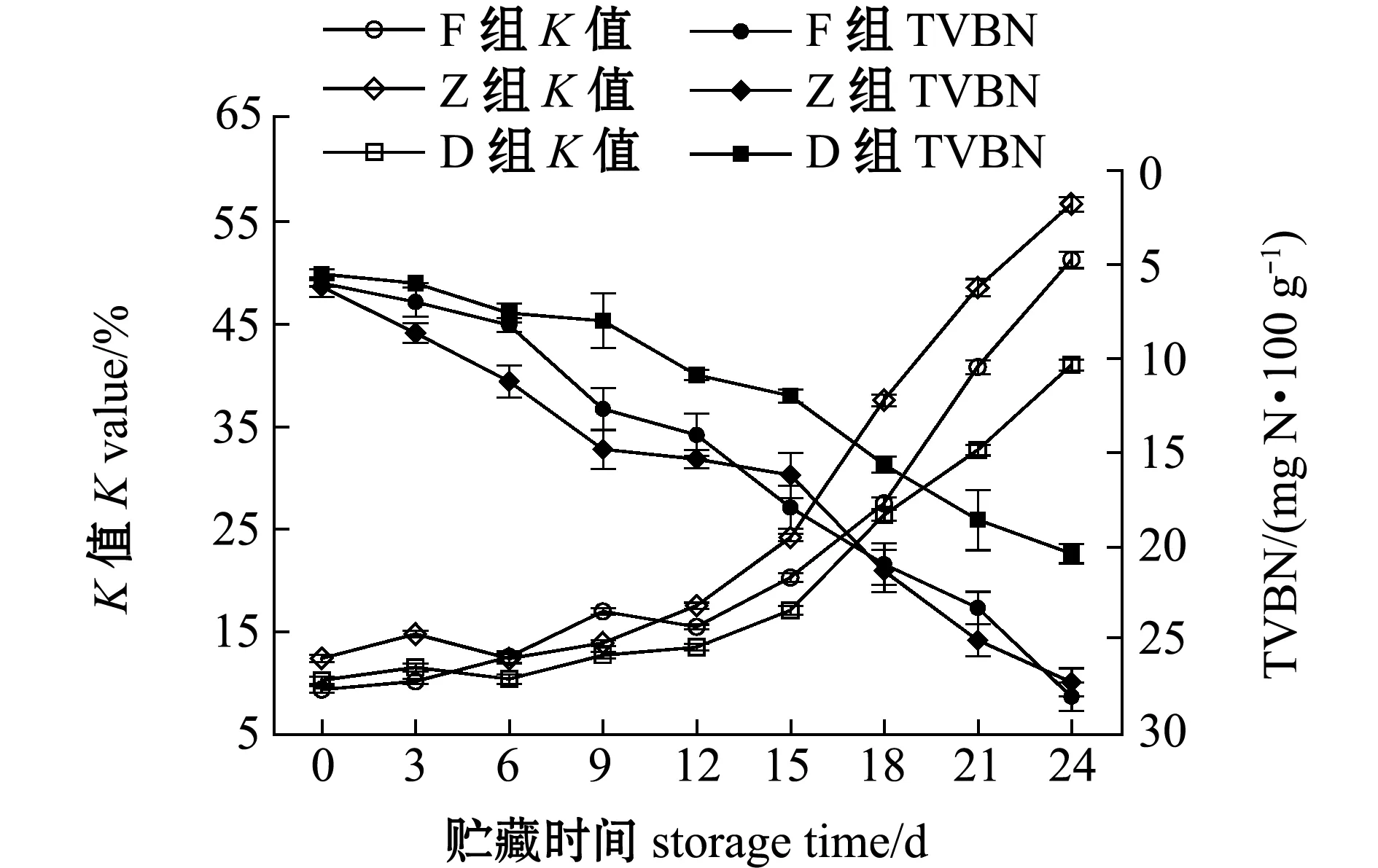
图3 牡蛎酶解过程中K值和TVBN含量的变化
2.3 冰温酶解过程中牡蛎总巯基含量、Ca2+-ATPase活力及TCA-可溶性肽含量的变化
牡蛎冰温酶解过程中总巯基含量、Ca2+-ATPase活力和TCA-可溶性肽变化分别见图4、图5和图6。
在整个24 d的酶解过程中,F、Z和D组的总巯基含量由最初51.83、50.65、53.05 μmol/g prot降低至0.91、0.45、0.95 μmol/g prot,降幅分别达到98.24%、99.11%和98.20%,酶解过程中D组总巯基含量下降最为平缓,其次为Z组,F组最为迅速(图4)。这表明,冰温酶解能有效促进蛋白质降解,使得蛋白质内部巯基暴露被氧化成二硫键。
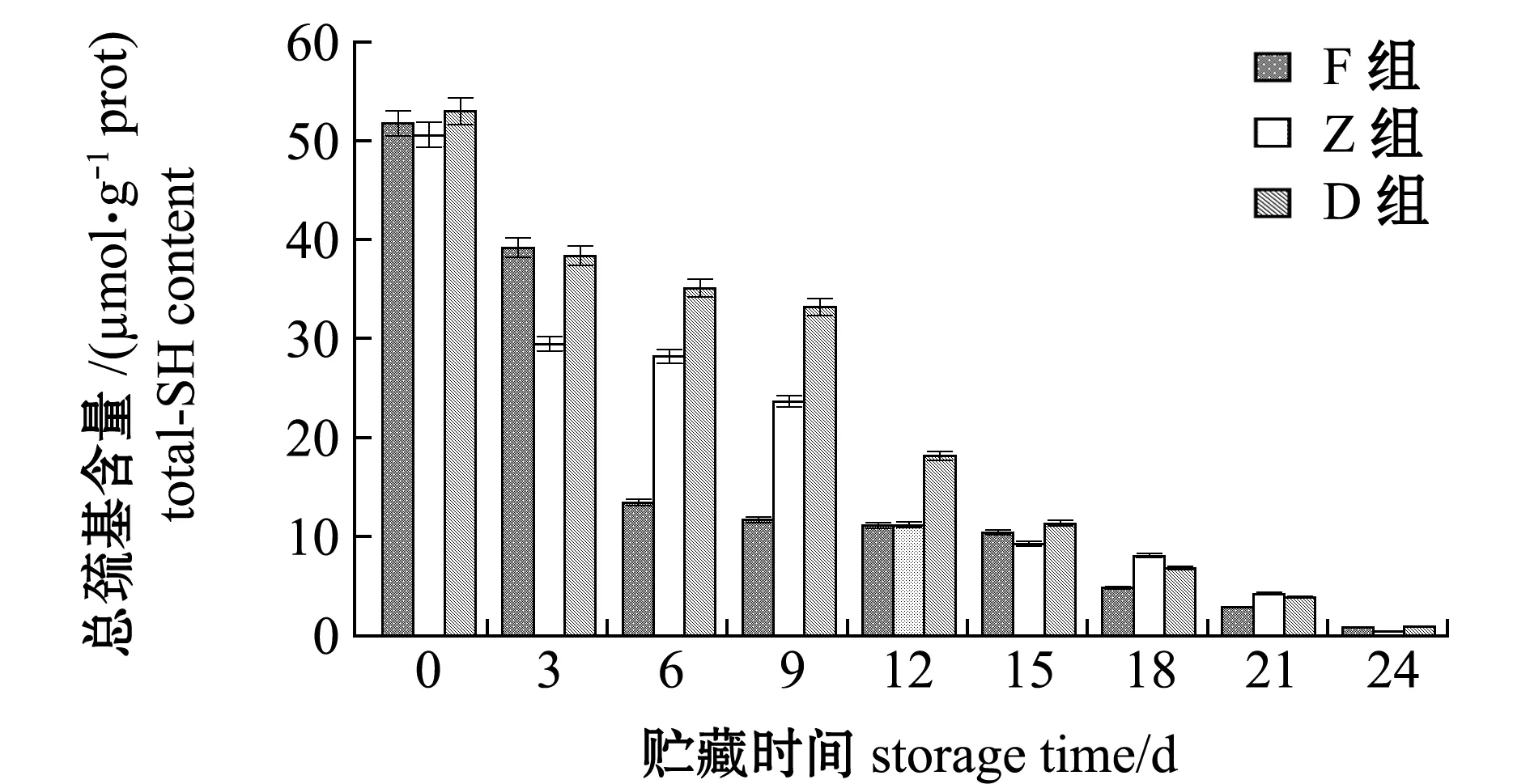
图4 牡蛎酶解过程中总巯基含量的变化
在整个24 d的酶解过程中,D组Ca2+-ATPase活力由5.39 U/mg prot降低至0.21 U/mg prot,与其总巯基变化的Pearson相关性系数r达到0.989,极显著相关(P<0.01);F和Z组的变化规律与D组相同,Ca2+-ATPase活力由5.90、7.25 U/mg prot分别降低至1.69、2.97 U/mg prot,与对应组总巯基含量变化极显著相关(P<0.01),相关性系数r分别为0.996和0.972;酶解期间,D组Ca2+-ATPase活力在同期3组中最低,F和Z组在总巯基含量较低的情况下显示出更高的Ca2+-ATPase活力(图5)。
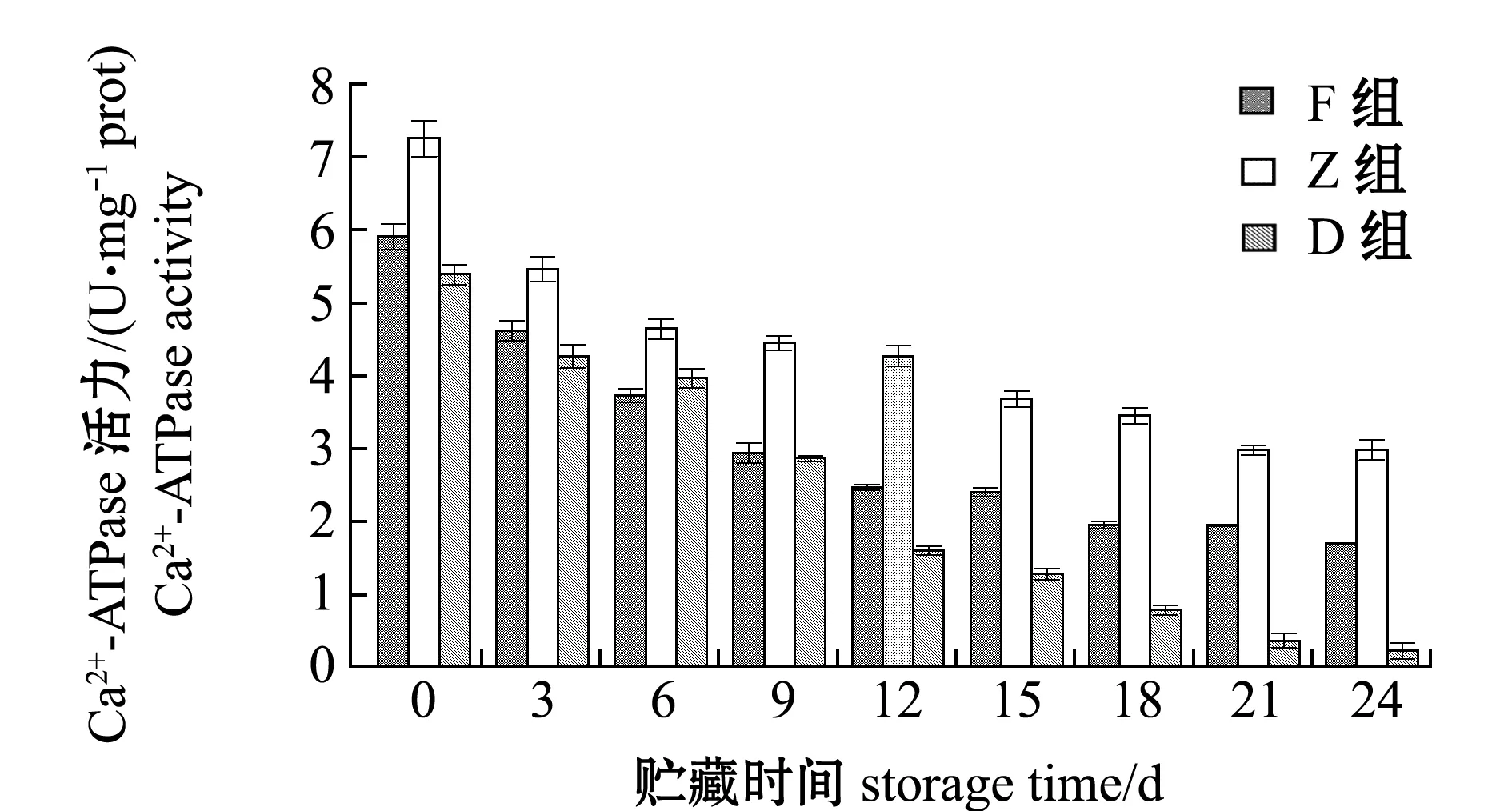
图5 牡蛎酶解过程中Ca2+-ATPase活力的变化
蛋白质降解影响TCA-可溶性肽含量,F、Z和D组酶解前9 d,TCA-可溶性肽显著增加(P<0.05),分别达到181.00、192.11、141.21 mg/g;从第12天时开始,TCA-可溶性肽含量开始下降,第24天时分别降至51.00、98.78、44.36 mg/g;F和Z组肽含量变化规律类似,皆明显高于D组,F组从第18天开始TCA-可溶性肽含量开始迅速下降,可能与风味蛋白酶中含有的氨肽酶和羧肽酶有关(图6)。
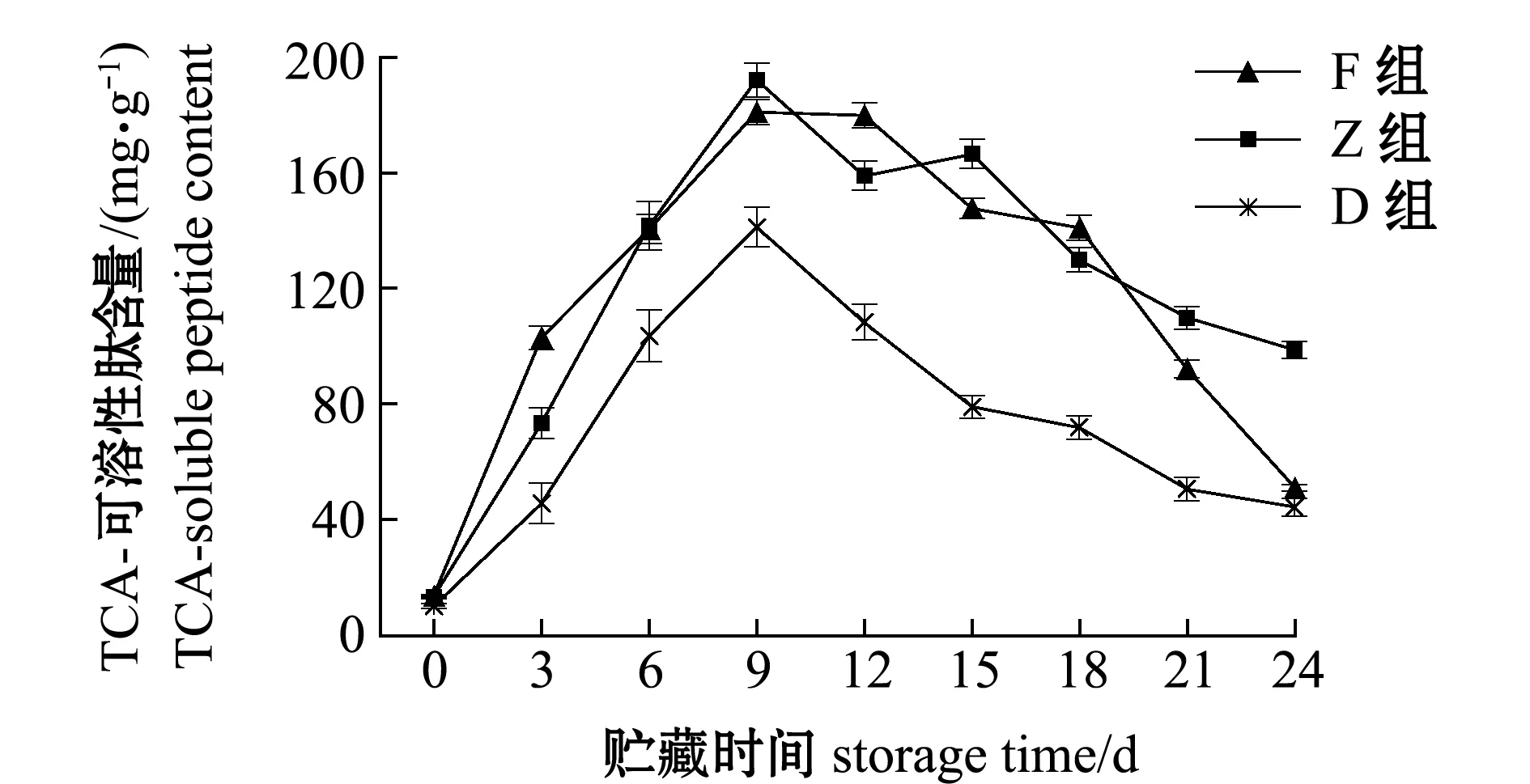
图6 牡蛎酶解过程中TCA-可溶性肽含量的变化
2.4 冰温酶解过程中牡蛎游离氨基酸的分析
酶解过程中,牡蛎鲜味氨基酸(UAA)(天冬氨酸Asp、谷氨酸Glu),甜味氨基酸(SAA)(苏氨酸Thr、丝氨酸Ser、甘氨酸Gly、丙氨酸Ala、组氨酸His和脯氨酸Pro),苦味氨基酸(BAA)(缬氨酸Val、蛋氨酸Met、亮氨酸Leu、异亮氨酸Ile、酪氨酸、苯丙氨酸Phe和精氨酸Arg)的变化如表1所示。酶解期间F、Z和D组总游离氨基酸含量(TAA)差异显著(P<0.05)(除第3天外),总含量变化与酶解时间呈正相关,表明冰温酶解能显著提升牡蛎总游离氨基酸含量(P<0.05);Z组在酶解中后期总游离氨基酸含量上升最为明显,第21天时达32.01 mg/g,显著高于F组(23.30 mg/g)和D组(19.51 mg/g)(P<0.05)。
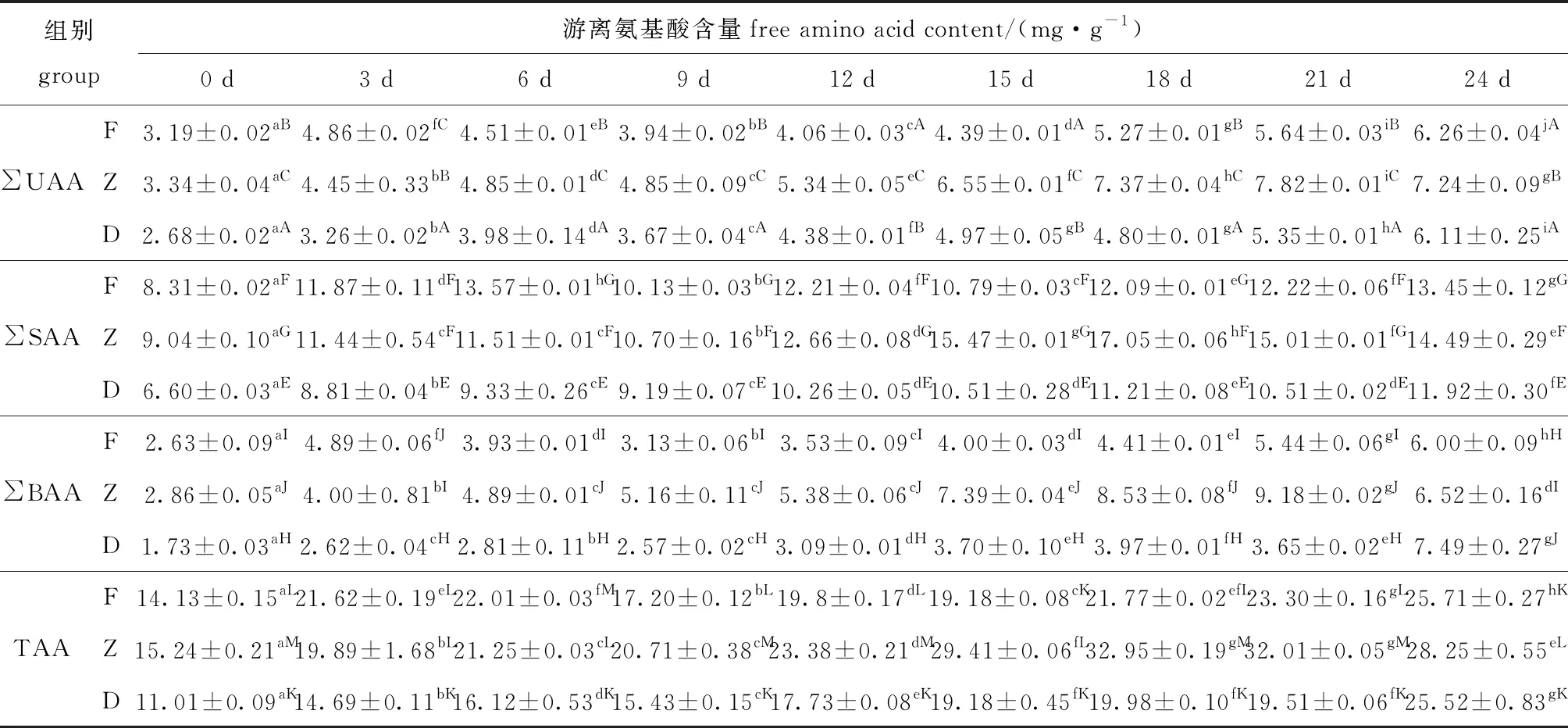
表1 牡蛎酶解过程中游离氨基酸含量随贮藏时间的变化
鲜味氨基酸(∑UAA)、甜味氨基酸(∑SAA)和苦味氨基酸(∑BAA)在含量变化上与TAA变化规律一致,但不同酶解方式使得氨基酸的组成差异明显,酶解第21天时F、Z与D组相比,∑UAA增加0.29、2.47 mg/g,∑SAA增加1.71、4.50 mg/g,∑BAA增加1.79、5.53 mg/g。
游离氨基酸对滋味的影响可以通过TAV值体现,酶解过程中鲜甜氨基酸TAV值变化如表2所示。氨基酸TAV值表明,鲜味氨基酸在呈味过程中占据主导地位,其次是甜味氨基酸,TAV值的变化依赖氨基酸含量的改变。酶解0 d时,F、Z和D组TAV>1的氨基酸皆有4种且种类一致,分别为谷氨酸、甘氨酸、丙氨酸和精氨酸,其在整个酶解期间均具备呈味贡献;随着酶解过程的进行,TAV>1的氨基酸,F组增加脯氨酸,Z组增加脯氨酸和天冬氨酸,D组没有变化。因酶解过程中产生的氨基酸含量不同,同一种氨基酸的TAV值由大至小依次为Z组>F组>D组(表2)。
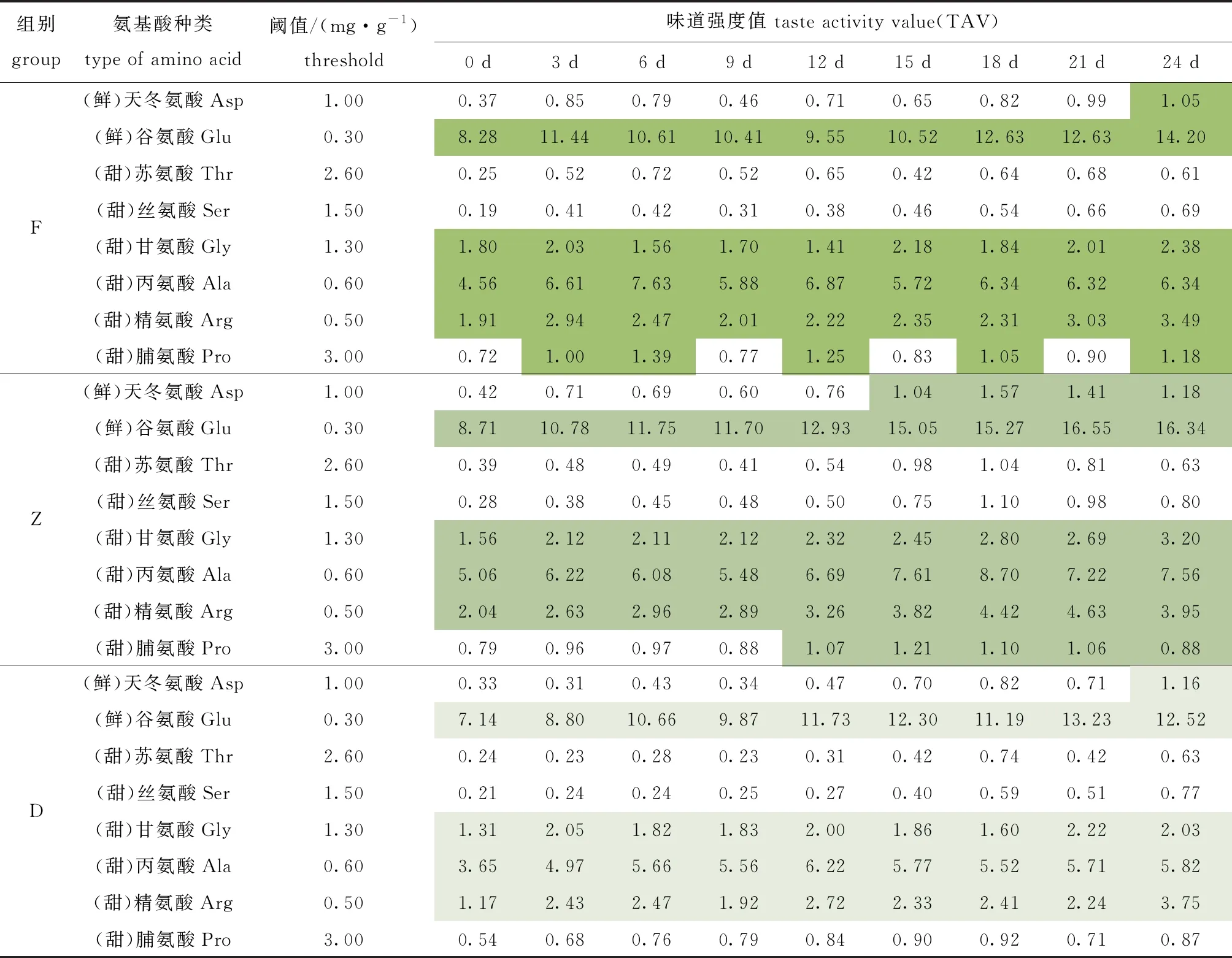
表2 牡蛎酶解过程中呈味氨基酸味道强度随贮藏时间的变化
2.5 冰温酶解过程中牡蛎呈味核苷酸及其关联化合物、EUC的变化
从表3可见:AMP含量在酶解期间内呈下降趋势,第0天时F、Z和D组的AMP含量分别为31.12、34.35、53.85 mg/100 g,第24天时降低至5.22、3.58、9.11 mg/100 g,分别降低83.22%、89.57%、83.07%;F、Z和D组的IMP含量在酶解的第3天时到达积累峰值,分别为155.22、217.13、85.06 mg/100 g,随后开始降低;与D组相比,每个时间点F和Z组的HxR含量均显著提高(P<0.05),使牡蛎K值升高,新鲜度下降。
AMP、IMP和HxR作为牡蛎的主要呈味物质,酶解前期含量波动大,组间差异明显,酶解第3天时,F、Z组与D组IMP含量分别相差71.16、132.07 mg/100 g,是酶解第24天时差值的7.19和5.16倍,同时HxR含量也表现为酶解组具有更高水平(表3),表明冰温酶解能影响呈味核苷酸极其关联化合物变化,前期影响更为明显。
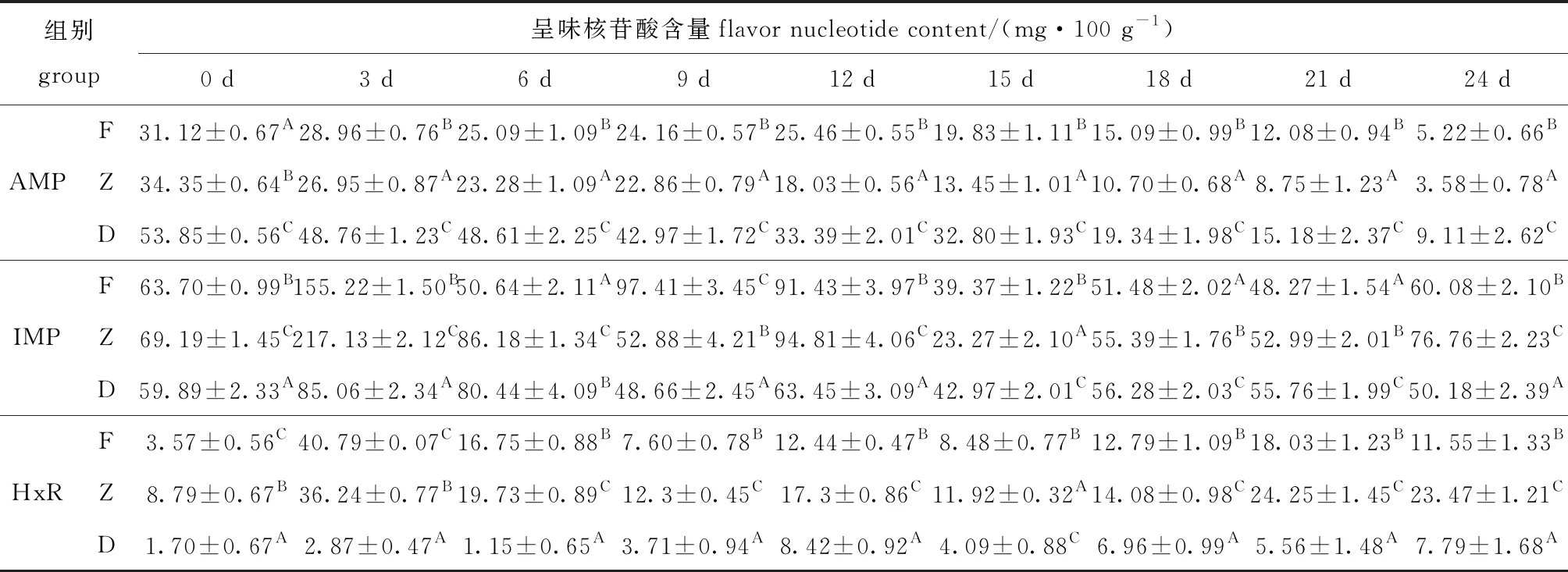
表3 牡蛎酶解过程中AMP、IMP和HxR含量随贮藏时间的变化
鲜味氨基酸与呈味核苷酸的协同作用有增鲜效果,酶解过程中牡蛎味精当量(EUC)变化如表4所示。EUC含量D组峰值出现在第6天,为35.40 g MSG/100 g,F和Z组出现在第3天,分别为68.42、89.23 g MSG/100 g,之后随贮藏时间延长逐步降低,酶解组与D组相比EUC峰值提前了3 d,表明IMP含量变化在牡蛎的滋味形成过程中起到重要作用。

表4 牡蛎酶解过程中味精当量随贮藏时间的变化
2.6 冰温酶解过程中牡蛎的电子舌分析
不同酶解阶段电子舌滋味轮廓的主成分分析(PCA)相关参数见表5,整个酶解期间牡蛎滋味轮廓主成分分析(PCA)见图7。试验中PC1、PC2之和贡献率高于96%,满足应当高于85%要求[19],因此,主成分分析能准确区分冰温酶解牡蛎的滋味变化。酶解期间,F、Z和D组DI值由第0天时的90降低至第21天时的68,表明酶解造成的滋味差异前期区分度更高,随着酶解的进行区分度降低。
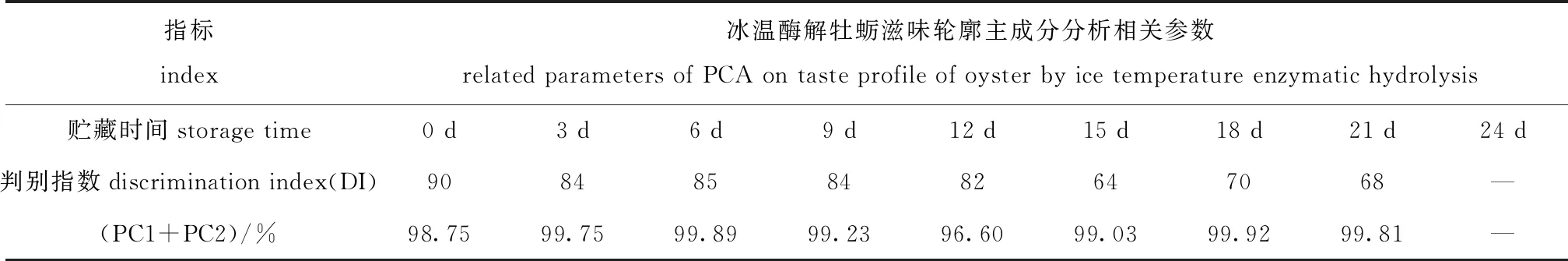
表5 牡蛎酶解滋味轮廓主成分分析(PCA)相关参数
图7(其中代号F0表示F组第0天时,其他代号同理)表明,虽然每个单一的时间段内F、Z和D组滋味能被有效区分,但对21 d内整个滋味变化过程的辨别指数却为-3,数据点的重叠主要发生在前期和后期且数据点区域发生明显改变,说明牡蛎整体滋味在冰温酶解的前后期有着较大差异。
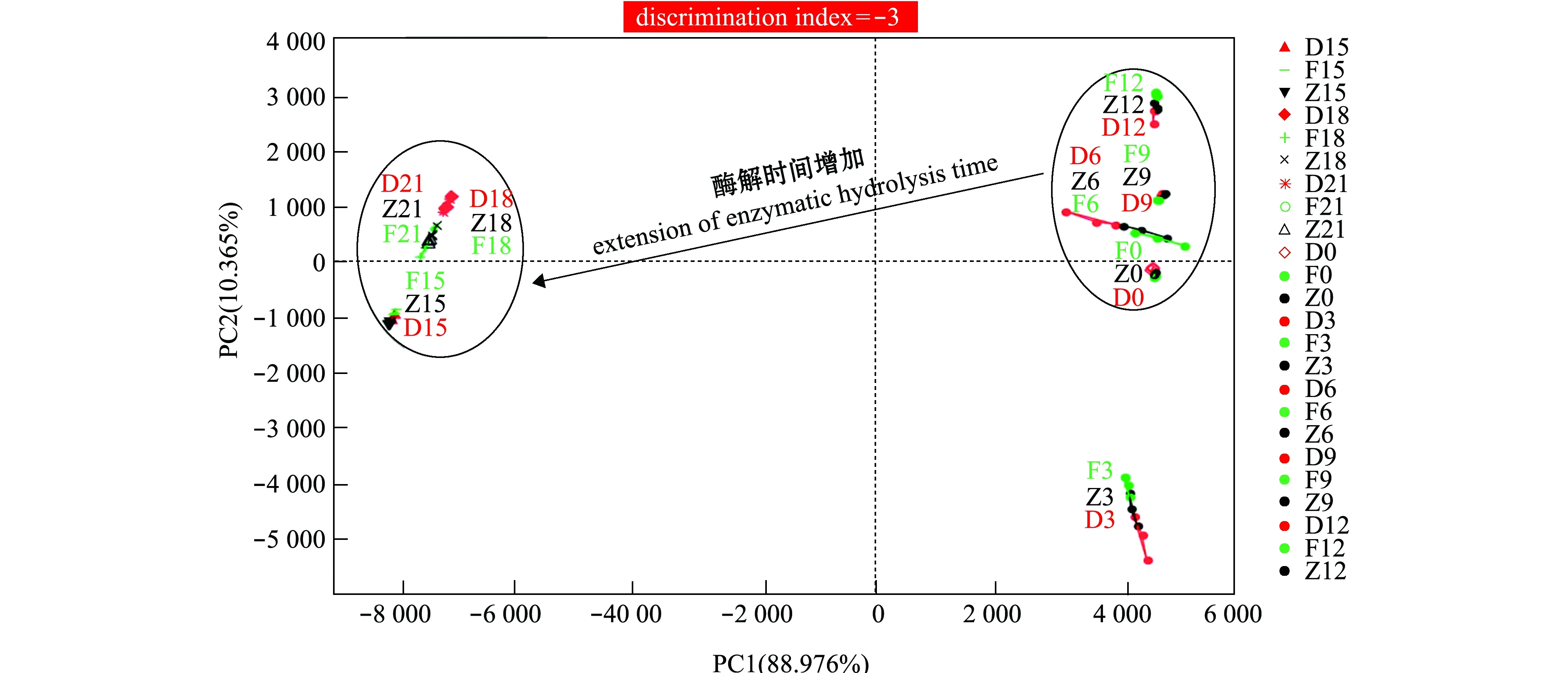
图7 牡蛎酶解过程中滋味轮廓主成分(PCA)分析图
3 讨论
3.1 冰温酶解对牡蛎新鲜度的影响
研究表明,牡蛎糖原含量超过1%[3],冰温酶解过程中糖苷酶释放降解糖原、加速糖酵解过程、产生乳酸累积,可能是酶解前期pH迅速下降的原因。本研究中,随着冰温酶解的进行,蛋白质降解产生的胺类、三甲胺及挥发性碱性物质开始累积,pH升高。这与Min等[23]的试验结果基本一致,pH变化同时受到自溶的影响,可作为对蛋白质降解程度分析的参考指标,pH变化表明蛋白质正在经历降解过程。
Kolakouski[24]认为,水产品低温贮藏过程中的品质变化前期以自溶为主,主要受到内源酶的影响。因此,本研究中添加外源酶进行冰温酶解能加速这一过程,TVBN含量变化是冰温酶解过程中蛋白质降解的重要体现。这解释了F组和Z组酶解前期TVBN值增长快,与D组相比先达到劣变期限的原因。F和Z组TVBN含量差异主要是外源酶酶解特性不同,风味蛋白酶是一种复合酶,含有内切酶和外切酶,而中性蛋白酶作为内切酶作用于肽键,因此,酶解前期牡蛎蛋白质降解速度不同,从而使二者的TVBN含量可能产生差异。
IMP分解产生次黄嘌呤腺苷(HxR)和次黄嘌呤(Hx),HxR和Hx二者累积是K值增加的主要原因。吴依蒙等[25]研究表明,IMP降解受到微生物产生外源酶和自身内源酶的共同作用,其中5′-核苷酸酶是催化IMP降解反应的主要酶之一,存在游离于细胞质和结合于细胞膜两种状态,因此,改变细胞膜结构也能够影响IMP的降解过程。本研究中,低盐脱水牡蛎酶解前期微生物增长缓慢[12],主要受内源酶作用,冰温酶解促进蛋白质降解变性,细胞膜受到破坏,5′-核苷酸酶活力得到释放,这可能使得酶解过程中F和Z组K值明显高于D组。酶解前期K值增长缓慢,随后迅速升高,这与Shi等[26]得出的结论基本一致。酶解加速ATP降解,使得前期IMP大量累积,后期降解生成HxR和Hx,这也可能是从第15天开始F和Z组K值快速上升的主要原因。
3.2 冰温酶解对牡蛎蛋白质降解的影响
谷胱甘肽巯基和蛋白质巯基是生物体内两种主要的巯基,其中蛋白质巯基具有维持蛋白质构象的功能,是判断蛋白质是否变性的重要指标,蛋白质变性会影响Ca2+-ATP的酶活性,该酶存在于生物体组织细胞及细胞器的膜上,总巯基含量及Ca2+-ATPase活力变化可反映酶解过程中蛋白质变性情况[27]。总巯基含量与Ca2+-ATPase活力关系密切,本试验中二者在变化趋势上基本一致,该结果与Sun等[28]的研究结果相同。总巯基含量较低的F和Z组表现出较高的Ca2+-ATPase活力,这可能是因为酶解过程中部分细胞结构受到破坏,使得附着在细胞膜上的Ca2+得到释放,激活Mg2+-ATPase,从而催化ATP分解生成ADP和无机磷[29]。
TCA-可溶性肽含量的变化可反映牡蛎蛋白质的酶解情况,本研究中相同酶解时间下F和Z组TCA-可溶性肽含量显著高于D组,这可能是由于外加酶与内源酶协同作用的结果,Le等[30]研究认为,在贮藏过程中细胞中的溶酶体发生破裂,各种内源酶得到释放是TCA-可溶性肽含量增加的原因之一。本研究中酶解第12天时牡蛎TCA-可溶性肽含量开始降低,Ruiz-capillas等[31]认为,TCA-可溶性肽含量降低与蛋白质变性发生聚集有关,酶解后期pH上升,总巯基含量和Ca2+-ATPase活力变化也证实了这一观点,说明冰温酶解显著促进了牡蛎蛋白质的降解。
3.3 冰温酶解对牡蛎滋味的影响
呈味氨基酸和核苷酸及其关联化合物含量不同会对滋味产生影响[32],当物质味道强度值(TAV)>1时,认为该物质对呈味具备贡献,数值越大表征贡献越高[33]。本研究中,冰温酶解促进F、Z组牡蛎蛋白质降解,总游离氨基酸含量显著升高,与D组相比,鲜甜味氨基酸TAV值上升,对呈味产生积极贡献。杨昭等[4]研究表明,酶解过程中为了达到统一的水解度,风味蛋白酶与中性蛋白酶相比需要更高酶解温度,更大的酶与底物含量比和更长的反应时间,导致同等酶解条件下中性蛋白酶效果更佳,该结论与本试验结果一致。因此,本试验中经中性蛋白酶冰温酶解,Z组鲜甜氨基酸含量显著高于F和D组,EUC含量显著提高。符合朱蓓薇[34]做出的中性蛋白酶作为牡蛎水解酶较为合理的判断。
AMP、IMP和HxR作为牡蛎的主要呈味成分,研究表明,存在AMP→IMP→HxR的降解过程,中间产物IMP呈鲜味特征[2]。本试验酶解过程中,F、Z和D组呈味核苷酸及关联化合物含量差异显著,表明酶处理及酶种类在冰温酶解期间对牡蛎滋味物质有显著影响。Z组IMP峰值显著高于D和F组,同时降解也更为迅速,表明中性蛋白酶对牡蛎呈味核苷酸及关联化合物影响更加明显。HxR的增加意味着K值上升,新鲜度下降,与D组相比,加酶使得HxR含量显著提高,这与前期IMP大量累积并迅速降解密切相关;3组的IMP峰值差异较大,可能是由于不同的酶处理对IMP积累过程影响不同。酶解前期呈味核苷酸及关联化合物的降解主要受到酶活性的调控,F和Z组外源酶与内源酶协同作用使牡蛎蛋白质发生不同程度降解,破坏了细胞膜及相关细胞器膜,作为催化IMP降解反应的主要酶,5′-核苷酸酶的不同程度释放也是造成呈味核苷酸及其关联物降解规律不同的原因,这与吴依蒙等[25]得出的结论基本一致。核苷酸含量差异也是F、Z和D组EUC值出现显著差异的重要原因,因此,冰温酶解主要影响游离氨基酸及呈味核苷酸含量,使牡蛎产生滋味差异。
本研究中,相同酶解时间点电子舌能有效区分F、Z和D组滋味,这与酶解过程中3组EUC含量差异显著密切相关。当酶解时间超过15 d后电子舌数据点发生明显变化,样品前后期数据点发生重叠,DI值为-3,表明整个酶解期间滋味不能有效区分,结合TVBN及K值判断,此时牡蛎新鲜度开始下降,前后期滋味差异使得电子舌数据点区域改变,该结果与Wang等[17]的研究结论基本相同。
4 结论
1)低盐脱水牡蛎经冰温酶解后,其TVBN和K值均显著提高,二者在鲜度指标上高度相关但不完全一致,酶解组牡蛎在20 d内满足鲜度要求,而对照组为24 d。
2)中性蛋白酶冰温酶解低盐脱水牡蛎活性更高,除影响蛋白质降解、改变肽及游离氨基酸含量外,酶解也会对呈味核苷酸及其关联化合物含量产生影响,二者协同作用使味精当量(EUC)显著提高,从而使滋味产生差异。
3)电子舌分析表明,冰温酶解产生的滋味差异前期区分度更高且前后期差异较大,冰温酶解具有显著增鲜效果,滋味差异能被电子舌有效区分,长时间保证牡蛎新鲜度的同时提升了牡蛎肽及游离氨基酸含量。
4)本研究为开发高附加值非冻结生鲜食品提供了相关参考,今后将进一步对其冰温酶解得到的牡蛎肽活性进行鉴定。
