苦参素通过sHH信号通路抑制胰腺癌细胞增殖和侵袭能力研究
2021-11-16任加强
蒋 洁,任加强,王 铮,韩 亮
(1.西安交通大学第一附属医院肝胆外科,陕西 西安 710061;2.陕西省人民医院肿瘤内科,陕西 西安 710068)
胰腺癌是消化道常见的恶性肿瘤,近年来在全球的发病率均呈明显的逐年上升趋势[1-2]。由于胰腺癌发病隐匿,生长迅速,早期出现肝脏转移,诊断时常处于晚期,恶性程度极高,预后极差[3-4]。
随着对中草药研究的不断深入,发现了许多具有抗肿瘤作用的中草药。苦参又名地槐、水槐,始载于《神农本草经》,是一味常用传统中药,为豆科植物苦参的干燥根茎。苦参味苦、性寒;归肝、肾、大肠、小肠、膀胱、心经;具有清热、燥湿、解毒、补中明目,养肝胆气以及利尿等功效[5]。据《本草纲目》记载其用法为“用糯米浓泔汁浸一宿,重重淘过,即蒸之,从巳至申,取晒切用”。《中华人民共和国药典》1977年版中规定“洗净、浸泡约六成透时,润透切片”。苦参素(Matrine,MT)广泛存在于苦参、苦豆子及广豆根等中草药中,具有广泛生物学活性。现代医学表明,苦参素对肿瘤细胞增殖侵袭具有抑制作用,具有较高的抗肿瘤活性及免疫调节作用[6]。但是苦参素抑制胰腺癌增殖侵袭的具体机制不明。
音猬因子/刺猬信号传导途径(Sonic hedgehog,sHH)是胰腺癌发生发展的核心信号通路之一。经典的sHH信号通路是由sHH配体、膜受体补丁蛋白(Ptched receptor,PTCH)和平滑蛋白(Smoothened,SMO)组成的受体复合物以及下游转录因子胶质瘤相关致癌基因(Glioma-associated oncogene homolog,Gli蛋白)组成[7-8]。sHH与受体PTCH结合启动信号通路,引起相应细胞的生物学行为改变。其可调控细胞的增殖、迁移分化等生物功能,在器官的发育和成熟中发挥关键作用[9],课题组前期研究发现sHH通路促进胰腺癌的增殖侵袭能力和神经浸润[10-11]。本课题即是以上课题的传承和拓展。旨在探讨sHH通路在苦参抑制胰腺癌增殖侵袭的过程中扮演的角色。
1 材料与方法
1.1 实验材料 人胰腺癌Panc-1细胞在含10%胎牛血清的高糖DMEM培养基中,于5% CO2、37 ℃培养箱中常规培养,2~3 d用0.25%胰酶消化传代,常规冻存备用。DMEM培养基购自Gibco公司。苦参素购自于西格玛奥德里奇(Sigma-Aldrich),sHH,SMO,GLI-1和内参GAPDH抗体,以及二抗由abcom公司提供。应用DMEM培养基将苦参素浓度稀释为20 μmol/L及40 μmol/L,其中20 μmol/L组定义为低浓度组,40 μmol/L组定义为高浓度组,无苦参素组为空白对照组。
1.2 实验方法
1.2.1 实时定量(Real time,RT)PCR检测mRNA表达:提取细胞DNA参照操作说明。Real time PCR反应条件:95 ℃预变性1 min后进入40个循环(95 ℃变性15 s;55 ℃退火15 s;72 ℃延伸45 s)。数据处理:用GAPDH作为正常对照,采用2-△△Ct法分析各个因子在细胞中mRNA的相对表达量。sHH mRNA引物序列如下:5’-GCTTCGACTGGGTGTACTACG-3’,5’-GCCACCGAGTTCTCTGCT-3’;GAPDH为内参对照,引物序列如下:5’-ACCACAGTCCATGCCATCAC-3’,5’-TCCACCACCCTGTTGCTGTA-3’。
1.2.2 蛋白印迹(Western blot)检测蛋白质表达:各干预组细胞加入细胞裂解液RIPA提取细胞总蛋白。BCA法测定蛋白浓度。配制12% SDS-PAGE胶。将20 μl样品依次加入制好的SDS-PAGE胶中。电泳后,采用半干转膜法转膜1 h。TBST洗膜2次后加入目标一抗4 ℃孵育过夜。再次洗膜2次加入二抗在常温孵育2 h。洗膜后暗室内加入ECL化学发光液,显影后应用凝胶显影系统拍照并分析蛋白表达水平。
1.2.3 细胞构建载体并转染:Panc-1细胞复苏后,添加含 10%胎牛血清、1%青-链霉素的RPMI-1640 培养基中生长,放置于37 ℃、5%CO2恒温培养箱内孵育,胰蛋白酶消化传代。取对数生长期细胞接种于6孔板内,每孔1×104个细胞,放置在37 ℃、5% CO2恒温培养箱内过夜孵育。将未转染的Panc-1细胞组定义为阴性对照组,将Panc-1细胞sh-control组定义为转染对照组,Panc-1细胞sh-sHH组定义为转染组。取1 ml慢病毒液分别加入对应sh-NC组和sh-sHH组细胞中,感染细胞48 h后,弃去原培养基,添加含10%胎牛血清的 DMEM 培养基,通过使用含8 μg/L杀稻瘟菌素S的培养基对感染后的细胞进行筛选,以获得稳定高表达sHH的Panc-1细胞株,用于后续实验研究。
1.2.4 MTT检测细胞增殖:活细胞线粒体内的琥珀酸脱氢酶能使外源性的噻唑蓝(MTT)还原,形成不溶于水的蓝紫色针状结晶并沉积在细胞中,DMSO可以溶解这种蓝紫色结晶,通过酶联免疫检测仪测定其吸光度值,可间接反映活细胞数量。将肿瘤细胞以8×103个细胞接种于96孔培养板中,每孔加入MTT溶液培养,弃去原液,每孔加入DMSO,置于摇床上低速振荡;在酶联免疫检测仪上测定各孔光吸收值(OD值)。计算平均增殖率,增殖率=实验孔OD值/对照孔OD值。
1.2.5 Transwell小室检测迁移与侵袭:取50 μl稀释的Matrigel胶添加在24孔Transwell小室上室,放置于37 ℃下待胶凝固。将对照组、Panc-1的密度调整为2×104个/ml,分别取200 μl悬液加入Transwell 小室上室,下室加入600 μl含10%胎牛血清新鲜培养液,置于37 ℃、5% CO2恒温培养箱中培养24 h,培养结束后取出小室,弃培养液并擦去上室细胞,在小室中加入4%多聚甲醛固定30 min,0.1%结晶紫染色,PBS清洗多余染液,光学显微镜下观察拍摄图像,随机选择5个视野计数,计算细胞侵袭数目,结果取平均值。
1.3 统计学方法 采用SPSS 13.0统计学软件进行分析。计量资料以均数±标准差表示,用t检验,多组数据之间的比较使用单因素方差分析检验。P<0.05表示差异具有统计学意义。
2 结 果
2.1 苦参素对胰腺癌细胞的增殖和侵袭能力的影响 不同浓度苦参素干预胰腺癌Panc-1细胞株,分别在干预12、24和48 h时间点检测胰腺癌细胞的增殖和侵袭能力(图1)。应用MTT检测细胞增殖,计算平均增殖率。结果显示,在同一苦参素干预浓度,随着干预时间的延长,胰腺癌Panc-1细胞的增殖能力逐渐减弱;在同一干预时间段,高浓度组与低浓度组相比,明显抑制胰腺癌细胞的增殖能力(P<0.05)。在研究苦参素对侵袭能力影响时,选取24 h时间点进行观察,结果显示,高浓度组细胞数为(26.00±8.51)个;低浓度组细胞数为(43.00±3.90)个;空白对照组为(64.00±5.42)个。高浓度组与低浓度组分别与空白对照组相比均可明显抑制肿瘤细胞在Transwell小室的穿透能力(P<0.05)。高浓度组的抑制能力强于低浓度组(P<0.05)。见表1。
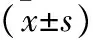
表1 苦参素对胰腺癌细胞增殖水平的影响

A:空白对照组;B:低浓度组;C:高浓度组图1 苦参素对胰腺癌细胞侵袭能力的影响(结晶紫染色,×100)
2.2 苦参素对胰腺癌细胞中sHH信号通路活化的影响 不同浓度苦参素干预胰腺癌Panc-1细胞株,选取24 h时间点观察胰腺癌细胞中sHH信号通路蛋白,如sHH,SMO,GLI-1等的表达。RT PCR统计结果为高浓度组和低浓度组与空白对照组比较的比值,提示苦参素抑制sHH mRNA的表达且成浓度依赖性(P<0.05);苦参素对SMO mRNA的表达无明显影响;苦参素抑制GLI-1 mRNA的表达且成浓度依赖性(P<0.05)。Western blot结果显示(图2),苦参素可明显抑制肿瘤细胞sHH(P<0.05)和 GLI-1(P<0.05)的蛋白表达。见表2。

图2 苦参素对sHH和GLI-1蛋白表达的影响

表2 苦参素对sHH信号通路活化的影响
2.3 转染sHH的胰腺癌细胞构建 应用慢病毒构建高表达sHH的胰腺癌细胞株Panc-1-sh-sHH。Western blot检测各组细胞中sHH蛋白相对表达量,用来评估转染的效果(图 3)。RT PCR结果显示,转染对照组sHH mRNA表达量与阴性对照组比较的比值为(1.29±0.84),转染组与阴性对照组比较的比值为(6.91±0.17)。与阴性对照组及转染对照组比较,转染组中sHH mRNA相对表达量均明显增加(P<0.05)。表示转染效果满意,可用作下一步实验。

图3 转染sHH的胰腺癌细胞构建,Western blot检测sHH蛋白表达
2.4 苦参素通过sHH通路对胰腺癌细胞增殖和侵袭的影响 成功构建高表达sHH的胰腺癌细胞株Panc-1-sh-sHH后,苦参素高浓度组与低浓度组分别干预胰腺癌细胞24 h后,Transwell小室及MTT检测胰腺癌细胞的增殖和侵袭能力(图 4)。应用MTT检测细胞增殖,计算平均增殖率。结果显示,不论在高浓度组或低浓度组,苦参素对胰腺癌细胞增殖能力的抑制程度明显强于sHH转染的胰腺癌细胞Panc-1-sh-sHH(P<0.05)。可见,苦参素通过sHH抑制胰腺癌细胞增殖能力。而低浓度组对胰腺癌细胞侵袭能力的抑制作用明显强于对胰腺癌细胞Panc-1-sh-sHH的抑制作用。同样,在高浓度组,对胰腺癌细胞侵袭能力的抑制作用明显强于对胰腺癌细胞Panc-1-sh-sHH的抑制作用,差异具有统计学意义(P<0.05)。见表3、4。

表3 苦参素通过sHH通路影响胰腺癌细胞侵袭水平比较(个)

A:低浓度组作用于阴性对照组;B:低浓度组作用于转染组;C:高浓度组作用于阴性对照组;D:高浓度组作用于转染组图4 苦参素通过sHH通路对胰腺癌细胞侵袭的影响(结晶紫染色,×100)
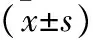
表4 苦参素通过sHH通路影响胰腺癌细胞增殖率比较
3 讨 论
胰腺癌被认为是最致命的癌症形式之一,其特征是肿瘤生长快,早期可转移。近年来,尽管手术和辅助药物治疗措施有所改善,但胰腺癌患者的5年生存率仍然不到10%。由于胰腺癌患者预后不良的主要原因是早期浸润和高转移率,大多数患者在确诊时已存在淋巴转移和血行转移,使得无法施行手术切除治疗[2-4]。然而,目前胰腺癌侵袭和转移的潜在机制仍不明了,确定调节侵袭和转移的关键因素对于提高该疾病的治疗效率来说至关重要。与化疗药物不良反应大的特点相比,中草药具有独特的优势[12-15]。苦参,入药部位为植物的干燥根,春、秋二季采挖,除去根头及小支根,洗净,干燥,或趁鲜切片,干燥。其在全国各地均有分布,味苦,性寒,归肝、肾、大肠、小肠、膀胱、心经。《神农本草经》记载其“主心腹结气,癥瘕积聚,黄疸,溺有余沥,逐水,除痈肿,补中,明目止泪”,《滇南本草》记载其“凉血,解热毒,疥癞,脓窠疮毒,疗皮肤瘙痒,血风癣疮,顽皮白屑,肠风下血,便血,消风,消肿毒,痰毒”。苦参素作为其提取物及主要成分,在心脑血管系统疾病和抗肿瘤的作用价值逐步得到认可并成为研究热点[16-19]。sHH信号通路的异常激活及其配体的过度表达与人类恶性肿瘤有着密切联系,参与了人类多种肿瘤的发生发展,如,基底细胞癌、卵巢癌、肺癌、黑色素瘤、前列腺癌、胃癌以及胰腺癌等多种肿瘤组织中,均可检测到sHH信号分子或其通路分子的高表达[20-23]。课题组长期研究sHH信号通路促进胰腺癌的相关研究并取得成果[24-26]。在本实验中,我们发现苦参素可抑制胰腺癌细胞的增殖和侵袭能力,且与浓度呈正相关性。同时,苦参素可抑制胰腺癌细胞中sHH的表达量,且其通路核心转录因子GLI-1的表达也受到明显抑制[27-29]。即苦参素可抑制sHH信号通路的活化。为了进一步验证苦参素通过sHH信号通路和胰腺癌细胞增殖和侵袭的能力,我们构建高表达sHH的胰腺癌细胞株。然后应用不同浓度的苦参素进行干预,结果显示,苦参素对高表达sHH胰腺癌细胞株增殖和侵袭能力的抑制作用明显减弱。所以,课题关于苦参素通过sHH信号通路抑制胰腺癌细胞增殖和侵袭能力的假说是成立的。
但是本实验仍存在不足之处。本课题为纯粹的体外实验,需要进行体内实验进一步论证。同时单独采用一种胰腺癌细胞具有一定的片面性,需要在多种不同分化程度的胰腺癌细胞中得以验证。另外,本研究仍较多的聚焦于现象学层面,需要对其内在的机制进行研究和探讨。这些问题将在后续的实验中得以补充及完善。
