转化生长因子-β2促进牙髓干细胞增殖和分化的作用研究
2021-11-11熊梦琳吴龙马丽赵今
熊梦琳 吴龙 马丽 赵今
1.新疆医科大学第一附属医院(附属口腔医院)牙体牙髓科 乌鲁木齐830054;2.新疆维吾尔自治区口腔医学研究所 乌鲁木齐830054
造成口腔骨组织缺损的疾病有很多,例如颌 面部创伤或者感染、骨髓炎及肿瘤等。牙髓干细胞(dental pulp stem cells,DPSCs)是一种来源于牙髓组织的具有高度增殖能力及多向分化潜能的间充质干细胞,可分化为成牙本质细胞,是组织工程牙再生、骨再生研究中极具潜能的细胞,可参与牙髓的再生修复[1]。加快诱导DPSCs增殖和成骨向分化,可缩短骨缺损的修复时间。转化生长因子-β(transforming growth factor-β,TGF-β)是通过细胞间信号转导调节细胞活动的一类多肽因子,TGF-β1、TGF-β2和TGF-β3均属于TGF-β家族成员,在骨形成中起重要作用[2]。已有研究[3]表明:TGF-β1过表达可增加DPSCs的增殖及成骨分化。还有学者[4]发现:骨折愈合者血清TGF-β1的浓度高于骨折不愈合者,提示TGF-β1对骨折的愈合有益。TGF-β3对于细胞的增殖、分化、代谢等起着至关重要的作用[5],可促进成骨细胞的增殖和成骨能力,还可促进DPSCs成骨向分化[6-7]。TGF-β2也是TGF-β家族的重要一员,和血管内皮生长因子一起可提高骨缺损区组织的再生[8]。然而目前TGF-β2对DPSCs增殖及成骨分化的影响尚未清楚,本实验旨在通过探索TGF-β2对DPSCs增殖及成骨分化的影响,为修复牙髓组织,促进牙骨再生提供新的方法和思路。
1 材料和方法
1.1 主要试剂与仪器
胎牛血清、DMEM培养基(美国Gibco公司);胰蛋白酶、青链霉素(美国Sigma公司);β甘油磷酸钠、地塞米松(武汉博士德生物工程有限公司);TGF-β2(北京孚博生物科技有限公司);四甲基偶氮唑盐比色法(tetramethylazoazole colorimetric method,MTT)试剂盒(上海晶抗生物工程有限公司);碱性磷酸酶(alkaline phosphatase,ALP)活性测定试剂盒(美国Sciencell公司);二辛可宁酸(bicinchoninicacid,BCA)试剂盒(上海联硕生物科技有限公司);Runt相关转录因子2(Runt-related transcription factor 2,Runx2)、骨涎蛋白(bone sialoprotein,BSP)和骨桥蛋白(osteopontin,OPN)多克隆抗体(上海信裕生物科技有限公司);DAB底物显色试剂盒、苏木素染色液(上海康朗生物科技有限公司);Thermo FC酶标仪(美国Thermo公司);倒置荧光显微镜(日本Olympus公司)。
1.2 DPSCs分离、培养与鉴定
收集临床15~28岁因正畸需要或阻生而拔除的健康完整牙齿,去除表面牙周组织后立即置于预冷的含双抗的低糖无血清DMEM培养液中,于无菌条件下冲洗数遍,劈开牙冠并迅速取出牙髓并剪去根尖1/3,然后用低糖无血清DMEM培养液反复冲洗干净,剪成1 mm3大小的碎块,加入5 mL 2.5%的胰蛋白酶,37℃消化30 min,加入含血清培养液终止消化,去除多余水分,将消化后的组织块平铺于含有15%胎牛血清的高糖DMEM培养基的培养瓶底部,瓶底向上,37℃、5%CO2培养箱中培养,组织块贴壁后翻转瓶底,静置培养。当细胞铺满瓶底80%左右时用胰酶消化,按1∶1首次传代,以后按1∶3传代。取第4代培养3 d的细胞,显微镜下观察细胞形态。
1.3 实验分组
取第4代DPSCs,随机分为阴性对照组、阳性对照组、TGF-β2组。阴性对照组用含10%胎牛血清培养液培养,阳性对照组用含10%胎牛血清培养液+10 mmol·L-1β甘油磷酸钠+10 mol·L-1地塞米松+50 mg·L-1维生素C培养,TGF-β2组用含10%胎牛血清培养液+80 ng·mL-1TGF-β2培养。
1.4 MTT法检测细胞活力
取阴性对照组、阳性对照组、TGF-β2组DPSCs,以每孔5×104个细胞的密度接种于96孔细胞培养板,分别培养1、3、7、10 d(每个时间点设3个复孔)后,每孔加入20μL MTT,继续孵育4 h后弃去上清液,每孔加入150μL二甲基亚砜(dimethyl sulfoxide,DMSO),振荡反应10 min使沉淀溶解,用酶标仪于波长490 nm处检测光密度(optical density,OD)值。
1.5 ALP活性测定试剂盒检测细胞内ALP活性
取阴性对照组、阳性对照组、TGF-β2组DPSCs,以每孔5×104个细胞的密度接种于24孔板中,分别培养1、3、7、10 d(每个时间点设3个复孔)后,加入体积分数为1%的Triton-X100 120μL,反复冻融,充分裂解,裂解后用PBS清洗2遍,12 000 r·min-1离心10 min,取上清液按试剂盒说明书进行操作,于酶标仪520 nm波长处测定OD值。
1.6 蛋白质印迹法检测Runx2、BSP和OPN蛋白表达
阴性对照组、阳性对照组、TGF-β2组DPSCs培养10 d后提取总蛋白,BCA试剂盒定量后将蛋白变性,取30μg蛋白样品进行聚丙烯酰胺凝胶电泳,然后转至聚偏二氟乙烯膜上,用5%脱脂奶粉室温封闭2 h,再分别加入一抗(1∶500),4℃孵育过夜,TBST洗膜;加入二抗(1∶2000)室温孵育2 h,TBST洗涤,用ECL发光液显影,用ChemiDoc XRS+系统成像,Quantity One软件测定各组蛋白条带灰度值,蛋白相对表达水平=目的条带灰度值/β-actin条带灰度值。实验重复3次。
1.7 Runx2免疫组织化学染色检测
取阴性对照组、阳性对照组、TGF-β2组DPSCs,以每孔1×104个细胞的密度接种于24孔板中,培养10 d后用4%多聚甲醛室温固定30 min,5%胎牛血清封闭30 min,加入Runx2多克隆抗体(1∶300),4℃孵育过夜,加入二抗孵育1 h,然后DAB显色,苏木素染色2 min,自来水冲洗后倒置显微镜下观察拍照,用ImagePro Plus软件分析Runx2表达的阳性单位(positive unit,PU),每组实验重复3次。
1.8 统计学分析
实验数据用SPSS 20.0软件进行统计学分析,统计方法采用单因素方差分析,组间两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 牙髓干细胞生长状态
通过酶消化法分离获得DPSCs,传至第4代,生长3 d后观察其细胞形态,大多数细胞为长梭形或多角形,胞体丰满,胞质均匀(图1)。选择本代细胞用于后续实验。
图1 第4代DPSCs培养3 d的细胞形态 倒置荧光显微镜 ×200Fig 1 Cell morphology of the fourth-generation DPSCs on day 3 inverted fluorescence microscope×200
2.2 TGF-β2对DPSCs增殖的影响
阴性对照组、阳性对照组、TGF-β2组细胞培养1、3、7、10 d后进行细胞活力检测,结果见表1。培养1 d后各组细胞活力差异无统计学意义(P>0.05);随着时间延长,细胞活力升高,阳性对照组细胞活力高于阴性对照组(P<0.05),同时低于TGF-β2组(P<0.05)。
表1 TGF-β2对DPSCs增殖的影响Tab 1 Effect of TGF-β2 on the proliferation of DPSCss,n=3
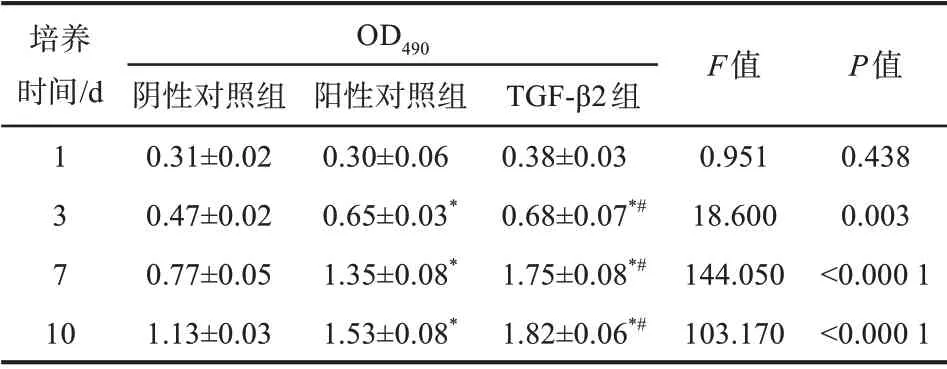
表1 TGF-β2对DPSCs增殖的影响Tab 1 Effect of TGF-β2 on the proliferation of DPSCss,n=3
注:与阴性对照组比较,*P<0.05;与阳性对照组比较,#P<0.05。
培养时间/d 1 3 7 10 OD490阴性对照组0.31±0.02 0.47±0.02 0.77±0.05 1.13±0.03阳性对照组0.30±0.06 0.65±0.03*1.35±0.08*1.53±0.08*TGF-β2组0.38±0.03 0.68±0.07*#1.75±0.08*#1.82±0.06*#F值0.951 18.600 144.050 103.170 P值0.438 0.003<0.000 1<0.000 1
2.3 TGF-β2对DPSCs ALP活性的影响
阴性对照组、阳性对照组、TGF-β2组细胞培养1、3、7、10 d后ALP活性检测结果见表2。培养1 d后,各组细胞内ALP活性的差异无统计学意义(P>0.05);随着时间延长,细胞内ALP的活性总体上调,阳性对照组细胞内ALP活性高于阴性对照组(P<0.05),同时低于TGF-β2组(P<0.05)。
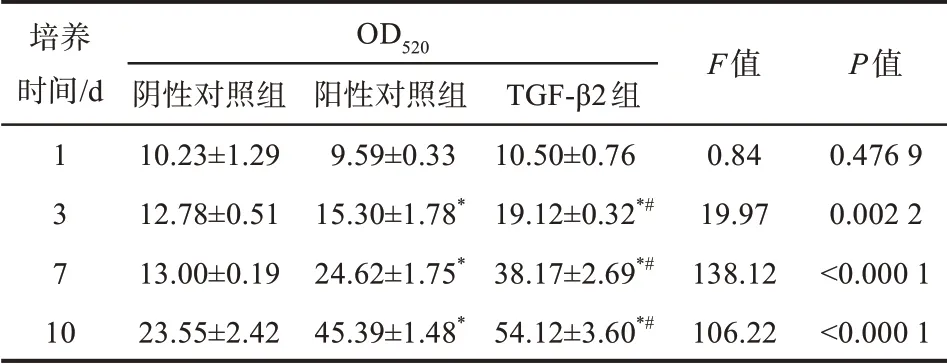
表2 TGF-β2对DPSCs ALP活性的影响Tab 2 Effect of TGF-β2 on ALPactivity of DPSCs xˉ±s,n=3
2.4 TGF-β2对DPSCs Runx2、BSP和OPN蛋白表达的影响
阴性对照组、阳性对照组、TGF-β2组细胞连续培养10 d后检测成骨分化蛋白表达,结果见图2和表3。阳性对照组Runx2、BSP和OPN蛋白表达水平高于阴性对照组(P<0.05),同时低于TGF-β2组,差异均有统计学意义(P<0.05)。
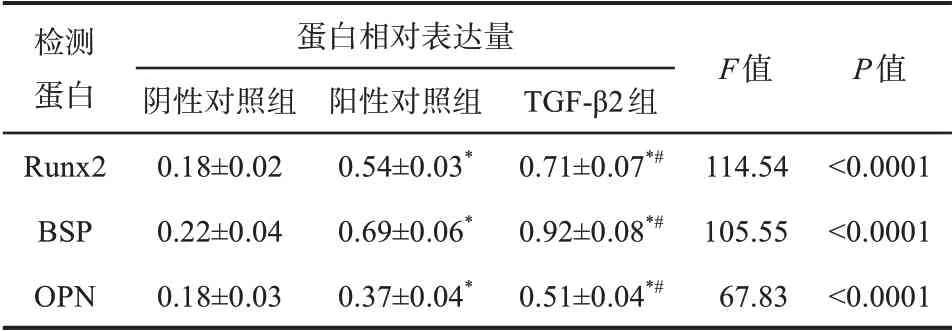
表3 TGF-β2对DPSCs Runx2、BSP和OPN蛋白表达的影响Tab 3 Effect of TGF-β2 on the expression of Runx2,BSPand OPN protein of DPSCs xˉ±s,n=3
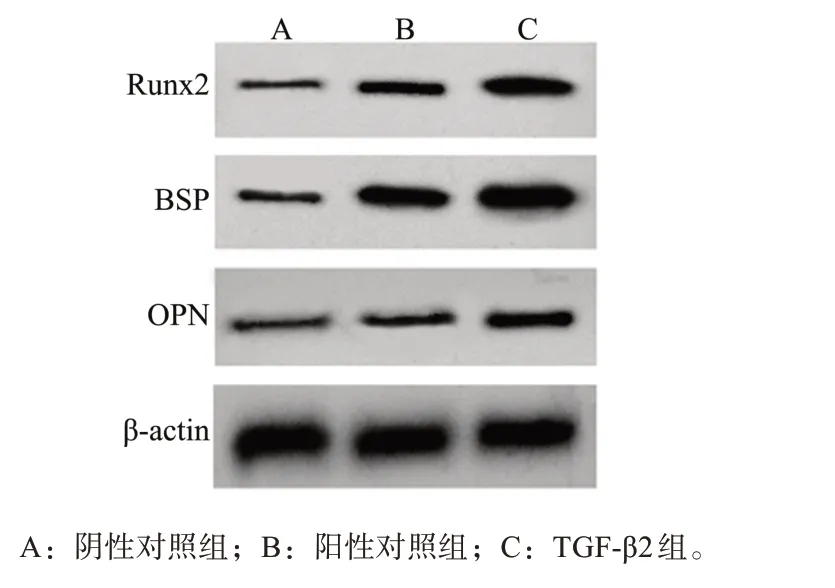
图2 DPSCs中Runx2、BSP和OPN蛋白的表达Fig 2 Runx2,BSPand OPN protein expression of DPSCs
2.5 DPSCs Runx2免疫组织化学染色
阴性对照组、阳性对照组、TGF-β2组细胞连续培养10 d后进行Runx2免疫组织化学染色,结果见 图3,其PU值 分 别 为7.19±0.41、10.78±0.78、12.72±0.76(F=51.98,P<0.000 2)。阳性对照组Runx2阳性表达单位高于阴性对照组(P<0.05),同时低于TGF-β2组(P<0.05)。
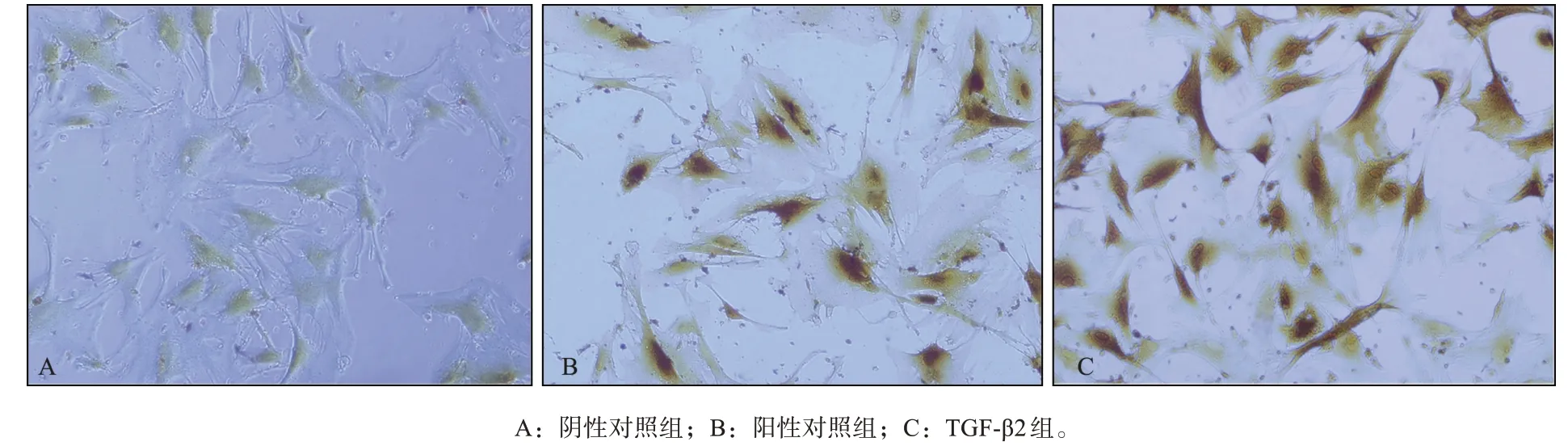
图3 DPSCs中Runx2的表达 免疫组织化学染色 ×200Fig 3 Runx2 expression of DPSCs immunohistochemical staining ×200
3 讨论
DPSCs具有多向分化潜能,一定条件下可以分化为成骨细胞,在组织再生与修复研究中具有潜在作用[9]。本实验通过酶消化法分离培养人DPSCs,培养第4代生长3 d,大多数细胞为长梭形或多角形,胞体丰满,胞质均匀,说明DPSCs分离成功,可用于后续实验。
TGF-β可以调节细胞增殖、分化,对骨改建和骨形成具有重要作用[10]。TGF-β3对DPSCs成骨向分化具有促进作用,TGF-β3联合DPSCs可有效促进种植体的骨结合[11]。TGF-β2可促进骨髓间充质干细胞的增殖,并诱导其向成骨细胞分化[12]。本实验采用TGF-β2处理DPSCs,结果显示:阴性对照组、阳性对照组、TGF-β2组细胞诱导1 d后各组细胞活力差异无统计学意义(P>0.05),诱导3、7、10 d后,阳性对照组细胞活力高于阴性对照组,TGF-β2组细胞活力高于阳性对照组,该结果提示TGF-β2可促进DPSCs增殖。
ALP是反应骨组织中分解代谢水平的一种标志酶,在组织钙化中起着重要作用,其活性在一定程度上可反应成骨细胞的分化程度和功能状态[13]。Runx2、BSP、OPN在细胞分化过程的不同时期形成,可反映DPSCs的成骨能力。Runx2是Runt相关基因家族成员之一,是成骨细胞和软骨细胞形成过程中的关键调节因子,在成骨分化早期起促进作用,可调控间充质干细胞向成骨细胞分化[14]。BSP是一种高度磷酸化和糖基化的分泌性蛋白,具有促进骨的形成及分化,以及成骨细胞的趋化、黏附等功能,是成骨细胞矿化的标志[15]。OPN是一种分泌型的磷酸化糖蛋白,在骨矿化、代谢、重建中扮演重要角色,可促进DPSCs向成骨细胞分化[16-17]。本实验结果显示:阴性对照组、阳性对照组、TGF-β2组细胞诱导1 d后各组细胞内ALP活性差异无统计学意义(P>0.05),诱导3、7、10 d后,阳性对照组细胞内ALP活性高于阴性对照组,TGF-β2组细胞内ALP活性高于阳性对照组(P<0.05)。各组细胞连续培养10 d后,阳性对照组细胞内Runx2、BSP和OPN蛋白表达水平高于阴性对照组,TGF-β2组内细胞3种蛋白表达水平高于阳性对照组。以上结果表明:TGF-β2具有促进DPSCs向成骨细胞分化的能力。由此可以看出,TGF-β2可促进牙髓干细胞增殖和向成骨细胞分化,为临床上骨缺损疾病的治疗提供了新的方法和思路。
利益冲突声明:作者声明本文无利益冲突。
