γ-氨基丁酸豆酱的挥发性风味物质分析
2021-11-05李拂晓李冬龙王晖怡李秋凤刘继栋
李拂晓,李冬龙,王晖怡,李秋凤,刘继栋,2*
(1.广西大学轻工与食品工程学院,广西南宁 530004)(2.广西蔗糖产业协同创新中心,广西大学,广西南宁 530004)
豆酱是一类具有适口的咸、鲜等滋味,广泛流行于中国、日本及韩国等亚洲国家和多个地区的调味品[1]。传统豆酱生产中,豆酱基质经微生物发酵降解形成独特风味[2],维生素、氨基丁酸及异黄酮等有益物质也得到有效提升[3],赋予豆酱一定的功能特性。各地区间的豆酱产品因地域和工艺差异在形态及感官品质上有所不同[4],如中国的黄豆酱与豆瓣酱、韩国大酱及日本纳豆等[5]。基于此,学者们在工艺研究及产品开发上进行了诸多研究,如恒温发酵[6]、混菌复配发酵[7]及低盐发酵[8]等工艺研究与高酚含量绿豆酱[9]、低盐豆酱[10]、及抗氧化豆酱[11]等功能性产品开发。γ-氨基丁酸是一种中枢神经的抑制性神经递质,具有降血压[12]及改善睡眠[13]等作用,在前期研究中,本实验室开发了一款高γ-氨基丁酸(γ-Aminobutyric Acid,GABA)功能性豆酱,该豆酱富含的高γ-氨基丁酸可为功能性豆酱产品的开发提供一定的参考价值。相较于商业豆酱,此产品在功能性及营养性方面已有较大提升,但与消费者接受度密切相关的一些指标仍未得到较好阐明。
通常,除氨基酸态氮含量、色值和pH等常规指标外,风味是衡量豆酱品质以及消费者接受度的重要指标之一[14]。然而,加工工艺条件变化会导致风味物质组成出现差异,如炒籽温度会导致葵花籽酱香味物质种类和含量的差异[15],生产工艺及发酵基质的不同也会导致豆酱香味物质组成差异[16]。迄今为止,研究者们从豆酱中检测到超百种风味物质,并且豆酱独特风味由多种挥发性物质间相互调和形成[17],全面分析挥发性物质组成难度较大[18],因此学者们开始尝试寻找豆酱的特征风味物质以替代全量检测分析。目前,4-乙烯基愈创木酚、2,6-二甲氧基-4-乙烯基苯酚、3-甲基丁醛、异戊酸乙酯、1-辛醇及3-甲基硫代丙醛等被认为是豆酱的特征风味物质[2]。然而,使用常规手段无法准确分析豆酱风味物质组成,顶空固相微萃取-气相色谱质谱联用技术(Headspace Solid Phase Microextration Gas Chromatography Mass Spectrometry,HS-SPME-GC-MS)因快速、简便及重现性好等优点已被广泛用于挥发性成分的组分分析[2],同时,气味活度值[19](Odor Activity Values,OAV)及主成分分析(Principal Component Analysis,PCA)可用于鉴定对整体风味有较大影响的挥发性成分。基于此,本研究使用HS-SPME-GC-MS对9种商业豆酱和GABA豆酱的挥发性成分进行定性定量检测,结合OAV和PCA进一步明确豆酱中贡献度较大的风味物质,同时分析商业豆酱与GABA豆酱间的挥发性成分差异,为豆酱风味品质评价、功能性豆酱开发及风味改善提供一定参考依据。
1 材料方法
1.1 材料与仪器
大豆、糙米,产地广西,购于广西南宁市冠超市;小麦粉,香满园特一小麦粉(73.50%淀粉、11%蛋白质);米曲霉孢子粉(Aspergillus oryzae3.042),上海佳民酿造食品有限公司。2-苯基乙酸乙酯标准品、2-辛醇标准品及甲醇,色谱纯,上海阿拉丁生化科技股份有限公司;C7-C40饱和烷烃混合标准物,色谱纯,西格玛奥德里奇(上海)贸易有限公司。γ-氨基丁酸标准品(纯度>99%)、邻苯二甲醛、β-巯基乙醇,色谱纯,上海麦克林生化科技有限公司;乙腈,色谱纯,广东光华科技股份有限公司;氢氧化钠、甲醛溶液、乙酸钠、蔗糖,AR,成都科隆化学品有限公司。
BMJ-160C霉菌培养箱,上海博迅实业有限公司;pH计,青州市精诚机械有限公司;CM-3600d分光测色计,日本柯尼卡美能达公司;安捷伦1100高效液相色谱仪、安捷伦气相色谱质谱联用仪(7890B-5977),安捷伦有限公司;固相微萃取萃取头50/30 μm(DVB/CAR/PDMS),美国Supelco公司。
1.2 实验方法
1.2.1 豆酱的制备
参考李冬龙等[20]方法进行豆酱的制曲,挑选颗粒较为饱满的黄豆,洗净后浸泡于清水中约12 h以除豆腥味。将浸泡后的黄豆蒸煮30 min,冷却后以黄豆:小麦粉10:2比例制作酱坯,并添加9.0%糙米粉和6.1%蔗糖,接种0.1%米曲霉孢子粉于霉菌培养箱制曲,湿度设置为95%,温度控制为28~30 ℃,制曲时间65 h。将制成的酱曲与17%的盐水按重量比例混合于发酵罐中,于霉菌培养箱中恒温发酵,温度37 ℃,发酵时间35 d,每日翻酱一次,取样前充分混合,该豆酱记为S10。其余豆酱样品购于市场,其中,厨邦黄豆酱(S1)、李锦记黄豆酱(S2)、李锦记辣豆酱(S3)、海天辣豆酱(S4)、海天黄豆酱(S5)、欣和黄豆酱(S6)、家庭自制黄豆酱(S7)、欣和甜面酱(S8)、嘉泰甜面酱(S9)。
1.2.2 氨基酸态氮及总酸含量的测定
氨基酸态氮与总酸含量的测定参考国标GB/T 5009.40-2003《中华人民共和国国家标准酱卫生标准的分析方法》,采用甲醛电位滴定法。
1.2.3 豆酱色值与pH的测定
取适量豆酱用水稀释,利用pH计进行测定。豆酱色值通过分光测色计测定,使用ΔE、L*、a*及b*值表述,色值ΔE的计算公式为:

式中:
ΔE——色值;
L*——亮度;
a*——红绿变化;
b*——黄蓝差异。
1.2.4γ-氨基丁酸含量的测定
利用高效液相色谱(HPLC)测定豆酱中的γ-氨基丁酸含量。色谱条件:色谱柱Agilent HC-C18(250 mm×4.6 mm,5 µm);流动相A为25 mmol/L乙酸钠溶液,流动相B为乙腈,梯度洗脱程序:0~5 min,流动相为90% A、10% B;5~20 min,B相由10%上升至35%;20~28 min,流动相保持65% A、35% B;在28~30 min,B相由35%降低至10%。检测条件:安捷伦VWD检测器,检测波长338 nm;柱温40 ℃;总进样量:10 μL。
1.2.5 挥发性成分的萃取
参考Lu等[2]的方法,称取混匀的豆酱样品5.000 g放置于20 mL顶空瓶中,加入混合基准物质2-辛醇与乙酸苯乙酯的甲醇溶液10 μL(浓度均为10 mg/mL)。将装样的顶空瓶置于50 ℃水浴中平衡10 min,把已老化的萃取头(50/30 μm DVB/CAR/PDMS)插入顶空瓶中萃取30 min,在进样器中解吸附3 min后进样。
1.2.6 GC-MS分析条件
色谱条件:进样方式不分流;色谱柱:DB-Wax(60 m×320 μm×0.25 μm);升温程序:40 ℃保持3 min,3 ℃/min升温至150 ℃,6 ℃/min至240 ℃,240 ℃保持6 min。进样口温度250 ℃;进样方式:不分流;载气为氦气(纯度≥99.99%),流速1.0 mL/min。
质谱条件:电子离子源,离子源温度200 ℃;离子能量70 eV;检测电压350 V;质量扫描范围35~550m/z,扫描速率0.2 s/scans。
1.2.7 挥发性物质定性定量分析
挥发性成分使用NIST谱库检索及保留指数结合进行定性,保留指数以C7~C40正构烷烃进行计算,计算公式为:

式中:
RIz、RIn及RIn+1——未知物、含n及n+1个碳原子正构烷烃的保留指数;
RTz、RTn及RTn+1——未知物、含n及n+1个碳原子正构烷烃的保留时间/min。
检出物质的保留指数参考相关文献及数据库www.odour.org.uk;风味描述查询网址www.flavornet.org及相关文献。
挥发性物质的含量测定采用内标半定量法,计算公式为:

式中:
C2——待测风味组分浓度;
C1——2-辛醇浓度;
S2——待测风味组分峰面积;
S1——内标物峰面积;
m——样品取样量。
1.2.8 感官分析评价
参照GB/T 24399-2009的感官检验方法,随机选择10名受过专业培训的感官分析人员在食品感官分析室中进行评价(评分标准见表1)。

表1 感官评定评分标准Table 1 Scoring criteria for sensory assessment
1.2.9 数据分析处理
所有数据均为三次平行所得,使用SPSS 26.0和Origin 9.6.5对数据进行处理及显著性分析,使用Amdis 2.1对气质质谱图解卷积,NIST 14谱库检索及保留指数匹配风味物质,使用Illustrator 23.0.2软件制图。
2 结果与讨论
2.1 不同豆酱的基础指标及GABA含量对比
对各豆酱样品的基础指标进行测定,结果如表2所示。不同发酵酱产品因工艺及原料的不同而导致pH值存在一定差异,实验结果表明,10种豆酱的pH值分布于3.81至4.88间,其中S6的pH值最高达4.88,S9的pH值最低为3.81,而S10的pH值为4.69,与其他豆酱已无明显差异。

表2 豆酱样品基础指标的测定Table 2 Analysis of common indicators of soybean samples
有机酸作为发酵酱中的重要呈味物质,主要由乳酸菌等微生物代谢产生,与生产过程中的优势菌种及各发酵步骤工艺差异相关[17]。各样品中,总酸含量高低与pH值高低呈现趋势相同,与赵建新[21]的豆酱自然发酵研究结果呈现相似趋势。S10的总酸含量较高,可能因发酵基质中的糖类物质含量较高,促进了发酵酱中有机酸的生成及累积。
氨基酸态氮含量为发酵酱中最具代表性指标之一,各豆酱样品中的氨基酸态氮含量分布于0.55 g/100 g至1.13 g/100 g间,均符合国家标准。其中,S10的氨基酸态氮含量最高达1.13 g/100 g,显著高于其余9个样品,同时还高于前人对豆酱制品的研究[22]。传统发酵酱因整体发酵时间较长,在发酵过程中美拉德反应及微生物代谢减少游离氨基酸积累量,导致氨基酸态氮含量相对较低。而S10因酱曲蛋白酶活较高且发酵时间相对较短,基质降解较快同时美拉德反应消耗的氨基酸有限导致氨基酸态氮含量相对较高。
各样品中的GABA含量分布于0.54 mg/g至1.87 mg/g间,各市售酱的GABA含量与Xu等[3]测定商业豆酱中的GABA含量范围相吻合。S10的GABA含量显著高于其余9个检测样品,相较于最低含量样品S3提升了244.00%,较其余样品中最高的S6也有46.00%的提升,相较前人研究,S10的GABA含量也提升较多[23]。发酵酱中的GABA多由发酵基质带入或经微生物发酵富集,发酵工艺及基质均会导致其含量差异。S10因制曲工艺、制酱工艺、原料与其他样品有所不同,导致其GABA含量存在差异。糙米具有富集GABA的作用[24],S10制作过程中利用糙米作为额外碳源,促进了S10中GABA含量增长。此外,传统豆酱生产中通常使用淀粉作为除小麦粉外的碳源,淀粉经米曲霉产生的淀粉酶水解时,在一定程度上增大了菌体负荷,而S10制作工艺中将淀粉替换为蔗糖,蔗糖作为易代谢碳源,利于微生物生长繁殖,同时,在液态培养中添加外源天然糖也可促进米曲霉产生[25]。
色泽作为豆酱的基础指标之一,需达到红褐色或棕褐色要求。a*为正值时表示色泽偏红,10个样品的a*值均为正值,其中S1至S7共7个样品的a*值均在10以上,特征色为红色。S8、S9因发酵基质中含有糖类且发酵周期较长,使得a*值相对较小,色泽偏黑。S10作为快速发酵豆酱,与色泽形成相关美拉德反应的反应历程较短,因此呈现更高b*值达32.12,特征色为黄色。色差综合评定指标ΔE显示,GABA豆酱S10的色值ΔE高于其余检测样,色泽相对亮丽并已达到国家标准中对发酵豆酱色泽的要求。

?

?
?
2.2 不同豆酱的挥发性物质组
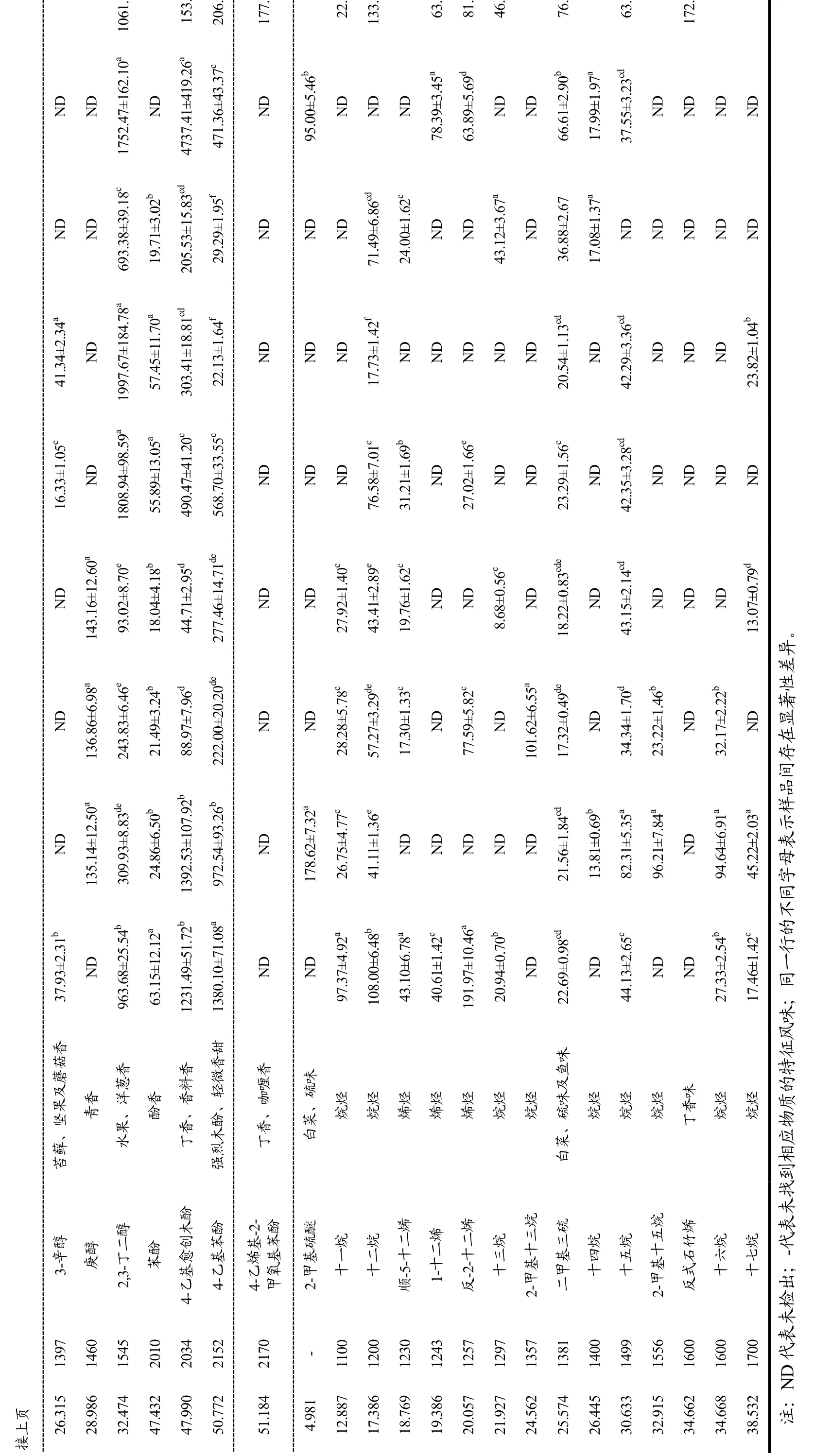
使用HS-SPME-GC-MS对各豆酱中的挥发性物质进行测定,如表3所示,不同豆酱的挥发性成分组成及相对含量存在一定差异,总体上各豆酱的挥发性物质种类与含量与前人的研究相似度较高[21]。10种豆酱样品共检出144种挥发性物质,其中醛类11种、酮类13种、酯类51种、醇类16种、酸类9种、杂环类18种、芳香类11种及其他类15种。其中,S1、S2、S3、S4、S5、S6、S7、S8、S9和S10中分别检出78、72、72、72、68、72、79、70、78及74种。
因检出的挥发性物质种类较多且多为非共检出,故将10个豆酱样品的所有检出物质分为醛类、酮类、酯类、醇类、酸类、杂环类、芳香类及其他类8类对豆酱的风味品质进行整体分析。以总挥发性组分为100%,各类挥发性物质占总挥发性物质相对含量如图1所示。

图1 不同豆酱样品中挥发性物质的相对含量Fig.1 Relative contents of volatile substance in different soybean paste samples
豆酱中的醛酮类物质多由氨基酸及酯类降解产生[26],是发酵产品中重要的香气成分,为豆酱提供花香及焦香等特征风味。S10中醛类和酮类物质分别占挥发性物质总含量的7.15%和8.37%,其中醛类物质气味阈值较低,对豆酱的香气有显著贡献[27]。GABA豆酱醛类物质检出中含量最高为苯甲醛,特征风味为焦糖香。在酮类挥发性物质中,S1-S10中均检出2-辛酮,且S10含量最高。酯类物质来自发酵过程中酸与醇的反应[28],是豆酱风味中的重要组成成分,各豆酱样品中的酯类物质种类丰富且含量均较高。S10中酯类检出数量最多为25种,占总挥发性成分的22.20%,其中含量最高的为棕榈酸甲酯,表现出油脂香。由表1可知,乙酸乙酯、亚油酸甲酯和亚油酸乙酯对GABA豆酱的油脂香风味贡献较大。
醇类和酸类物质虽种类相对较少但含量较高,醇类化合物有效推动豆酱风味形成[29]。除S1和S6外,醇类化合物总含量占比最高,其中S10样品中醇类化合物占挥发性物质总含量的39.66%,乙醇、3-甲基-1-丁醇和苯乙醇属于常见醇类化合物,其中3-甲基-1-丁醇为碳水化合物在发酵时经EMP途径分离出来的支链醇[30],使S10具有麦芽及焦香风味。S10及多组对照样品中,酸类物质含量仅次于醇类和酯类,S10中山梨酸含量较低可能因制作时未添加防腐剂山梨酸钾。杂环类和芳香类含量相对较低,但仍是豆酱风味形成的重要组分;其他类中则主要为烷烃、烯烃及含硫化合物等,含硫化合物参与风味形成,而烷烃及烯烃对风味形成的贡献较小[31]。
2.3 不同豆酱的挥发性物质主成分分析与综合评价
主成分分析是一种将多个变量通过降维为少数综合变量,以简化数据反映原始信息的多元统计方法[32]。对各豆酱样品不同种类的挥发性物质进行PCA,利用8大类挥发性物质在PC1(51.70%)和PC2(20.60%)上的得分图和载荷图如图2所示。由图2a可知,不同豆酱样品的挥发性物质具有较为明显的区分性。样品S1、S2、S3、S6、S8在得分图上的距离较近,表明这5个样品的8大类挥发性物质组成相似度较高,且与其他样品有明显区分。S9与其他样品的距离较远,表明其与其他样品的风味组成有较大差异。由S10在得分图中与其他样品的距离可知,S10与S2、S7、S8的挥发性物质组成有较大相似度。由图2b可知,第一主成分中载荷值较大的为醛类、酯类、酸类、杂环类和芳香类,说明其与豆酱的挥发性组分相关性较强,为PC1的代表变量;第二主成分中酮类及醇类的载荷值较大,为PC2的代表变量。

图2 不同豆酱样品中8类挥发性物质的得分图(a)及载荷图(b)Fig.2 Score diagram and load diagram of 8 volatile substances in different soybean paste samples
根据PCA结果,S10得分较低。因占51.70%贡献率的第一主成分特征向量为醛类、杂环类、芳香类及酯类,S10中这四类物质含量相对较低,导致其综合得分较低。然而,S10在酮类有较大载荷(如图2),其中,2-庚酮含量达1232.69 μg/kg显著高于其余样品(p<0.01),其嗅闻阈值为45 μg/kg[33],根据香气活性值(OAV)计算公式可得其OAV值达27.39。通常,OAV值大于1对风味有较大贡献度,OAV值越高,该物质对样品风味贡献度越大[34]。同时,其他类中的反式石竹烯仅在S10中检出(172.95 μg/kg),其嗅闻阈值为64 μg/kg[26],OAV值为2.70,呈现丁香花香味。从制酱时间长短分析,S10仅发酵35 d,风味物质积累时间较短,而李杨等[35]研究发现发酵42 d前各类挥发性物质均呈现逐渐积累趋势。此外,S10采用单菌发酵,与混菌发酵相比风味可能相对不足[36],故各类挥发性物质总量上存在一定差异。
2.4 不同豆酱中共有特征挥发性风味物质分析
将挥发性物质归类分析可较为粗略评价豆酱的风味品质,但不同挥发性物质的特征风味及阈值均存在差异。由表1可知,10种豆酱样品中共有特征风味有43种,其中山梨酸为防腐剂,除S7、S10外的8款商业豆酱中均有标注添加,检测浓度显著高于样品S7与S10。甲氧基苯基肟在各种产品中均有检出[37],但呈味能力较弱,对风味的贡献度较小。因此通过剩余41种共有挥发性物质来评价10种豆酱的风味品质差异,其中,醛酮类7种、酯类14种、醇类8种、杂环类7种、酸类1种、芳香类3种及其他类1种(图3和图4)。

图3 41种共有风味物质的得分图(a)与载荷图(b)Fig.3 Scores diagram (a) and loads diagram (b) of 41 common flavor substances
S1-S6等6个样品在得分图中的距离较近(图3a),说明S1-S6的共有特征风味相似度较高。S10与其他样品的距离较远,在共有特征风味上面,GABA豆酱与其他样品存在一定差异。结合图4可知,S10中的2-辛酮、2-戊基呋喃、2-乙基-6-甲基吡嗪、愈创木酚、醋酸α-甲基苄酯、二甲基三硫、1-丁醇的相对含量较其他样品高,这也是S10与其他样品共有特征风味存在差异的原因。由图3b可知,3-甲基丁醛、α-亚乙基-苯乙醛、可卡醛、乙酸乙酯、2-甲基丁酸乙酯、乙酸异戊酯、己酸乙酯、辛酸乙酯、丁内酯、乙酸苯甲酯、苯乙酸乙酯、月桂酸乙酯、十四酸乙酯、棕榈酸乙酯、3-甲基-1-丁醇、3-甲硫基丙醇、2,5-二甲基吡嗪、2,6-二甲基吡嗪、4-乙基愈创木酚与PC1有较强的正相关性,而1-丁醇、麦芽酚则与PC1呈现较强的负相关;苯甲酸乙酯、2-呋喃甲醇、4-乙基苯酚与PC2呈较强的正相关,与PC2呈负相关的是2-辛酮、2-戊基呋喃、2-乙基-6-甲基吡嗪、愈创木酚。
各豆酱样品中共有的醛酮类化合物有7种(表1),其中,2-甲基丁醛(阈值4.40 μg/kg)[2]、苯甲醛(阈值100.00 μg/kg)[33]的OAV值均大于1,对风味贡献显著。2-辛酮的特征风味为花香、青香,而S7、S10中的含量显著高于其余样品(图4);豆酱中的酯类物质检出种类最为丰富,各豆酱中共有的酯类挥发性物质有14种,主要呈现水果香味和花香。其中,S10中的共有酯类浓度相对较低,只有呈栀子花香醋酸的α-甲基苄酯的含量显著高于其余样品,可能为发酵时间短导致(图4);豆酱中的醇类主要由微生物代谢产生,S1-S10中均检出的醇类物质为8种。其中,作为主要醇类的乙醇由酵母菌等代谢产生,在S8中相对含量最高达7.71 mg/kg,S1最低也达2.31 mg/kg,有研究表明,添加7.5~15%的乙醇能丰富豆酱的风味并获得更优异的感官评分[38]。各豆酱中均检出苯乙醇和3-甲基-1-丁醇,其OAV值均大于1,对风味的贡献显著,是豆酱的特征风味物质[2]。1-丁醇及异丁醇因阈值较高导致其OAV<1,仍可能对豆酱的风味形成存在辅助作用[39]。

图4 41种共有风味物质热力图Fig.4 Thermodynamic diagram of 41 common volatile compounds in 10 kinds of soybean pastes
各豆酱中共有的酸类和杂环类较少,分别为9种和7种,与现有研究使用固相微萃取法检出酸类种类较少的结果相似[40]。杂环类风味物质多来源于发酵过程中的美拉德反应,在豆酱特有风味形成中起积极作用[41]。由图4可知,S10中2-乙基-6-甲基吡嗪、2-乙酰基吡咯、2,3,5-三甲基吡嗪相对含量高于多数样品,说明S10具有更丰富的坚果及焙烤风味,这与制作过程中添加蔗糖促进麦拉德反应的发生有很大关系。
芳香类物质在10个豆酱样品中仅共同检出4种,其中愈创木酚、4-乙基愈创木酚及4-乙基苯酚是酱油、豆酱的特征风味物质[17],为木酚、芳香味。其中,S10中的愈创木酚相对含量最高达241.69 μg/kg,在其他类中,仅共检出二甲基三硫,各样品的OAV值均远大于1,对风味有较大贡献,其中S10的二甲基三硫相对含量最高,为76.32 μg/kg。
综上,S10样品经短时发酵,检出的挥发性化合物种类丰富,多数共检出风味物质含量已接近商业豆酱,部分香味物质含量已高于商业产品,其中S10中的杂环物质与芳香物质含量高于其他样品,这使得GABA豆酱与其他样品在共有特征风味上存在一定差异(图4)。
2.5 各豆酱产品的感官评价分析
感官评价结果(表4)表明,各豆酱产品的感官评价得分较高,色泽、香味、滋味和组织状态方面均有较好品质。其中,S5的各项评价得分较高,S10次之,在香味方面,S10的感官评价得分高于其他样品,这与S10中的杂环类物质相对含量较高导致其与其他样品风味存在差异相符合。S10及其他样品的色泽相对亮丽、组织状态黏稠均匀无杂质。综合评价结果可知,γ-氨基丁酸豆酱的感官品质较佳。

表4 感官评价得分Table 4 Sensory evaluation score
3 结论
在本研究中,通过多项基础指标、游离氨基酸及挥发性香味成分组成等方面对γ-氨基丁酸豆酱(S10)与商业豆酱(S1-S9)的综合品质进行准确评价。对各豆酱样品的基础指标进行测定表明,各豆酱的pH值差别不大,本研究中所制得的γ-氨基丁酸豆酱的pH值正常,色泽鲜艳亮丽,氨基酸态氮(1.13 g/100 g)和γ-氨基丁酸豆酱GABA(1.87 mg/g)含量不仅高于本研究中其他样品,且高于前人对多种豆酱制品的相关研究,赋予了GABA豆酱高γ-氨基丁酸的功能特性。在HS-SPME-GC-MS分析10种不同来源豆酱中的挥发性成分时,共检测出144种挥发性风味物质,共有挥发性物质为41种,包含醛类、酮类、酯类、醇类、酸类、杂环类、芳香类和其他类。其中,醛类、酯类、酸类、杂环类、芳香类及醇类对豆酱特征风味形成的贡献度较大。γ-氨基丁酸豆酱与商业发酵将的风味物质组成成分无明显差异,且部分特征风味位置含量高于商业产品,具有一定的工业化应用潜力。OAV值大于1的各挥发性物质中,2-甲基-丁醛、3-甲基-1-丁醛、苯乙醛、二甲基三硫和愈创木酚对豆酱风味的形成影响较大。结合共有挥发性物质PCA结果,不同来源的豆酱挥发性物质种类和含量有一定差异,S1-S6六个样品的共有挥发性物质相似度较高。γ-氨基丁酸豆酱中的酱香味风味物质2-戊基呋喃、2-乙基-6-甲基吡嗪和愈创木酚等显著高于其余样品,赋予了γ-氨基丁酸豆酱更浓郁的酱香风味。综上,本文基于豆酱产品风味物质组成与制备工艺的相关性分析,综合分析研究了γ-氨基丁酸豆酱作为快速发酵豆酱产品与商业豆酱的成分分析,可为功能性豆酱多元化生产开发提供借鉴。
