黄芪甲苷对镉联合高脂高糖致糖尿病小鼠胰脏损伤的保护作用
2021-11-05龚频刘萌裴舒亚杨倩杨文娟陈福欣
龚频,刘萌,裴舒亚,杨倩,杨文娟,陈福欣
(1.陕西科技大学食品与生物工程学院,陕西西安 710021)(2.西安科技大学化学与化工学院,陕西西安 710054)
随着人民生活水平的提升及生活方式的改变,糖尿病患者的数量逐年增加,且有极高的患病率、致残率和死亡率,已成为严重威胁人类健康的疾病之一。最新数据表明,截至到2015年全球有超过4亿1500万人患有糖尿病(Diabetic Mellitus,DM),预计在2040年将增加到6亿4200万人,中国DM患者人数最多为1亿960万[1]。流行病学的调查结果显示,在中国成年人中,DM总患病率为10.9%[2]。糖尿病的病因十分复杂,迄今为止尚不清楚,它可以引起心、脑、肝、肾、胰脏等多种器官的损伤,严重危害人类的健康。
重金属镉(Cadmium,Cd)被广泛的应用于染料、电池等行业,但镉的毒性较大,被国际癌症机构列为Ⅰ类致癌物。镉的生物半衰期为10~30年,易于在生物体内富集,特别是在肝脏、肾脏以及骨骼中富集,从而引起机体出现健康损害甚至中毒。日常生活中镉暴露主要来自于食物、水源以及香烟燃烧[3,4]。流行病学研究表明,镉暴露与糖尿病的发生发展存在密切的关联[5-7],但是镉暴露对糖尿病状态下的胰脏的损伤作用报道较少。同时,研究显示,高血糖所致的氧化应激是导致糖尿病胰岛素抵抗的原因之一。高血糖使机体内部血糖持续增高,诱导氧化应激反应,大量活性氧簇(ROS)被聚积,胰脏处于氧化应激状态,易激活多个损伤机制而破坏其结构和功能[8]。
目前,关于糖尿病的治疗主要包括注射胰岛素及口服降糖药,如磺酰脲类,双胍类,α-葡萄糖苷酶抑制剂和格列奈类,但糖尿病患者长期服用会使机体产生耐药性且对肝脏,肾脏等器官造成损伤[9]。与化学药物相比,传统中药大多来源于自然界,且一般都含有多种药理作用,很多中药材有药食同源的功效,对机体的毒副作用相对较低,因此,从天然产物中筛选和发现降血糖活性成分成为糖尿病新药研发的重要方向[10,11]。
黄芪是蒙古黄芪、膜荚黄芪的根,性味微温、甘,在中国被广泛用于治疗消渴症及其并发症,黄芪具有补气升阳、固表止汗、利水消肿、托毒生肌等功效,《神农本草经》有云:“主诸热黄疸,肠澼泄痢,逐水,下血闭,恶疮疽蚀火疡。”。黄芪甲苷(Astragaloside IV,AS-IV)是其重要的功效成分之一。黄芪甲苷的主要药理作用包括增强免疫力、抗炎、抗氧化、抗病毒等,在临床上被用于治疗肾病、糖尿病、心脑血管等疾病[12],已有研究表明黄芪甲苷可以降低血糖水平,改善胰岛素抵抗,降低氧化应激及炎症反应,从而起到保护作用[13,14],但是黄芪甲苷对镉诱导的糖尿病小鼠的胰脏损伤的保护作用尚未见报道。
1 材料与方法
1.1 实验材料
SPF级雄性昆明小鼠[许可证号:SCXK(陕)2017-003],购自西安交通大学实验动物中心;黄芪甲苷购于源叶科技有限公司,纯度大于99%,其结构式如图1所示。氯化镉(CdCl2)购自天津市福晨化学试剂厂,生理盐水购自西安京西双鹤药业有限公司;其他试剂均为分析纯。
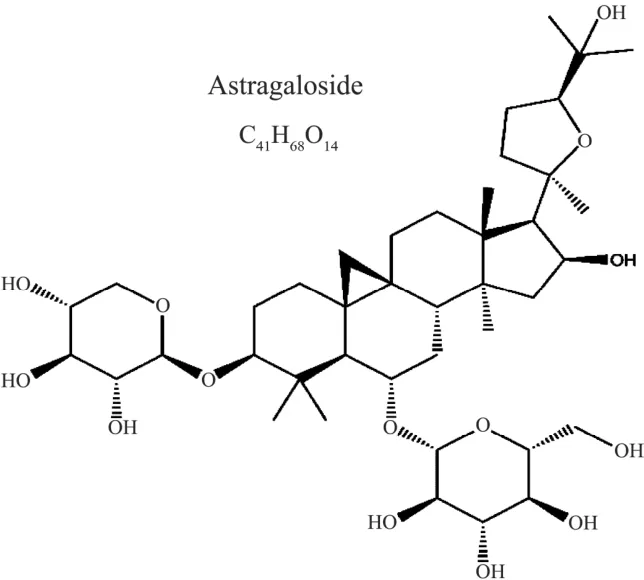
图1 黄芪甲苷的结构式Fig.1 Structure of astragaloside IV
1.2 实验动物与模型建立
雄性昆明小鼠50只,体重20.00±2.00 g,实验前适应性饲养3~5 d,自由取食饮水。将小鼠随机分为5组,每组10只。模型构建参考本实验之前的实验方法[15],具体如表1所示。

表1 糖尿病小鼠模型构建方法Table 1 Construction method of diabetic mouse model
空白组每天给予普通饲料,同时,腹腔注射0.9%的生理盐水。除空白组以外,模型组和保护组给予高脂高糖饲料喂养,同时,给予腹腔注射1.00 mg/kg氯化镉,构建糖尿病小鼠模型。每周检测小鼠空腹血糖变化。处理8周后,当模型组和保护组小鼠血糖≥11.10 mmol/L时,认为模型构建成功。
实验用的高脂高糖饲料所用的配方为:普通饲料粉末40.00%~50.00%、脂肪(熟猪油)20.00%~25.00%、食用白砂糖20.00%、鸡蛋8.00%~12.00%、食用盐<5.00%。
模型构建成功后,保护组胃饲不同剂量的黄芪甲苷,分别为低剂量组:20.00 mg/kg,中剂量组40.00 mg/kg,高剂量组60.00 mg/kg每日上午给药1次,模型组和空白组均灌胃0.9%的生理盐水,连续处理4周。
整个饲养过程中保持温度、光照、湿度等环境条件平行,每日供应饮食、饮水总量一致,末次处理前,禁食12 h,断颈处死,取新鲜胰脏组织,生理盐水冲洗干净后,于-80 ℃冷冻保存,用于检测镉致糖尿病小鼠胰脏组织的指标变化。
1.3 氧化损伤指标测定
胰腺组织加入适量冷裂解液研磨匀浆,制备成10%的组织匀浆,3000 r/min低温离心10 min后取上清液,蛋白测定采用考马斯亮蓝法、丙二醛(MDA)含量用硫代巴比妥酸法[6]测定、组织中的酶抗氧化剂活性SOD用联苯三酚自氧化法[12]测定、用DTNB(5,5’-二硫代双,2-硝基苯甲酸)法[14]测定还原型谷胱甘肽(GSH)的生成量。
1.4 胰脏超微结构观察
胰脏组织用戊二醇预固定后,用1%的锇酸进行后固定,常规乙醇和丙酮梯度脱水,环氧树脂618浸透、包埋、聚合,半薄切片(厚度1 μm)定位,超薄切片(厚度50~70 nm),醋酸铀和枸橼酸铅电子染色,Hitachi7500型透射电子显微镜观察拍照。
1.5 统计学处理
数据分析用SPSS 10.0统计软件,实验数据以x±s表示。计量资料组间比较采用单因素方差分析。统计学上p<0.05认为差异有统计学意义。
2 结果与讨论
2.1 2型糖尿病(T2DM)小鼠模型的确认
根据课题组之前的方法构建糖尿病小鼠模型,如表2所示,镉联合高脂高糖处理8周,除空白组以外,其他四组的血糖均大于11.10 mmol/L,表明糖尿病小鼠模型构建成功;给予黄芪甲苷4周处理后,结果表明不同剂量黄芪甲苷处理能够显著的降低小鼠血糖值(p<0.05,p<0.01),表明黄芪甲苷对糖尿病小鼠具有一定的保护作用。谢春英[16]研究了黄芪甲苷对高血糖小鼠的降血糖作用,结果显示黄芪甲苷具有降血糖作用,这与本实验结果一致。
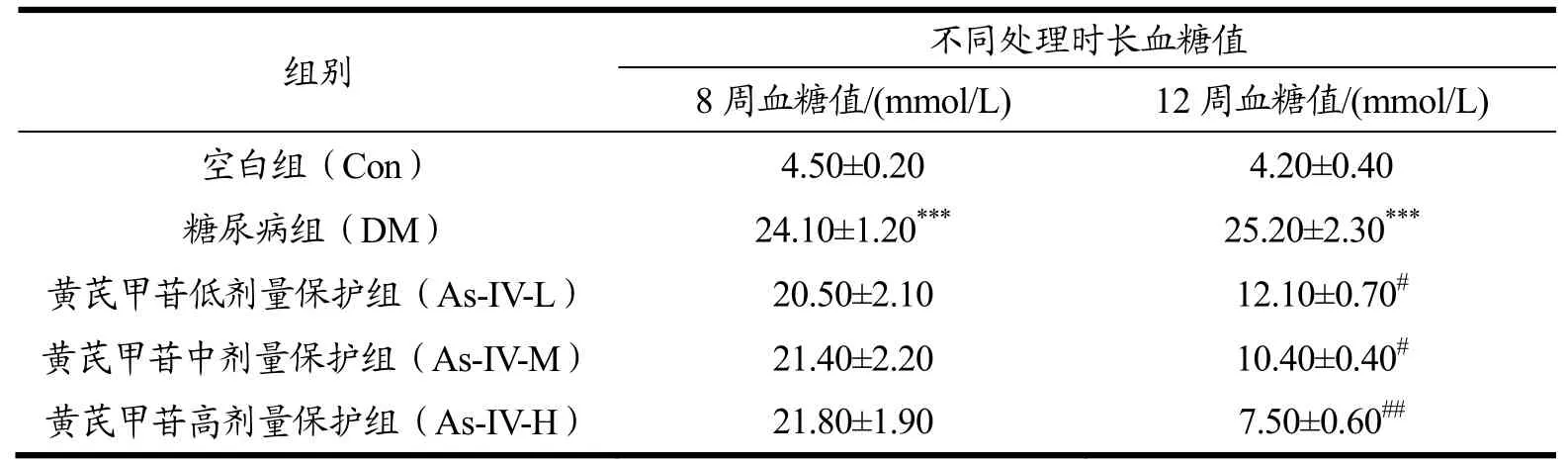
表2 不同处理时长不同组别血糖值Table 2 Blood glucose levels for different treatment periods
2.2 黄芪甲苷对糖尿病小鼠胰脏氧化指标的影响
MDA是ROS生成脂质过氧化的终末产物,可加速生物膜损伤,其含量能间接反映膜系统受损程度和细胞受自由基攻击的程度,被认为是评估氧化应激的良好标记物[17]。如图2所示,空白组MDA的含量为0.50 mmol/L protein,糖尿病小鼠MDA含量为空白组MDA含量的1.90倍,显著高于空白组MDA的含量(p<0.01)。相比于糖尿病小鼠组,黄芪甲苷低剂量保护组、中剂量保护组、高剂量保护组MDA含量分别为糖尿病小鼠组MDA含量的82.10%(p<0.05),68.40%(p<0.01)、58.90%(p<0.01),呈剂量依赖型趋势。镉虽然不是氧化还原金属元素,但是大量文献报道镉能够加剧体内的氧化应激状态,本研究结果表明,镉诱导的糖尿病小鼠胰脏的脂质过氧化反应增强,MDA含量增多,导致细胞代谢紊乱,最终引起胰脏功能失调。摄入黄芪甲苷能够减轻小鼠胰脏的脂质过氧化程度,减少MDA的含量,保护胰脏免受自由基的损伤。李竹青[18]研究了黄芪甲苷对糖尿病大鼠早期肾脏损伤的保护作用,结果显示不同剂量黄芪甲苷保护组MDA含量均显著降低。说明了黄芪甲苷可以降低MDA的含量,缓解氧化损伤,从而起到保护作用。
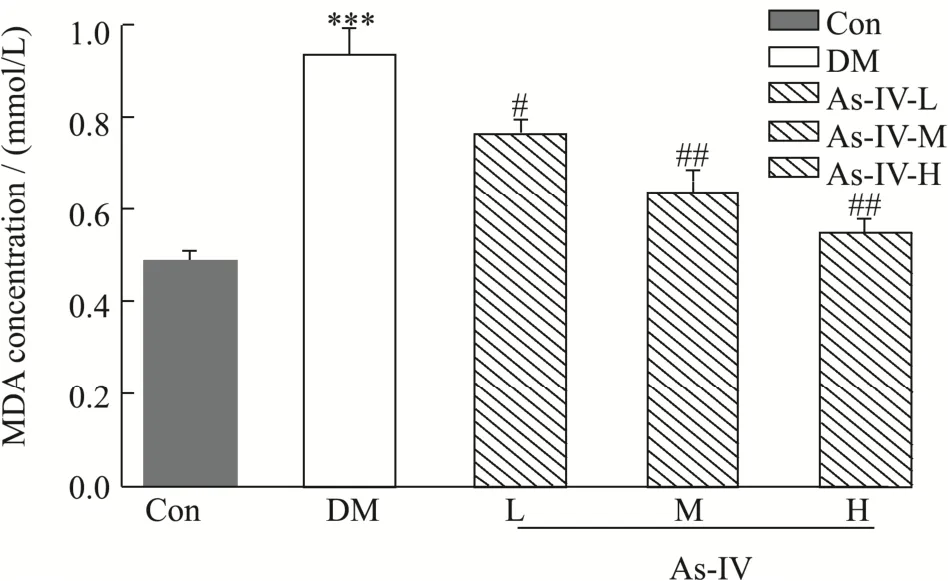
图2 黄芪甲苷对糖尿病小鼠MDA水平的影响Fig.2 Effects of astragaloside IV on MDA levels in diabetic mice
如图3所示,空白组的SOD含量为1.12 U/mg protein,糖尿病小鼠组SOD含量仅为空白组的48.10%,显著低于空白组(p<0.01)。与糖尿病组相比,黄芪甲苷保护组中SOD活性大大提升,其中,中剂量保护组、高剂量保护组SOD活性分别达到了糖尿病组的1.52倍(p<0.05)、1.72倍(p<0.01)。体内SOD的活性对于维持机体氧化-还原的动态平衡至关重要,SOD活力的下降会导致脂质过氧化反应的增强,结果表明,镉诱导的糖尿病小鼠模型中,小鼠胰脏SOD活性下降,自由基过度产生,脂质过氧化反应增强,从而损伤了胰脏,黄芪甲苷的保护,能够缓解机体SOD水平的下降,提高胰脏的抗氧化能力,减少胰脏的损伤。韩冬等[19]研究黄芪甲苷对实验性糖尿病大鼠肝脏组织的保护作用,发现中、高剂量黄芪保护组SOD活性均高于模型组。提示黄芪甲苷对实验性糖尿病大鼠具有保护作用,其作用机制可能与其能有效改善肝脏组织抗氧化酶活性、降低氧化应激损伤有关,与我们的研究结果一致,说明黄芪甲苷能够缓解机体SOD水平的下降,提高机体抗氧化能力,缓解机体损伤。
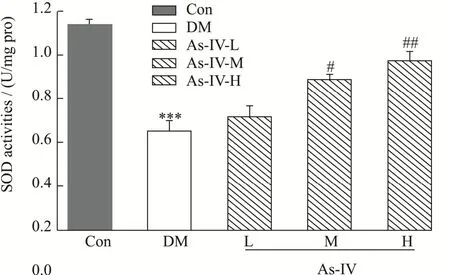
图3 黄芪甲苷对糖尿病小鼠SOD水平的影响Fig.3 Effects of astragaloside IV on SOD levels in diabetic mice
如图4所示,糖尿病小鼠GSH含量低于空白组(p<0.05),仅为空白组的44.40%,黄芪甲苷保护组GSH的含量明显高于糖尿病小鼠,呈剂量依赖趋势,高剂量保护组的效果最明显,为糖尿病小鼠组的2.00倍(p<0.01)。实验表明,镉在小鼠胰脏中聚集,导致大量自由基的产生,抑制了机体的抗氧化水平,导致氧化应激损伤,GSH的含量作为衡量细胞氧化还原状态的一个重要指标,可以通过直接供H+拮抗氧自由基毒性,清除体内的氧自由基,减少胰脏的氧化损伤[20]。
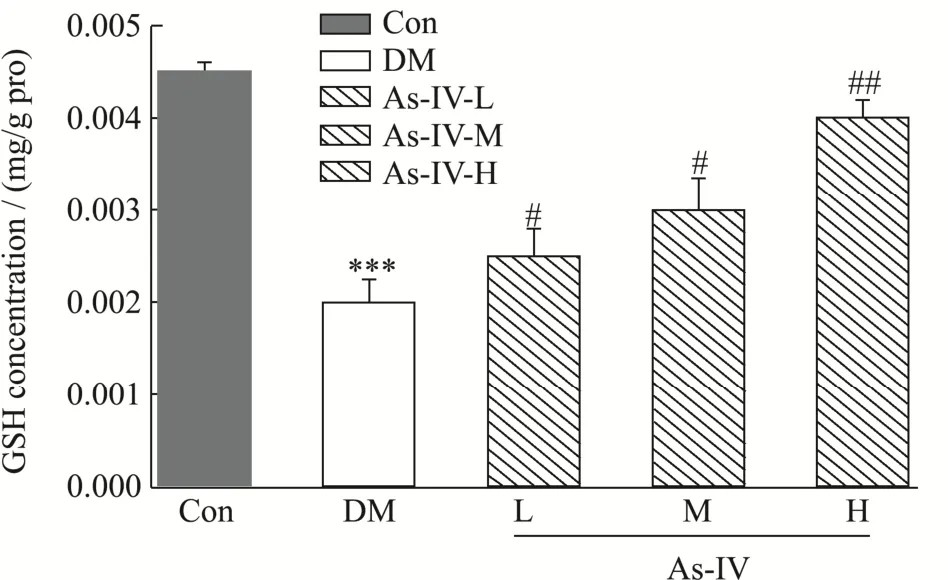
图4 黄芪甲苷对糖尿病小鼠GSH水平的影响Fig.4 Effects of AstragalosideIV on GSH levels in diabetic mice
在机体正常的代谢过程中,氧化还原处于动态平衡。镉暴露联合高脂高糖处理诱导小鼠糖尿病发生,加剧了其氧化应激反应,产生大量氧氮自由基,攻击脂质、蛋白质和DNA等大分子,产生MDA等脂质过氧化物、蛋白质羰基化产物(PCO)等,破坏细胞膜系统,损伤胰脏的抗氧化系统,破坏其正常的生理功能。SOD和GSH能够清除自由基,减少对胰脏的损伤。黄芪甲苷是一种羊毛酯醇形的四环三萜皂苷,是黄芪药材的主要有效成分之一。Cao等[21]报道黄芪甲苷可通过内源性抗氧化剂清除活性氧。黄芪甲苷处理可降低MDA含量,提高谷胱甘肽过氧化物酶和SOD水平。Lv等[22]报道黄芪甲苷可以降低2型糖尿病小鼠肝脏中的糖原磷酸酶和葡萄糖-6-磷酸酶水平,降低血糖和甘油三酯水平,改善胰岛素抵抗。因此,黄芪甲苷通过清除自由基,减少自由基对胰脏的损伤,同时通过改善胰岛素抵抗,维持胰岛素与胰高血糖素分泌的平衡,提高胰岛素的分泌质量,防止因血糖水平不稳定而导致机体代谢紊乱,胰脏受到损伤而进入恶性循环。
2.3 黄芪甲苷对糖尿病小鼠胰脏超微结构的影响
如图5所示,与空白组比,糖尿病小鼠组胰岛细胞中的分泌颗粒体密度显著减少、线粒体体密度也相应减少,胞核及核内染色质几乎完全溶解消失。与糖尿病小鼠组相比,黄芪甲苷组能够显著对抗镉联合高脂高糖所致胰岛细胞的损害,分泌颗粒体密度、线粒体体密度明显增高,表明镉联合高脂高糖对小鼠胰脏亚细胞结构造成了损伤,而黄芪甲苷的作用能够在一定程度上缓解这种变化。黄芪甲苷可显著提高实验性糖尿病模型大鼠胰岛素分泌水平、ISI,降低HOMA-IR,提示黄芪甲苷对实验性糖尿病大鼠胰腺组织具有保护作用。肖徐阳[23]研究了黄芪甲苷对糖尿病小鼠肝脏、胰脏组织不同程度损伤的缓解作用,结果显示,黄芪甲苷保护组小鼠肝脏、胰脏组织损伤均得到不同程度的缓解,说明黄芪甲苷能够显著改善糖尿病小鼠损伤。
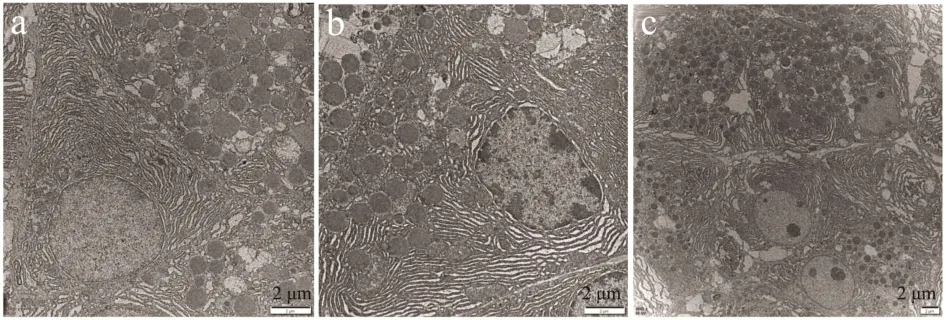
图5 黄芪甲苷对糖尿病小鼠胰脏保护作用研究Fig.5 Protective effect of astragaloside IV on pancreas of diabetic mice
3 结论
本研究实验结果证实,糖尿病的发病机制与氧化应激有着密切的联系,黄芪甲苷可能是通过清除过量产生的自由基,减少氧化应激对胰脏的损伤,从而起到一定的保护作用。但糖尿病的作用机制非常复杂,有待进一步研究。
