金黄色葡萄球菌SSL7蛋白对补体系统的作用分析
2021-11-04邓亦宁张云科王朋朋田欣睿焦晓宇吴文学
邓亦宁 张云科 王朋朋 田欣睿 焦晓宇 吴文学
(中国农业大学 动物医学院,北京 100193)
在我国奶牛养殖业中,葡萄球菌性乳房炎是威胁奶牛健康的重要原因,研究表明,临床型奶牛乳房炎中金黄色葡萄球菌(Staphylococcusaureus)的分离率高达10.2%[1]。王英杰等[2]调查表明,S.aureus感染北京地区奶牛导致的乳房炎发病率高达71.1%,其中37.8%呈隐性感染。S.aureus表达多种毒力因子,包括肠毒素、中毒休克综合征毒素-1(Toxic shock syndrome toxin-1, TSST-1)、超抗原蛋白(Superantigen protein)和超抗原样蛋白(Staphylococcal superantigen-like proteins, SSLs)等。SSLs与超抗原蛋白具有高度同源性,其基本保留了超抗原蛋白的结构特征,但在功能上却存在极大差异。Fitzgerald等[3]对8株S.aureus基因组SSLs家族的26个等位基因进行鉴定,发现共有11个独特的SSL基因驻留在SaPIn2的19 kb区域内,SSL基因按照它们沿基因组出现的顺序命名。Benson等[4]在血液培养物和喉咽拭子中随机收集并分离了40株S.aureus,其全部被检出了SSL基因,表明在SSLs在细菌中无冗余作用。已有多项研究确定部分SSLs的生物学特性,其功能多与免疫逃避相关。SSL3与Toll样受体2(Toll-like receptor, TLR2)结合,通过病原体相关分子抑制TLR2的活化[5];SSL8可以结合胞外基质蛋白粘合素C,抑制其与细胞外纤维蛋白原结合蛋白(Extracellular fibrinogen binding protein, EfB)的相互作用,减弱角质细胞的运动能力[6];SSL5和SSL11结合表达在白细胞表面的PSGL-1(P selection glyooprotein ligand),抑制中性粒细胞外渗[7]。
SSL7能特异性结合IgA,是SSLs家族中首个被证实的葡萄球菌免疫球蛋白结合蛋白,具有鲜明的超抗原样特性[8]。SSL7基因位于基因岛α(Genetic island-α, GIα)上,蛋白结构预测与SSL5相似。SSL7的二维氨基酸序列与TSST-1最为匹配[9],TSST-1呈茎环结构(Stem-loop structure),其被抗原呈递细胞(Antigen presenting cell, APC)识别后形成MHC Ⅱ-TSST-1复合物,诱发机体产生过敏毒素,导致休克与多器官衰竭[10]。过敏毒素是具有炎症介质作用的活性片段,包括补体活化过程中产生的C3a、C4a和C5a,其中 C5a 的作用最强,C3a 次之,C4a在人体中尚未发现的明确作用[11-12]。Motamedifa等[9]与Koch等[13]发现,注射眼镜蛇蛇毒耗尽补体的小鼠更容易受到严重的葡萄球菌感染,说明补体系统可有效抑制S.aureus的定殖。而S.aureus通过进化出多种免疫逃逸机制,抑制机体补体系统的激活[14]。SSL7结合IgA的方式与金黄色葡萄球菌A蛋白 (Staphylococcal protein A,SPA)结合IgG相似,SPA的C端结合域X与细菌的细胞壁结合,N端结合域D、E、A、B结合在免疫球蛋白IgG上,不仅能阻断Fc受体介导的吞噬作用,还能有效干预C1q的识别与结合,抑制补体的活化,提示SSL7蛋白也可能与补体系统特异性反应,阻断补体级联反应[15-16]。
为探究SSL7在S.aureus感染过程中的作用,本研究通过大肠杆菌表达系统表达了重组蛋白SSL7,随后利用补体杀伤试验、Western Blot和pull-down试验证明重组蛋白SSL7可以通过与C5特异性结合从而抑制补体系统的激活,延长细菌在血液中的存活时间。
1 材料与试剂
1.1 菌株及载体
S.aureusNCTC 8325株,购于中国医学细菌菌种保藏管理中心。大肠杆菌感受态细胞BL21(DE3)、DH5α,表达载体pET-28a(+)购自北京全式金生物技术有限公司。
1.2 主要试剂
异丙基-β-D硫代半乳糖苷 (IPTG)、盐酸胍购自北京索莱宝科技有限公司;BeyoGoldTMHis-tag Purification Resin (耐还原螯合型)试剂盒购自北京艾德莱生物科技有限公司。鼠抗His-tag mAb、山羊抗人C5 mAb、鼠抗兔C9 mAb、HRP标记山羊抗鼠IgG、HRP标记的兔抗山羊IgG购自武汉爱博泰克生物科技有限公司。
2 试验方法
2.1 重组质粒的构建
2.1.1提取S.aureus全基因组DNA
取1 mLS.aureusNCTC 8325培养液,收集菌体沉淀后提取S.aureus全基因组DNA,用100 μL的ddH2O回收全基因组DNA,经琼脂糖凝胶电泳检测完整性后保存于-20 ℃冰箱备用。
2.1.2SSL7基因扩增
根据GenBank上公布的S.aureusNCTC 8325的SSL7蛋白的基因序列(Gene ID: CP000253.1),利用软件Primer Premier 5.0设计PCR引物SSL7-F/SSL7-R,如表1,引物由生工生物工程(北京)股份有限公司合成。
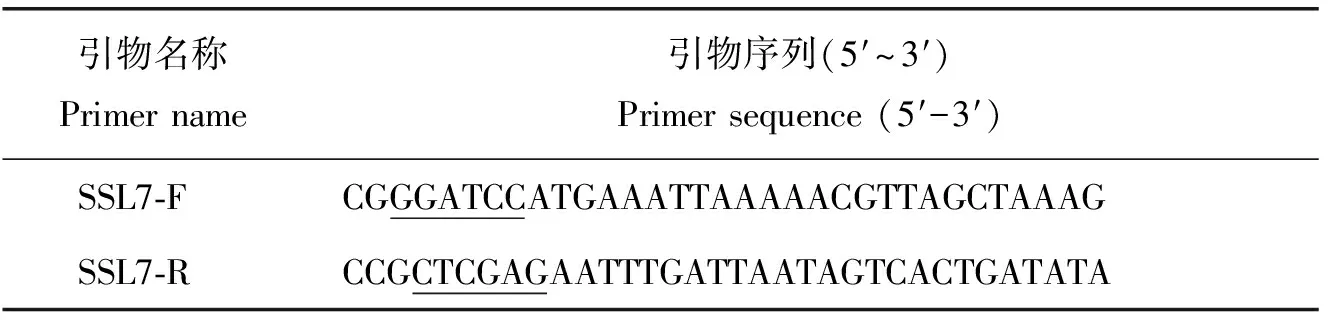
表1 本研究中的引物序列信息Table 1 Information of primer sequence in the study
反应体系:2×FastPfu高保真DNA聚合酶25 μL,上下游引物SSL7-F/SSL7-R各1 μL,DNA模板4 μL,ddH2O补至50 μL。反应结束后,通过凝胶电泳以及Nano Drop 2000微量分光光度计验证PCR产物的大小和纯度。回收扩增的DNA片段。
2.1.3重组表达载体pET-28a(+)-SSL7的构建
用限制性内切酶EcoR Ⅰ和Xho Ⅰ对回收的DNA片段及大肠杆菌表达载体pET-28(a)+进行双酶切,设计20 μL连接体系:目的基因4 μL,表达载体pET-28(a)+ 10 μL,T4DNA 连接酶1 μL,10×T4DNA连接酶Buffer 2 μL,ddH2O 3 μL。体系置室温连接2 h。测序正确的阳性菌落用质粒提取试剂盒抽提质粒,命名为pET-28a(+)-SSL7。
2.2 诱导表达重组蛋白SSL7
将重组质粒pET-28a(+)-SSL7转入感受态细胞E.coliBL21(DE3)中,挑取单菌落,接种于Amp+LB液体培养基中,37 ℃ 200 r/min恒温摇床培养,待菌体密度至OD600值为0.4~0.6时,加入IPTG至其终浓度为1 mmol/L,调整恒温摇床参数为25 ℃,继续培养6 h。
2.3 鉴定纯化重组蛋白SSL7
收集诱导表达的菌沉,超声破碎,收集菌沉和上清各10 μL进行SDS-PAGE电泳,通过Western Blot鉴定重组蛋白SSL7。用Ni-NTA亲和层析柱纯化SSL7重组蛋白,通过盐酸胍梯度透析法复性后用Millipore超滤管(NMWL为10 ku) 透析浓缩收集液,BCA蛋白定量试剂盒测定蛋白浓度,同时进行SDS-PAGE检测纯化效果。
2.4 补体杀伤试验
将E.coliDH5α菌液培养至对数生长期,收集沉淀,洗涤后重悬。进行5次10×倍比递减稀释,调整浓度至10-5。取新鲜兔血清(Rabbit serum, RS),稀释至10-4,部分56 ℃加热30 min使补体去活化。如表2标记和加样,37 ℃恒温孵育1 h后涂布于Amp+ LB固体培养基上,37 ℃倒置过夜培养。记录平板上菌落个数,根据公式计算每mL原始样品中所含有的细菌总数。进行3组重复。

表2 补体杀伤试验体系各成分列表Table 2 Complement killing text system μL
2.5 Western Blot检测补体沉积
将S.aureusNCTC 8325株培养至平台期后收集菌沉,PBS洗涤重悬,等分为4组:加1 mL无菌PBS;加入1 mL含10%兔血清的反应缓冲液;加1 mL 56 ℃加热30 min的灭活兔血清缓冲液;加10 μL 重组蛋白SSL7和990 μL 10%兔血清的反应缓冲液。37 ℃恒温孵育1.5 h后通过Western Blot检测补体沉积。
2.6 Pull-down检测重组蛋白SSL7与补体C5结合
取3 mL BeyoGoldTMHis-tag Purification Resin装柱,平衡3次。分别取20 μL的重组蛋白SSL7和20 μL的PBS与健康人血清混合,使Ni-NTA充分结合带有His标签的SSL7蛋白。尽可能洗去非特异结合的蛋白。加入100 μL含1×Loading Buffer的PBS,沸水煮10 min,进行SDS-PAGE 电泳。通过Western Blot检测补体C5是否被SSL7捕获。
2.7 数据分析
利用GroophPad Prism 8.0.2进行多重比较和方差分析(ANOVA),并作显著性分析。P<0.05表示存在差异显著,P<0.01表示存在极显著性差异。
3 结果与分析
3.1 构建重组表达质粒pET-28a(+)-SSL7
以S.aureus全基因组为模板,PCR扩增SSL7基因,扩增产物经1.2%琼脂糖凝胶电泳检测,与预期DNA的大小一致,没有非特异性扩增产物。用限制性核酸内切酶Xho Ⅰ和BamH Ⅰ 双酶切PCR产物和pET-28a(+)表达载体,电泳鉴定酶切产物,与预期相符,未出现其他非特异性酶切位点。将连接好的重组表达质粒转化到感受态细胞E.coliDH5α,挑取菌落进行鉴定和测序,如图1,目的片段大小为696 bp,序列和连接方向均正确,命名为pET-28a(+)-SSL7。
3.2 重组蛋白SSL7的表达与纯化
3.2.1重组蛋白SSL7的表达
经IPTG诱导表达,超声裂解后,分别取未诱导全菌蛋白、诱导全菌蛋白、超裂后上清液及沉淀进行SDS-PAGE电泳,如图2(a),重组蛋白SSL7能够在BL21(DE3)中正常表达,且在上清液中大量可溶性表达,大小约为25 ku,与预测值一致。
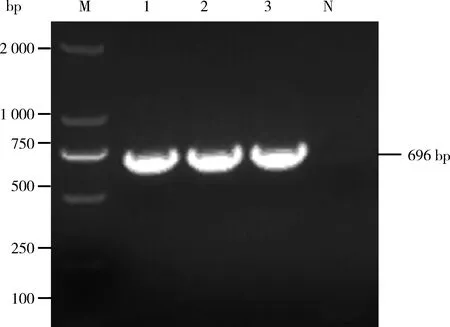
M:DNA分子质量标准;1~3:待检重组表达质粒;N.阴性对照M: DNA molecular quality standards; 1-3: Recombinant expression plasmid to be detected; N: Negative control图1 重组表达质粒pET-28a(+)-SSL7的构建Fig.1 Construction of recombinant expression plasmid pET-28a(+)-SSL7
3.2.2重组蛋白SSL7的鉴定与纯化
SDS-PAGE电泳后的诱导后表达E.coliBL21(DE3)和上清液转印到PVDF膜上,选用未诱导的大肠杆菌全菌蛋白为阴性对照,以鼠抗His-tag mAb为一抗,Western Blot检测结果如图2(b),抗His-tag抗体能识别重组蛋白,SSL7表达正确,可进一步大量表达和纯化。收集Ni-NTA亲和层析柱纯化的蛋白样品,PBS缓冲液透析和超滤管浓缩后,利用SDS-PAGE电泳测定纯化后蛋白的浓度。如图2(c),纯化后的重组蛋白SSL7条带单一,纯度较高,特异性较好。
3.3 补体杀伤试验
取出孵育好的细菌,结合显微镜记录各培养皿上的有效菌,计算后结果如图3。
计算比较可得,PBS阴性对照组,加入热灭活兔血清的HI组和加入SSL7的实验组中,大肠杆菌均能存活,而加入新鲜兔血清的RS组,由于血清中存在补体成分,引发级联反应,大肠杆菌被全部杀死,无法检出。表明SSL7能抑制宿主的补体杀伤,保障细菌存活。
3.4 Western Blot检测补体沉积
将培育至对数生长期的S.aureus分组,加入相应试剂,混均后37 ℃反应1.5 h,Western Blot检测结果如图4,与加入PBS相比,加入10%兔阴性血清后S.aureus激活了血清中的补体成分,使之产生MAC沉积在菌体表面上。加热灭活兔血清后,血清中的补体成分失活,无法产生MAC沉积。加入重组蛋白SSL7的菌体表面也没有形成MAC沉积,可见SSL7阻断了补体系统的激活,抑制了MAC的形成。
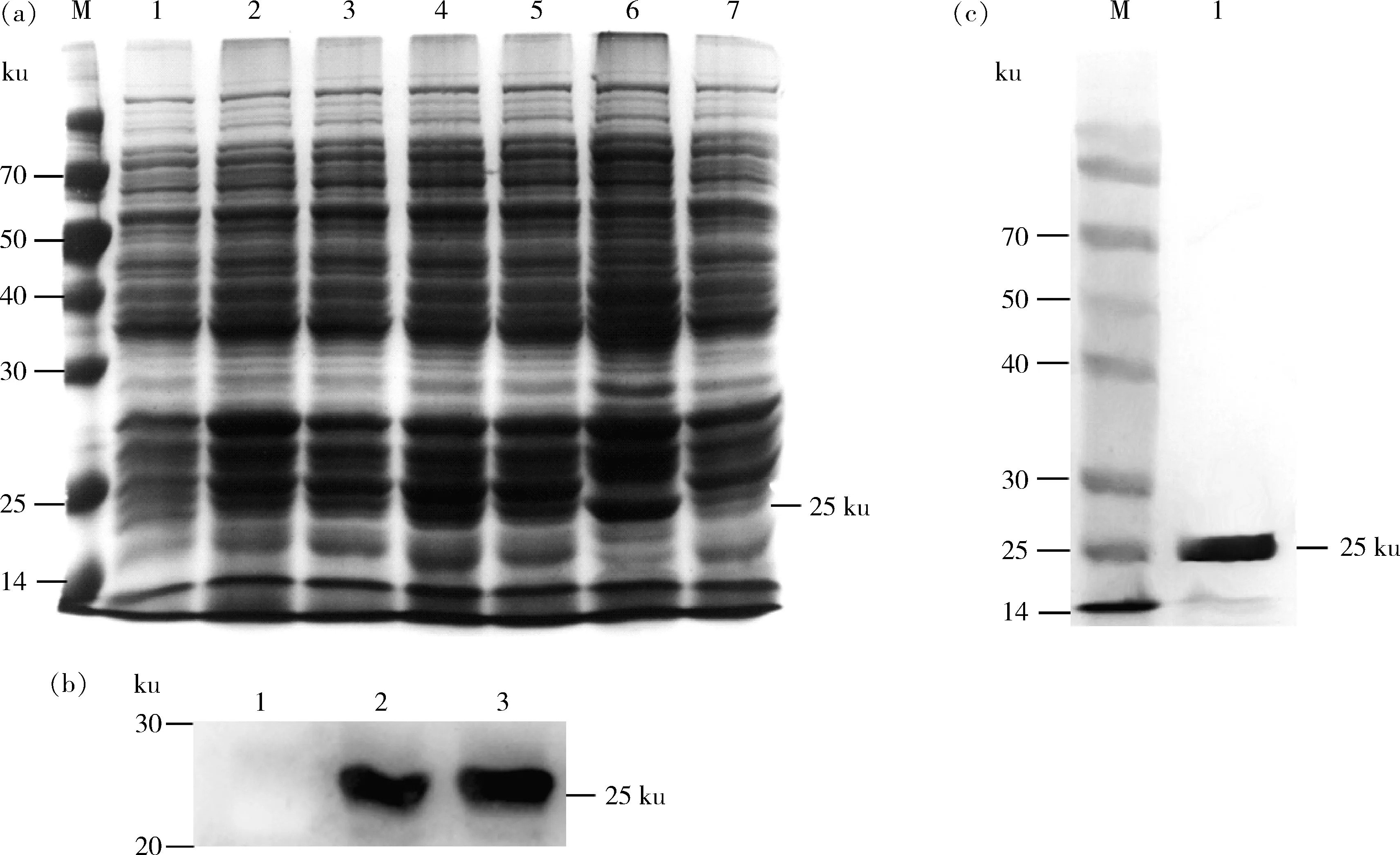
(a)SDS-PAGE检测SSL7蛋白的表达.M.蛋白质分子质量标准;1.未经诱导的表达菌;2~5.经IPTG 诱导的表达菌;6:表达后超裂的上清液;7:表达后超裂的沉淀.(b)Western Blot鉴定重组蛋白SSL7: 1.未诱导的大肠杆菌全菌蛋白;2.诱导后的大肠杆菌全菌蛋;3.诱导表达后超裂获得的上清液.(c)纯化重组蛋白SSL7的SDS-PAGE鉴定:M.蛋白质分子质量标准;1.超滤浓缩液(a) SDS-PAGE detection of SSL7 protein expression. M.protein maker; 1.Uninduced expression bacteria; 2-5.Expression bacteria induced by IPTG; 6.Supernatant after hyper crack; 7.Precipitation after hyper crack. (b)Western Blot identification of the recombinant protein SSL7. 1.Uninduced E. coli whole bacteria protein; 2.Induced E. coli whole bacteria protein; 3.Supernatant obtained by hyper cleavage. (c)SDS-PAGE of purified recombinant protein SSL7. M.Protein maker; 1.Ultrafiltration concentrate图2 重组蛋白SSL7的表达、鉴定与纯化Fig.2 Expression, identification and purification of recombinant protein SSL7
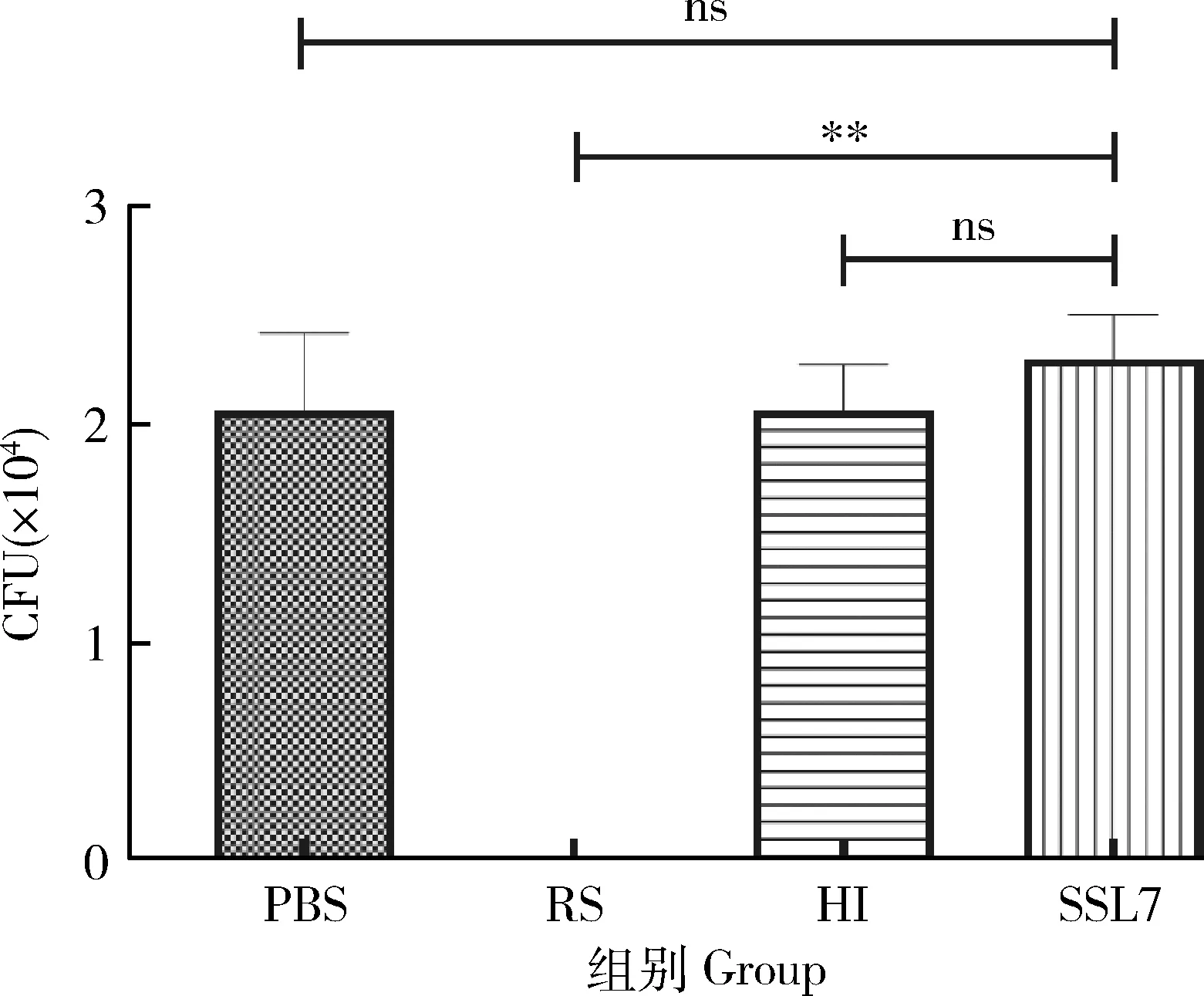
ns表示无显著性差异;**表示极显著差异。ns represent no significant difference; ** represents extremely significant difference.图3 SSL7阻断鼠血清对E.coli DH5α 补体杀伤的效果比较Fig.3 Effect comparison of SSL7 blocking complement killing of E.coli DH5α by mouse serum
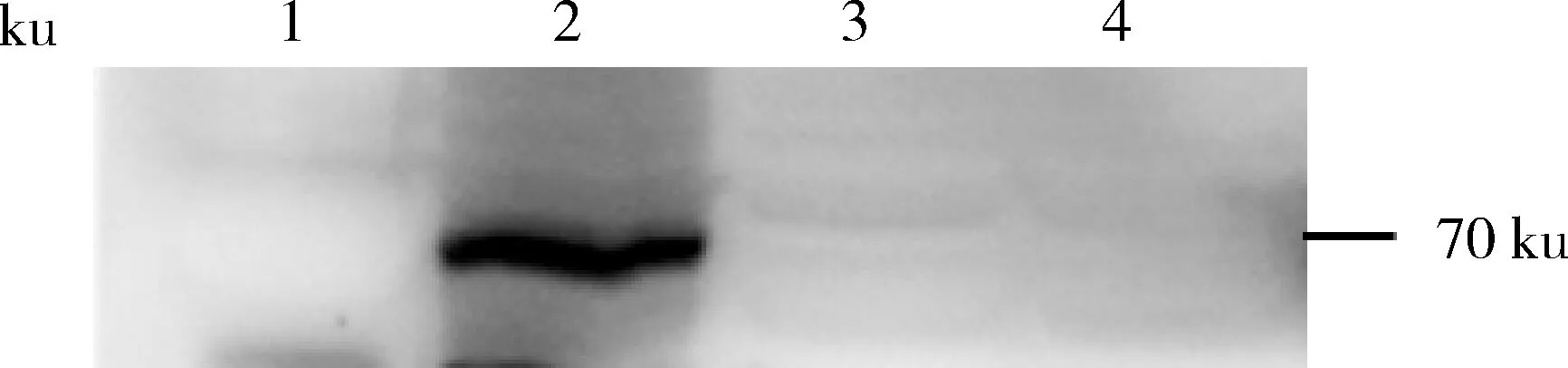
1.PBS孵育的S.aureus;2.兔阴性血清孵育的S.aureus;3.兔阴性血清和重组蛋白孵育的S.aureus;4.兔热灭活血清孵育的S.aureus1.S.aureus incubated with PBS; 2.S.aureus incubated with rabbit negative serum; 3.S.aureus incubated with rabbit negative serum and recombinant protein; 4.S.aureus incubated with rabbit heat-inactivated serum图4 Western Blot 检测沉积于菌体表面的C9分子Fig.4 Detection of C9 molecules deposited on bacteria surface by Western Blot
3.5 Pull-down方法检测重组蛋白SSL7与补体C5的结合
以纯化后的带有His-tag的SSL7作为诱饵,与健康人血清共孵育,以等体积的PBS作为阴性对照,利用Ni-NTA捕获抗原-抗体复合物,通过Western Blot检测补体C5。如图5,共获得了2条特异性蛋白条带,其大小分别是115和75 ku,分别与C3裂解产物C5a和C5b对应,表明重组蛋白SSL7与补体C5特异性结合。
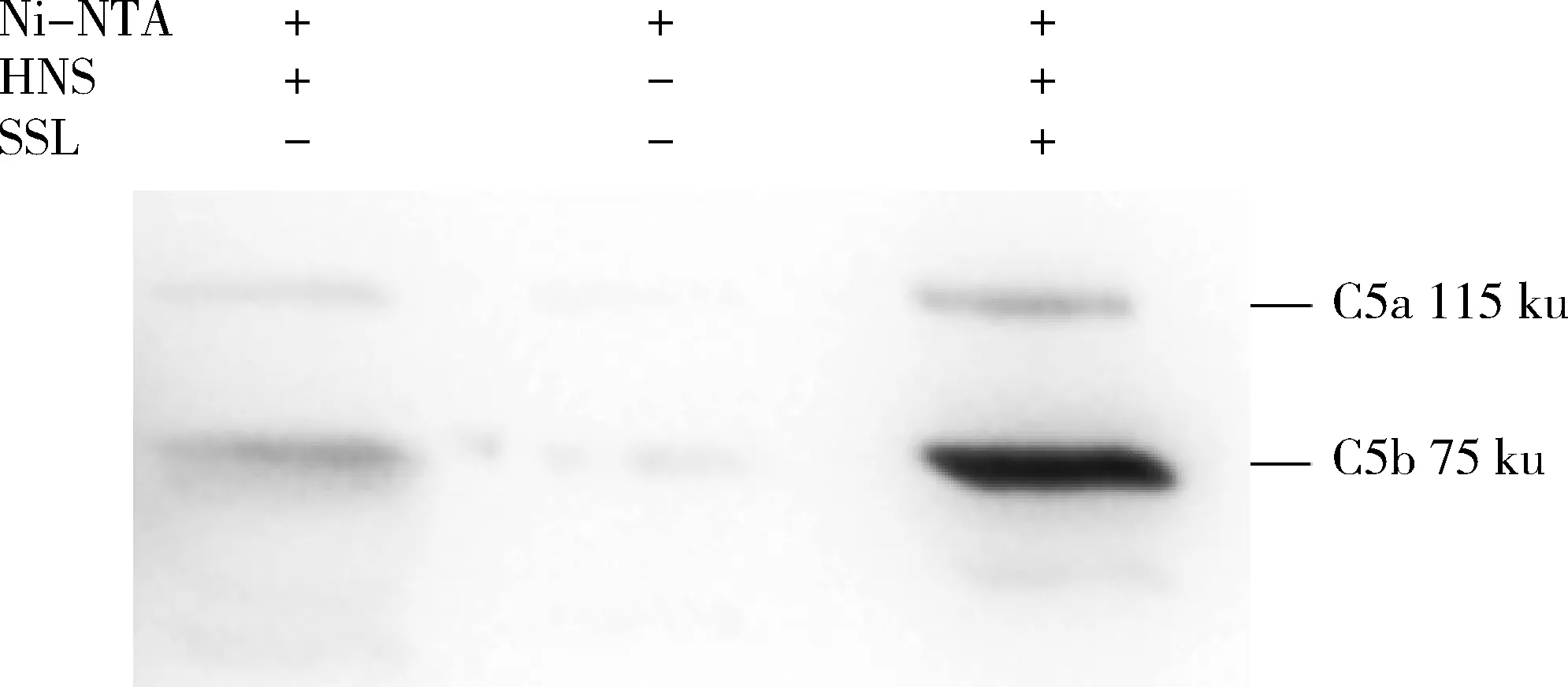
图5 Pull-down 检测SSL7与补体C5的结合Fig.5 Pull-down detection of the binding of SSL7 to complement C5
4 讨 论
超抗原样蛋白虽然与葡萄球菌TSST-1和肠毒素具有结构相似性,却没有以极低浓度即可引发较强免疫应答的超抗原特点,其作用机理及介导的免疫逃逸机制一直是近年来的研究热点。Armstrong等[17]发现S.aureusNTCT8325菌株和S.aureusMu50菌株分别有14种和12种SSLs,表明不同的S.aureus菌株编码SSLs的种类与数量不完全相同,各SSLs的结构和功能亦尚不完全明确。SSL7是一种具有标识性的SSLs,大多数有关SSL7蛋白的研究集中于对其结构的探索,Laursen等[18]通过单晶X线衍射测定了S.aureus12598株与S.aureus4227株SSL7复合物的结构,发现其C端β-grasp 结构域出现变异。Bakshi等[19]对照SSL7的结合位点,改造VHH-IgA*融合蛋白,使IgA能被SSL7成功纯化。SSL7的结构与SSL5十分相似,其三维结构虽然具有超抗原分子的所有主要特征,在功能上也可与白细胞结合,却没有检测到超抗原活性[20]。功能上,Langley等[21]利用临床分离得到的两株金黄色葡萄球菌,借助标准外周血淋巴细胞增殖试验发现SSL7与人血清中多肽结合。Wines等[22]发现SSL7尽管与单核细胞弱结合,但其结合物在葡聚糖的存在下可被树突状细胞(Dendritic cells, DCs)吞噬,目前尚未明确DCs的摄取机制,重组蛋白SSL7的表达与纯化为今后的机制研究奠定了基础。不仅如此,Wines等[23]还通过分别表达人、大鼠和小鼠的IgA-Fc证实IgA CH2/CH3位点的糖基化可以抑制SSL7与IgA的相互作用,为仅使用兔血清进行功能性探索的本研究提供了新思路。
过敏毒素C5a是补体系统活化产物,是炎症反应的重要介质和趋化因子[24]。近年来,寻找鉴定新型C5a抑制剂具有重要的临床应用价值,金黄色葡萄球菌菌趋化抑制蛋白(Chemotaxis inhibitory ofS.aureus, CHIPS)可与C5a受体特异性结合,抑制C5a的趋化作用[25]。Dutta等[26]报道了SSLs能与细胞内丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)家族蛋白ERK2结合,调控细胞转录,在炎症和增殖中起重要作用。C5在补体级联反应中可被C5转化酶(C4b2a2b或C3bBb3b)裂解形成大量C5a,SSL7与C5特异性结合,可能可以作为新型补体抑制剂,治疗C5a介导的炎症反应及自身免疫疾病。
免疫逃逸对病原菌定殖至关重要,天然免疫应答能抵御大部分金黄色葡萄球菌的感染,其高度依赖补体级联反应和中性粒细胞介导的杀伤作用。迄今为止,许多SSLs被预测出具有补体抑制活性,本研究通过Western Blot以及Pull-down试验证实SSL7能特异性结合C5,表明其是良好的补体激活阻断物,对结合产物的进一步探索可能可以揭示SSLs在免疫调节过程中涉及到的互补或协同功能。
5 结 论
本研究制备的重组蛋白SSL7能通过特异性结合补体C5来阻断补体级联反应,具有抑制宿主先天免疫反应的生物学特征,为进一步研究SSL7的蛋白结构、作用机制,探索金黄色葡萄球菌免疫逃逸机理、寻找补体新型抑制剂奠定基础。
