长角血蜱磷酸丙糖异构酶的真核表达及免疫保护力分析
2021-11-02吴品兴董红猛肖舒文胡永红河北师范大学生命科学学院河北石家庄050024
吴品兴,梁 娜,董红猛,肖舒文,胡永红 (河北师范大学 生命科学学院,河北 石家庄 050024)
长角血蜱(Haemaphysalislongicornis)隶属于节肢动物门(Arthropoda)、蛛形纲(Arachnida)、蜱螨亚纲(Acari)、寄螨总目(Parasitiformes)、蜱目(Ixodida)、硬蜱科(Ixodidae)[1],在全世界呈广泛性分布[2-4]。长角血蜱作为重要的病原体载体,可引起立克次体病[5]、人单核细胞埃立克体病[6]、犬焦虫症[7]、泰勒虫病[8]及发热伴血小板减少综合征[9]等,对人类健康和畜牧业发展带来极大危害。目前,化学防治仍然是控制蜱类的重要方式[10],但长期使用会导致环境污染和蜱抗药性的产生[11],因此,疫苗接种已成为有效的蜱类防治策略之一。
磷酸丙糖异构酶(triosephosphate isomerase,TIM)是一种催化磷酸二羟丙酮(DHAP)和甘油醛-3-磷酸(GAP)互逆转化的酶,在糖酵解过程中有重要的地位[12]。已有研究证实,刚地弓形虫(Toxoplasmagondii)[13]、日本血吸虫(Schistosomajaponicum)[14]、微小扇头蜱(Rhipicephalusmicroplus)[15]中TIM对宿主具有免疫保护力,而蜱中相关研究报道甚少。毕赤酵母(Pichiapastoris)是一种工业化的甲基营养型酵母,具有易操作,稳定表达,高密度发酵及翻译后修饰(例如糖基化,多肽折叠和甲基化)的优点[16],并且在毕赤酵母中表达的重组蛋白不会遇到内毒素污染[17]。因此,本研究采用毕赤酵母表达系统对长角血蜱TIM进行表达和纯化,通过蜱叮咬试验分析免疫保护力,为进一步筛选抗蜱疫苗提供理论依据。
1 材料与方法
1.1 实验动物新西兰大白兔(约2 kg)购自河北医科大学实验动物中心。所有动物试验方案经河北师范大学动物伦理委员会批准 (2020LLSC05)。
长角血蜱采集于中国小五台山国家自然保护区。非寄生期蜱放置于恒温培养箱培养(湿度为75%,温度为(25±1)℃)。
1.2 主要试剂Pme I(Thermo)、质粒提取试剂盒(Axygen)、琼脂糖凝胶回收试剂盒(Axygen)、Zeocin(上海生工)、大肠杆菌DH5α感受态(北京全式金)、酵母提取物(Oxid)、蛋白胨(Oxid)、胰蛋白胨(Oxid)、葡萄糖(国药)、山梨醇(Amresco)、弗氏佐剂(Sigma)。
1.3 基因合成按照毕赤酵母密码子偏好性优化TIM基因,经北京华大基因合成,连入真核质粒pPICZaA,获得真核重组质粒pPICZaA-TIM。
1.4 质粒提取与线性化取1 μL pPICZaA-TIM转入大肠杆菌DH5a感受态,取100 μL涂含25 mg/L Zeocin的LB平板。37℃培养箱过夜培养。挑单菌落加入含25 mg/L Zeocin的LB中37℃,180 r/min过夜培养,按照axygen质粒提取试剂盒说明书提取质粒,将质粒线性化(Pme I酶,37℃水浴,酶切3 h)。按照Axygen琼脂糖凝胶回收试剂盒说明书回收线性化质粒,用无水乙醇沉淀,加入无菌水重悬。
1.5 毕赤酵母X33感受态的制备和转化将毕赤酵母X33在YPD固体平板划线培养,挑单菌落于YPD液体培养基中培养,在进行大量培养,离心收集菌体,用预冷的无菌水重悬洗涤,离心,再用预冷的1 mol/L山梨醇重悬洗涤、离心,菌体用1 mol/L山梨醇重悬待用。
将线性化质粒与X33感受态混合,冰浴5 min,转入预先冰浴的电击杯中,按照电击仪的预设程序电击(2 mm电击杯,电击条件:2 000 V、25 uF、200 Ω;电击时间5.1 ms),电击后立即加入1 mL 预冷的1 mol/L山梨醇,然后转移到1.5 mL离心管中,30℃复苏2~3 h,涂Zeocin质量浓度为0.1 g/L的YPDS平板,30℃培养3~5 d。
1.6 表达检测将单菌落接种到BMGY培养基中,30℃、220 r/min培养2 d后,离心,菌体用BMMY培养基重悬并开始诱导TIM表达,之后每24 h补加终浓度为1%的甲醇,取诱导3 d的样品SDS-PAGE检测。
将小量表达量较高的菌种接入BMGY中培养2 d,按1%接种到500 mL BMGY中培养2 d,离心菌体用500 mL BMMY重悬并诱导培养,每24 h 补加终浓度1%的甲醇,诱导3 d,离心收集上清。
1.7 纯化蛋白将诱导上清分别用0.80,0.45,0.22 μm 滤膜过滤,上镍柱纯化,利用不同浓度咪唑(25,50,100,150,250 mmol/L)进行梯度洗脱,SDS-PAGE检测纯化情况。
1.8 重组蛋白rTIM的免疫原性分析将纯化的rTIM样品进行SDS-PAGE电泳,之后按照海绵滤纸、凝胶、PVDF膜、海绵滤纸顺序放入半干转膜仪,22 v,转膜30 min。PVDF膜用TPBS清洗3次,封闭液常温封闭2 h后,一抗(1∶2 000)常温孵育30 min,4℃静置过夜,第2天进行常温孵育1 h。再用TPBS清洗3次,用含辣根过氧化物酶的羊抗兔二抗(1∶2 000)孵育2 h,用TPBS清洗3次,置于化学发光成像仪中进行成像。同时,用新西兰大白兔阴性血清孵育作对照。
1.9 免疫动物将新西兰大白兔随机分为2组(对照组和试验组),每组3只新西兰大白兔。试验组中,将0.5 mL rTIM (0.1 g/L)与等体积弗氏完全佐剂混合,注射新西兰大白兔;2周后将0.5 mL rTIM (0.1 g/L)与等体积弗氏不完全佐剂混合,注射新西兰大白兔;2周后进行第3次免疫,方法同上。同时,0.5 mL PBS与佐剂混合免疫新西兰大白兔做对照。
1.10 血清的ELISA检测一免前及一免疫后每隔7 d,自新西兰大白兔耳缘静脉采血,4℃静置离心取血清。使用纯化rTIM进行96孔板包被,4℃过夜;经洗液清洗3次,加入封闭液封闭1 h;用洗液清洗3次,加入待测血清孵育45 min,洗液清洗3次,加入用含辣根过氧化物酶的羊抗兔二抗(1∶2 000)孵育30 min,洗液清洗3次,加入显色液显色再加终止液终止反应,置于酶标仪中读取D450 nm值,并在1∶25 600的血清稀释倍数下作图。
1.11 蜱叮咬试验第3次免疫后10 d进行蜱叮咬试验。将饥饿期长角血蜱成蜱32头/兔(雌、雄比1∶1)喂养于新西兰大白兔耳上。每天对蜱进行观察,并记录相关数据。结果使用SPSS软件进行统计学分析。将试验组与对照组雌蜱的叮咬数量、产卵量以及卵的孵化率相比,计算其免疫保护率(Eff%)=100(1-(NET×EWPF×H))[18],其中NET代表蜱数量的降低比,EWPF代表产卵量的降低比,H代表卵的孵化率降低比。
2 结果
2.1 TIM序列优化在前期克隆长角血蜱TIM基因747 bp(GenBank登录号:MK599255)基础上,根据毕赤酵母密码子偏好性优化TIM基因,序列见图1。

阴影部分为插入pPICZaA位点;下划线为起始密码子;斜体为His标签;波浪线为终止密码图1 TIM进行优化后的序列和翻译的氨基酸序列
2.2 质粒扩增对转入DH5α的pPICZaA-TIM进行菌液PCR,1%琼脂糖凝胶电泳结果显示,TIM目的基因大小处有1条明亮条带,序列测序结果与TIM优化序列完全一致(图2)。
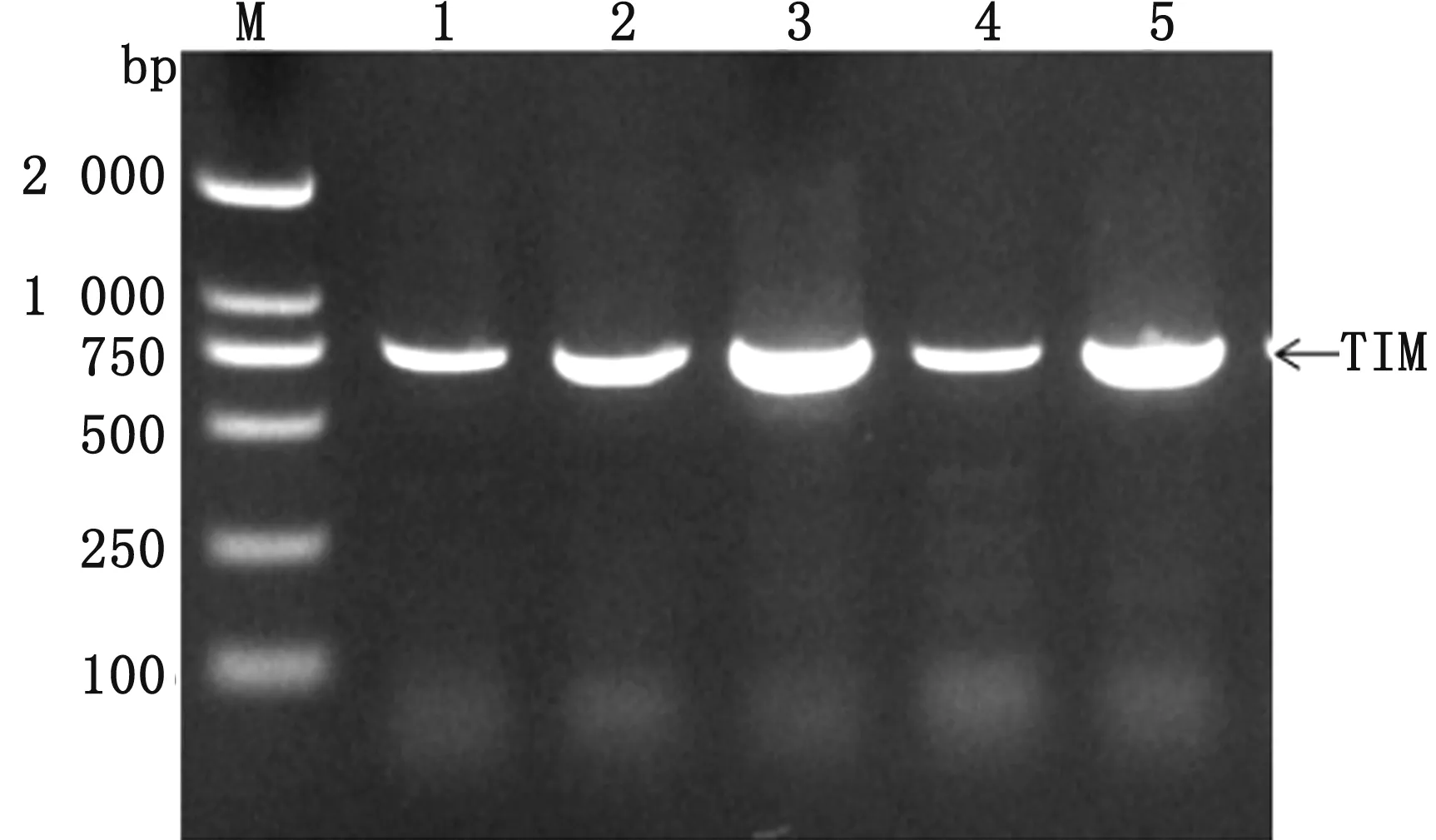
M.DL2000 DNA Marker;1~5.重组质粒在DH5α中的扩增产物图2 重组质粒转入DH5α中的菌液PCR扩增结果
2.3 重组蛋白初步表达将YPDS平板上长出的单菌落接种到BMGY培养基中培养,离心后再转入BMMY培养基中,重悬和开始诱导TIM表达。取诱导3 d的样品进行SDS-PAGE检测,结果显示,第8泳道菌株表达的目的蛋白最多,其相对分子质量大小与预测一致,约为28 kDa(图3)。

1~9.代表不同的单菌落;M.蛋白Marker图3 小量表达筛选检测
2.4 重组蛋白纯化将表达量较高的8号菌种大量表达,并进行蛋白纯化,使用不同浓度的洗脱缓冲液进行洗脱,SDS-PAGE检测。在50,100 mmol/L咪唑洗脱缓冲液下得到明显的条带,其蛋白相对分子质量大小与预测一致,约为28 kDa(图4)。

1~5.250,150,100,50,25 mmol/L咪唑洗脱缓冲液收集的重组蛋白rTIM;M.蛋白Marker图4 不同浓度的咪唑溶液洗脱重组蛋白rTIM
2.5 重组蛋白rTIM的Western blot分析将纯化的rTIM蛋白与兔抗长角血蜱血清进行Western blot检测(图5)。兔抗长角血蜱血清与rTIM反应,而重组蛋白rTIM与阴性血清不反应,表明rTIM蛋白具有免疫原性。

M.蛋白 Marker;1.阴性血清孵育纯化的rTIM;2.兔抗长角血蜱血清孵育纯化的rTIM图5 rTIM的免疫印迹分析
2.6 ELISA检测将纯化的rTIM蛋白与佐剂混合免疫注射新西兰大白兔,一免后每隔7 d取血。ELISA检测结果显示,一免后14 d,与对照组相比,试验组新西兰大白兔抗体水平显著升高(P<0.05),并随着免疫次数持续增高,三免后趋于平稳(图6)。
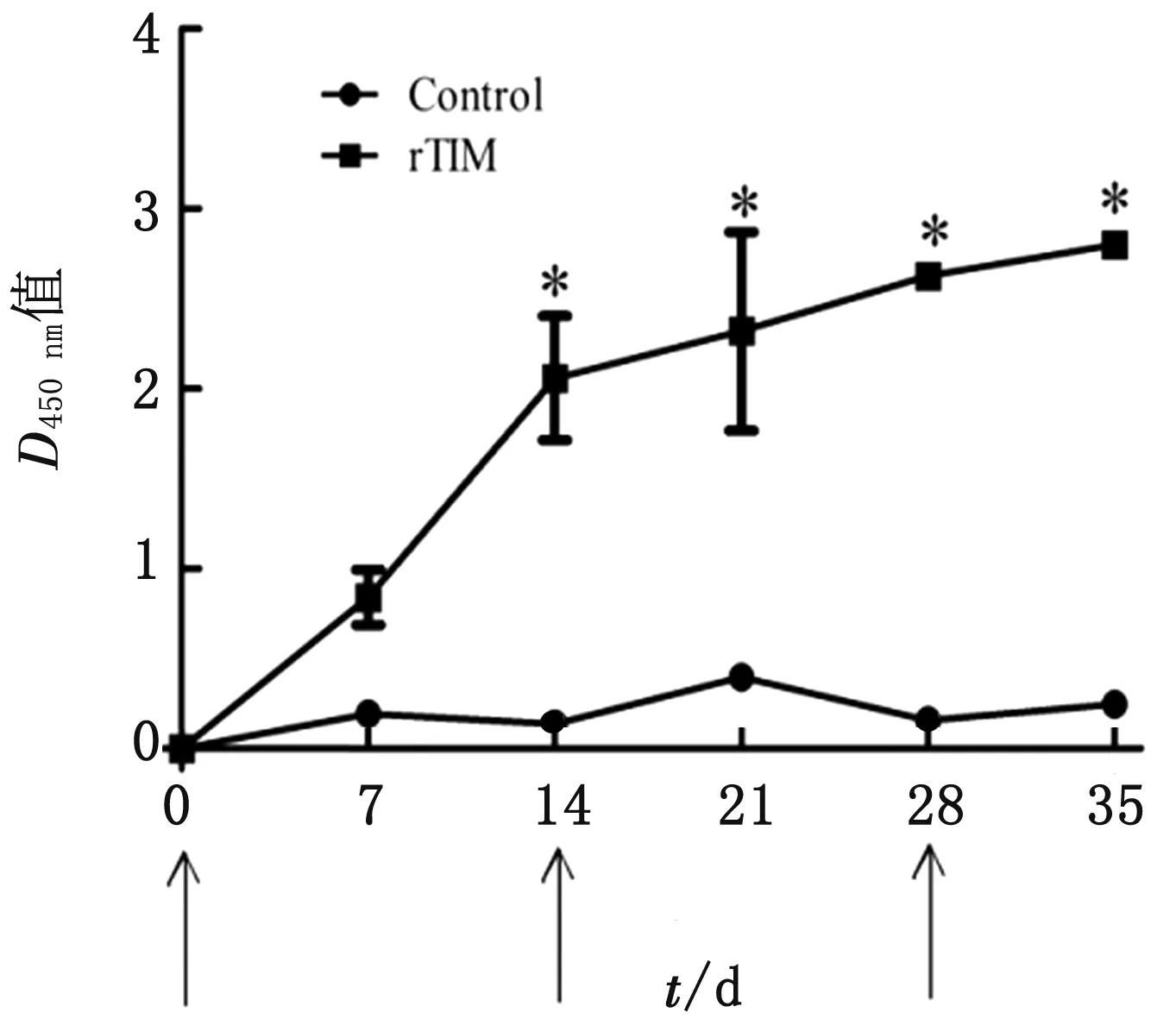
rTIM.试验组血清;Control.对照组血清;箭头表示免疫注射时间图6 免疫rTIM的新西兰大白兔血清ELISA检测结果
2.7 免疫rTIM疫苗的新西兰大白兔对长角血蜱雌蜱的影响rTIM雌蜱叮咬数据分析如表1所示。在吸血时间上,rTIM试验组(8.0±0.23) d与对照组(7.21±0.25) d相比无显著性差异。试验组雌蜱饱血体质量、产卵量和卵孵化率分别为(163.30±1.40) mg,(52.23±1.41) mg,(29.26±2.43)%,与对照组相比差异显著(P<0.05),分别减少11.02%,16.00%和44.69%。根据免疫效率计算公式,得到rTIM试验组的免疫效率为58.40%。
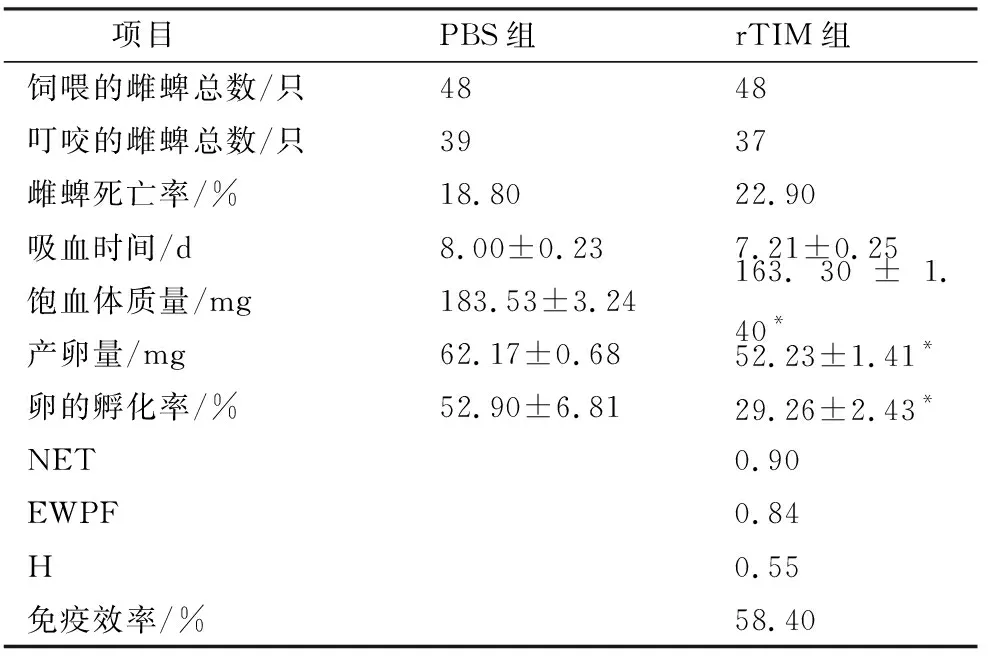
表1 免疫rTIM疫苗的新西兰大白兔对长角血蜱雌蜱的影响
3 讨论
长角血蜱能够携带和传播多种病原体,对人类健康以及畜牧业的发展造成了严重的危害[19-21],因此针对长角血蜱的防治刻不容缓。TIM是一种重要的糖酵解途径酶,在糖酵解过程中起着至关重要的作用[22],对于能量的生成十分重要[23]。因此,根据TIM特性开展寄生虫防治的研究已在多个物种报道。
赵正虎等[24]利用刚地弓形虫TIM进行原核表达和免疫原性试验,发现TIM可引起宿主产生强烈的免疫应答。ZINSSER等[25]对曼氏血吸虫(Schistosomamansoni)TIM进行生物分析,发现其是研制曼氏血吸虫疫苗的潜在靶标。与原核表达相比较,真核表达具有一定的优势,特别是对目的蛋白修饰上。毕赤酵母具有真核翻译后修饰如糖基化、二硫键形成及蛋白水解加工的能力[26]。本研究对TIM进行表达纯化,发现纯化蛋白的主带上有1条小带,可能是毕赤酵母对目标蛋白修饰引起的。Western blot结果说明rTIM具有免疫原性。ELISA检测结果表明,重组蛋白rTIM能有效引起宿主产生体液免疫。蜱叮咬试验结果显示,与对照组相比,rTIM可显著抑制雌蜱的饱血体质量、产卵量和卵孵化率,且分别减少11.02%,16.00%和44.69%。TIM是糖酵解关键酶,推测其诱导宿主产生的TIM抗体及免疫细胞[27]在蜱吸血过程中进入蜱体内,影响了长角血蜱对宿主血液的利用,抑制了相应的糖代谢过程,无法将其转化为自身的营养物质,从而影响了雌蜱饱血体质量、产卵量及卵的孵化。特别是试验组中卵孵化率与对照组相比减少44.69,%,推测TIM主要影响了长角血蜱胚胎发育过程。这与SARAMAGO等[28]的研究相似,微小扇头蜱TIM单克隆抗体可抑制胚胎蜱细胞系 (BME26)的细胞增殖,这可能是因为胚胎发育过程需要糖代谢产生ATP供能,而TIM功能损伤影响了能量产生[29]。本试验首次利用毕赤酵母对长角血蜱TIM进行真核表达,结果表明, TIM可部分保护宿主免受蜱侵害,可作为抗蜱疫苗的候选蛋白。
