猪圆环病毒2型Cap蛋白、猪肺炎支原体和副猪嗜血杆菌三联灭活疫苗的制备及安全性和有效性评价
2021-11-02吕茂杰王显兵车艳杰鲍恩东吉林大学动物医学学院吉林长春13006天津瑞普生物技术股份有限公司生物制品研究院天津300308南京农业大学动物医学院江苏南京10095
吕茂杰,王显兵,孙 晨,3,张 英,车艳杰*,丁 壮,鲍恩东,3* (1.吉林大学 动物医学学院,吉林 长春 13006;.天津瑞普生物技术股份有限公司 生物制品研究院,天津 300308;3.南京农业大学 动物医学院,江苏 南京 10095)
猪圆环病毒2型(porcine circovirus 2,PCV2)是引起断奶仔猪多系统衰竭综合征(postweaning multisystemic wasting syndrome,PMWS)[1]的主要病原,该病主要表现为体质量下降、呼吸困难、黄疸以及间质性肺炎、淋巴结肿大、肝炎和肾炎等症状[2]。PCV2主要感染断奶仔猪和育肥猪,自1991年在加拿大发生后,迅速蔓延到各养猪国家,成为目前危害世界养猪业的重要疫病之一[3]。猪肺炎支原体(Mycoplasmahyopneumoniae,Mhp)是猪支原体肺炎(Mycoplasmalpneumoniaof swine,MPS)(又称猪气喘病,也称地方性肺炎)的主要病原。该病的主要特点为传染性高、发病率高和死亡率低,主要表现为发热、咳嗽、呼吸困难等症状,造成食欲减退、生长阻滞、饲料转化率降低及上市时间延迟[4-5]。副猪嗜血杆菌病是由副猪嗜血杆菌(Haemophilusparasuis,HPS)引起的猪多发性浆膜炎和关节炎,主要临床症状为发热、咳嗽、呼吸困难、消瘦、跛行、共济失调和被毛粗乱等;剖检病理变化表现为胸膜炎、肺炎、心包炎、腹膜炎、关节炎和脑膜炎等[6-9]。此外,HPS还可引起败血症,并且可留下后遗症,即母猪流产、公猪慢性跛行。HPS的血清型复杂多样,按琼脂扩散血清分型方法,至少可分为15种血清型,另有20%以上的分离株不可定型,目前我国以4,5型最为流行,其次为12,13,14型,而其他血清型均较少[10-11]。
PCV2感染猪后破坏其免疫系统,产生免疫抑制,增加了猪对多种病原体的易感性,易与猪繁殖与呼吸综合征病毒(PRRSV)、伪狂犬病病毒(PRV)、猪瘟病毒(CSFV)和HPS、猪链球菌等混合感染,引发难以控制的严重疾病[12-17]。Mhp很容易引起猪群继发感染其他疾病,常与猪流感病毒(SIV)、PRRSV、PRV和PCV2等病毒性疾病和巴氏杆菌病、胸膜肺炎、链球菌病和副猪嗜血杆菌病等细菌性疾病混合感染,形成猪呼吸系统疾病综合征(porcine respiration disease complex,PRDC)[18]。HPS已成为我国各猪场保育仔猪死亡的一个主要原因,一些免疫抑制性的病毒,如PRRSV、PCV等经常与该菌混合感染[19],疫苗接种己成为预防和控制该病的主要措施[20-21]。
鉴于3种病原混合感染的普遍性,目前在临床实际生产中使用的疫苗多为单价疫苗或二联苗,对于3种抗原的三联疫苗的使用尚未见报道。本研究通过将PCV2杆状病毒载体表达的Cap蛋白抗原、Mhp抗原和HPS 4,5型抗原按照一定比例混合,加入适宜佐剂制备PCV2、Mhp、HPS三联灭活疫苗,通过对免疫仔猪的安全性、抗体水平和攻毒保护效果的评价,表明该三联疫苗的安全性和有效性良好,为实现“一针三防”奠定基础。
1 材料与方法
1.1 抗原PCV2 Cap蛋白,由PCV2 RPVS0301株ORF2基因经密码子优化的重组杆状病毒RP-1株接种Sf9细胞制得,经浓缩纯化后质量浓度为200 mg/L,批号P1901;Mhp灭活抗原,质量浓度为3 g/L,批号M1901;HPS 4型RPBS0904-11株灭活抗原(含灭活前活菌数≥1.0×1010CFU/mL)和HPS 5型RPBS0905-3株灭活抗原(含灭活前活菌数≥1.0×1010CFU/mL),批号为H41901和H51901,均由天津瑞普生物技术股份有限公司生物制品研究院制备和提供。
1.2 主要试剂Montanide IMS 1313 VG NST,批号:171115017195,购自法国SEPPIC公司;硫柳汞钠购自国药集团化学试剂有限公司;PCV2 Cap蛋白单克隆抗体购自浙江大垚生物科技有限公司;Mhp兔源阳性血清,琼扩效价≥1∶16,由天津瑞普生物技术股份有限公司制备;HPS 4,5型兔源阳性血清,抗体效价≥1∶128;SDS-PAGE试剂购自北京索莱宝科技有限公司;辣根过氧化物酶(HRP)标记山羊抗鼠IgG,HRP标记山羊抗兔IgG,HRP标记山羊抗猪IgG购自KPL公司;DAB显色液购自天根生化公司;PCV-2抗体检测试剂盒购自北京金诺百泰生物技术有限公司;Mhp抗体检测试剂盒购自IDEXX公司;HPS血清微量平板凝集试验(MAT)抗体检测方法,由本实验室自建。
1.3 检验用菌毒种PCV2 RPVS0301株,F11代,病毒含量106.50TCID50/mL,仔猪的攻毒途径和剂量为肌注4.0 mL和滴鼻4.0 mL;Mhp JX株,F8代冻干组织毒,最小发病剂量(MID)为0.005 g,攻毒剂量为100 MID;HPS 4型RPBS0904-11株,F5代,仔猪发病剂量为3.28×109~4.33×109CFU;HPS 5型RPBS0905-3株,F5代,仔猪发病剂量为1.68×109~2.21×109CFU;菌毒种均由天津瑞普生物技术股份有限公司制备、鉴定、保存和供应。
1.4 实验动物3~4周龄健康易感猪(包括三元仔猪和长大二元仔猪),PCV2 抗原抗体、Mhp抗原抗体、HPS血清抗体及鼻拭子HPS抗原检测阴性,PRRSV、PRV、SIV血清PCR检测抗原均为阴性,购自天津周边散养户。
1.5 制苗用抗原的检验取PCV2 Cap蛋白,Mhp灭活菌体抗原,HPS 4,5型抗原经超声处理后,进行SDS-PAGE分析及Western blot鉴定。在15 V 30 min条件下,转至硝酸纤维膜(NC)上,4℃、5%脱脂乳封闭过夜,分别用PCV2 Cap蛋白单克隆抗体、Mhp阳性血清、HPS 4,5型阳性血清在37℃作用1 h,PBS洗膜3次,再用1∶5 000倍稀释的HRP标记的羊抗鼠(或羊抗猪或羊抗兔)IgG 37℃作用1 h,PBS洗膜3次后,进行DAB显色分析反应活性。
1.6 疫苗制备将水相与佐剂按70∶30的体积比混合,500~800 r/min搅拌20~30 min。在终止搅拌前加入1%硫柳汞溶液,使其终浓度为0.005%,充分混匀。最终使每头份疫苗中含灭活的PCV2 Cap蛋白应不低于50 μg,Mhp菌体蛋白应不低于100 μg,HPS 4型RPBS0904-11株至少为4.0×109CFU,HPS 5型RPBS0905-3株至少为2.0×109CFU。
1.7 疫苗安全性评价用3~4周龄三元仔猪10头,其中5头猪于颈部肌肉注射疫苗4.0 mL/头(2头份),5头作为空白对照,连续观察14 d。接种后观察以下指标:连续测温7 d;接种疫苗前后体质量变化;接种疫苗后局部和全身不良反应情况观察;接种疫苗后14 d,剖检所有实验猪,观察疫苗接种部位疫苗吸收、肉芽肿情况,并取接种部位组织进行HE染色和分析。
1.8 疫苗有效性评价
1.8.1疫苗免疫 将该三联灭活疫苗颈部肌肉注射3~4周龄健康易感猪20头,2.0 mL/头,间隔2周采用相同的剂量和途径进行二免。同时设攻毒对照猪20头,空白对照猪5头。各组猪同条件下隔离饲养。
1.8.2抗体监测 采集免疫前、首免后14 d、二免后7 d、二免后14 d血清,检测PCV2 Cap ELISA抗体效价、Mhp ELISA抗体效价和HPS 4,5型MAT抗体效价。其中,PCV2血清ELISA抗体和Mhp血清ELISA抗体按照试剂盒说明书进行判定;HPS 4,5型MAT抗体检测中,效价≤1∶4,判为阴性,效价>1∶4判为阳性。
1.8.3PCV2攻毒保护试验 二免后14 d,从免疫组和攻毒对照组猪中各随机选取5头测体质量,分别用PCV2 RPVS0301株病毒液攻毒,8.0 mL/头,同时设5头空白对照。攻毒后连续观察28 d,于28 d 测体质量,采血分离血清,按PCV2 PCR方法检测血清中PCV2病毒核酸;扑杀所有实验猪,取腹股沟淋巴结,按免疫组化检测(IHC)方法检测PCV2抗原。根据相对日增重、血清中PCV2病毒核酸和IHC结果进行判定。a.病毒核酸检测:攻毒后28 d,采血分离血清,用PCR方法检测血清中PCV2病毒核酸,出现特异性条带,判为PCV2病毒核酸检测阳性,否则,判为阴性。b.淋巴结IHC:攻毒后28 d,扑杀所有猪,取腹股沟淋巴结,按照IHC方法进行检测,仔猪腹股沟淋巴结滤泡内可见棕黄色着染,判为PCV2阳性,否则,判为阴性。c.相对日增重:攻毒前与攻毒后28 d,将免疫组、攻毒对照组(不免疫)和空白对照组(不免疫、不攻毒)猪逐头测体质量,用SPSS软件进行组间平均相对日增重比较,当平均相对日增重与空白对照组比较有显著性差异时(P<0.05),判为该组仔猪生长发育不良,有PCV2引起的临床症状。计算公式为:相对日增重=(攻毒后28 d体质量-攻毒当日体质量)÷(攻毒当日体质量×28)。符合上述判定标准中的任意两项时,即可判为发病或保护。
1.8.4Mhp攻毒保护试验 二免后14 d,从免疫组和攻毒对照组猪中各随机选取5头,于气管注射100 MID的Mhp强毒JX株,观察28 d,扑杀全部实验猪。按28评分法对各实验猪的肺炎病变进行评分,计算肺炎病变减少率,按下述标准判定。(1)MPS病变评分标准:通过肺小叶(左尖叶、左心叶、左膈叶、右尖叶、右心叶、右膈叶和副叶)特异性病变面积占各肺小叶总面积的百分比进行量化评定。每个肺小叶未见肺炎病变为0分;病变面积占肺小叶面积的1%~25%为1分;病变面积占肺小叶面积的26%~50%为2分;病变面积占肺小叶面积的51%~75%为3分;病变面积占肺小叶面积的75%以上为4分。每个肺小叶最高病变评分为4分,7个肺叶病变评分最大为28分。如肺叶正反面均有病变,以病变面积大的一面进行计分。(2)按照以下公式计算各组免疫猪的肺炎病变减少率:肺炎病变减少率=[(对照猪肺炎病变几何平均分-免疫猪肺炎病变几何平均分)/对照猪肺炎病变几何平均分]×100%。
1.8.5HPS 4,5型攻毒保护试验 二免后14 d,从免疫组和攻毒对照组猪中各随机选取10头,其中5头分别腹腔注射4型RPBS0904-11株菌液3.0 mL(4.1×109CFU),另5头分别腹腔注射5型RPBS0905-3株菌液3.0 mL(2.30×109CFU)。逐日观察并记录仔猪发病死亡情况至14 d。按下述标准判定:a.死亡;b.出现发热症状,且体温升高至40.5℃及以上,并至少持续2 d;c.出现精神沉郁、喜卧、食欲减退、呼吸困难、跛行等临床症状;d.剖检可见多发性浆膜炎(胸膜炎、心包炎、腹膜炎等)、关节炎和肺脏表面或腹腔内有纤维素性渗出物。符合a判为发病,或符合d和b或c中的任何一项即可判为发病。
2 结果
2.1 抗原检验结果经SDS-PAGE(图1)和Western blot(图2)检测,PCV2 Cap蛋白抗原出现28 kDa大小的特异性条带;Mhp菌体抗原出现大小25~130 kDa的多条蛋白条带(包括蛋白P36、P46、P65、P74、P97、P102、P110等);HPS 4,5型菌体抗原出现大小10~70 kDa 的多条条带(包括外膜蛋白和酶)。

M.蛋白Marker;1,3,5,7.PBS对照;2.Cap蛋白;4.Mhp菌体蛋白抗原;6.HPS 4型菌体抗原;8.HPS 5型菌体抗原图1 4种抗原的SDS-PAGE鉴定结果

M.蛋白Marker;1,4,5,8.PBS对照;2.Cap蛋白;3.Mhp菌体蛋白抗原;6.HPS 4型菌体抗原;7.HPS 5型菌体抗原图2 4种抗原的Western blot鉴定结果
2.2 安全性评价结果
2.2.1体温监测 疫苗2倍剂量接种实验猪,个别仔猪在接种疫苗后4 h体温一过性升高(P<0.01),24 h后恢复正常,但免疫组与对照组均无显著性差异(P>0.05)(图3)。

图3 体温变化趋势图(**P<0.01)
2.2.2体质量监测 疫苗2倍剂量接种实验猪,在免疫前和免疫后14 d对免疫组与对照组分别测体质量,利用SPSS软件分析显示,免疫组与对照组平均日增重差异不显著(P>0.05,P=0.619),表明疫苗对仔猪增重无显著性影响(图4)。

图4 平均相对日增重比较结果
2.2.3临床观察及剖检结果 疫苗接种实验猪后,14 d观察周期内免疫组仔猪全部健活,精神状态良好,行为、采食和粪便均正常。观察期结束后,各组实验仔猪注射部位未见明显的红肿、硬结,剖检观察疫苗吸收良好,无残留,无肉芽肿的形成;各主要脏器未见异常,未出现全身不良反应,免疫猪与对照猪相比接种部位剖检和HE染色检测无明显差异;表明该疫苗接种均未引起临床、局部和全身不良反应(表1,图5)。
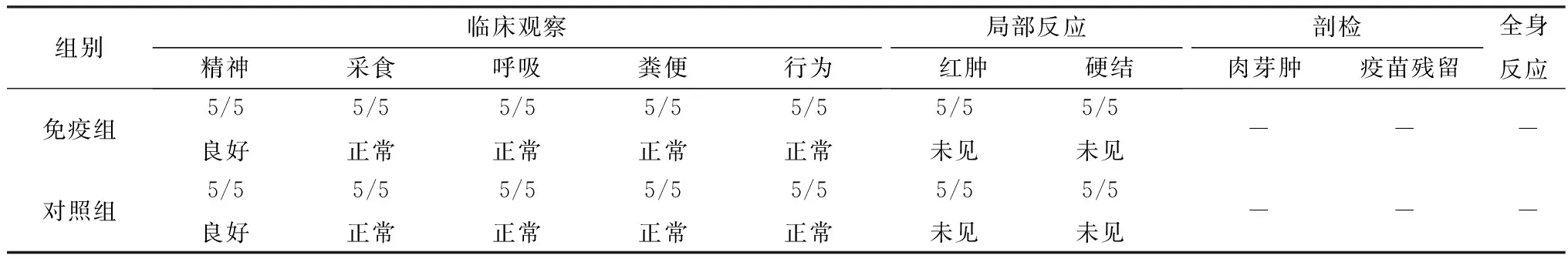
表1 临床观察结果
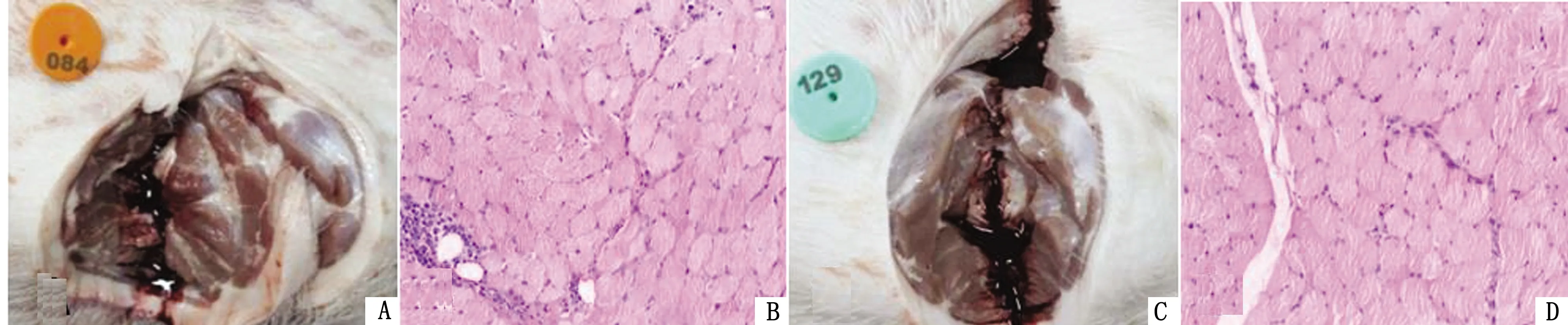
A.免疫猪接种部位;B.免疫猪接种部位病理切片,HE染色;C.未免疫猪接种部位;D.未免疫猪接种部位病理切片,HE染色图5 免疫猪与未免疫猪接种部位剖检和病理分析结果
2.3 免疫猪抗体监测疫苗首免后14 d,个别猪只PCV2 Cap ELISA抗体转阳(S/P值≥0.4);二免后14 d,免疫组所有猪的PCV2 Cap ELISA抗体全部转阳,S/P平均值达到1.291±0.091,对照组始终为阴性(S/P值<0.4)(图6A);疫苗二免后7 d,免疫组所有猪的Mhp ELISA抗体全部转阳(S/P值≥0.4),二免后14 d Mhp ELISA抗体S/P平均值达到1.133±0.150,对照组始终为阴性(S/P值<0.4)(图6B);疫苗二免后14 d,免疫组所有猪的HPS 4,5型MAT抗体全部转阳,分别为1∶27.9和1∶21.1,对照组始终为阴性(MAT抗体效价<1∶4)(图6C,D)。
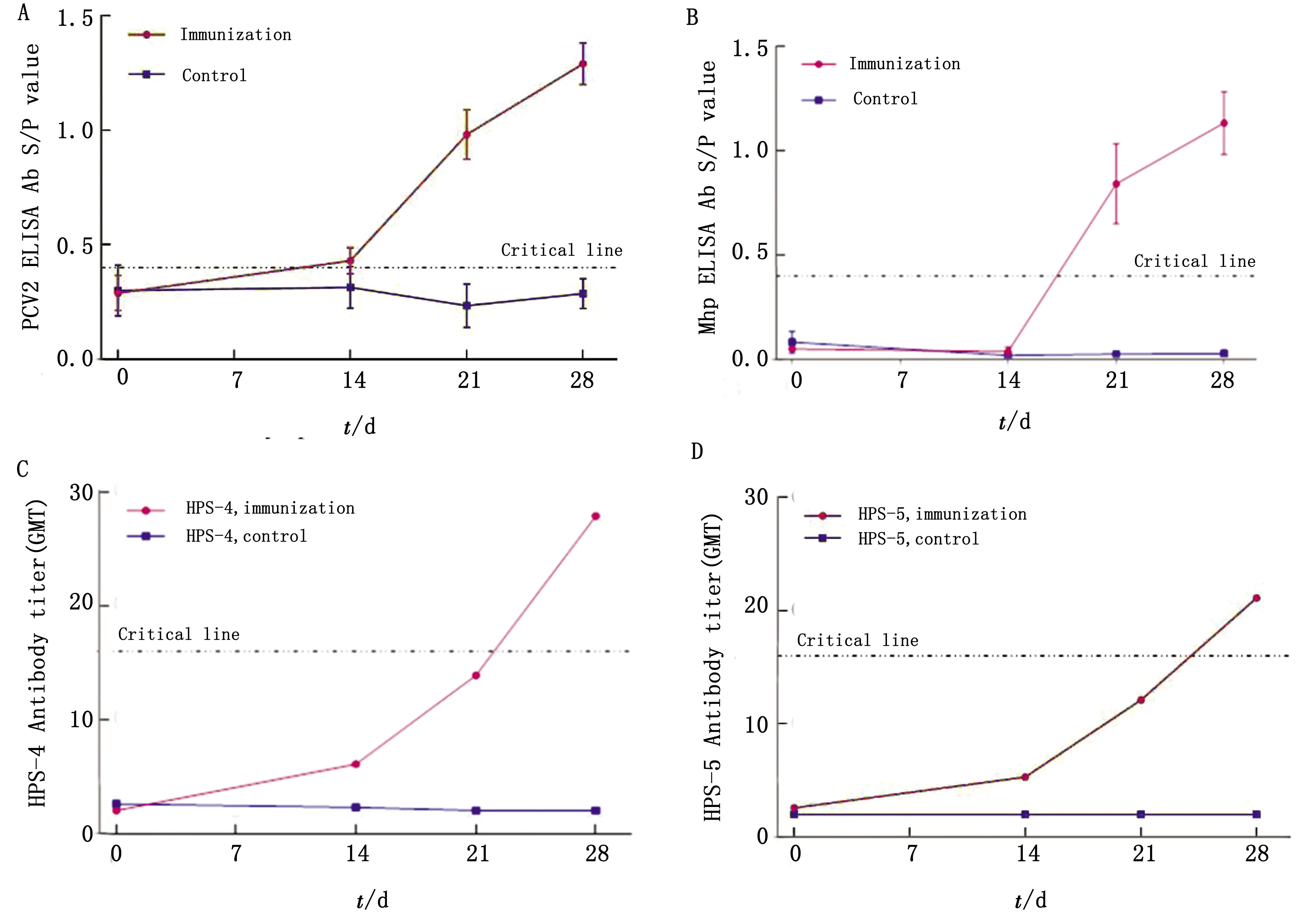
A,B.PCV2、Mhp ELISA抗体变化趋势; C,D.HPS 4,5型MAT抗体变化趋势图6 三联苗免疫猪抗体变化
2.4 PCV2攻毒保护试验在PCV2攻毒试验中,免疫攻毒组平均相对日增重与空白对照组差异不显著(P>0.05,P=0.726),攻毒对照组与空白对照组差异不显著(P>0.05,P=0.423);血清病毒核酸PCR检测,免疫组4/5阴性,攻毒对照组4/5阳性;免疫组化检测,免疫组4/5阴性,攻毒对照组5/5阳性。综合判定,疫苗免疫攻毒组为4/5保护,攻毒对照组4/5发病,空白对照组5/5正常(表2)。

表2 二免后14 d PCV2攻毒保护结果
2.5 Mhp攻毒保护试验由表3、图7结果显示,疫苗免疫组猪肺炎病变减少率为61.35%。

表3 二免后14 d Mhp攻毒保护结果
2.6 HPS 4,5型攻毒保护试验HPS 4型免疫猪5/5保护,攻毒对照猪5/5发病(表4);HPS 5型免疫猪4/5保护,攻毒对照猪4/5发病(表5);三联苗对HPS 4,5型攻毒均达到80%的保护效果。

表4 二免后14 d HPS 4型攻毒保护结果

表5 二免后14 d HPS 5型攻毒保护结果
3 讨论
PCV2、Mhp与HPS混合感染给全球养猪业造成巨大经济损失,因此,对3种病原的防控尤为重要,目前已上市的用于预防3种疫病的疫苗包括PCV2全病毒灭活疫苗、PCV2基因工程亚单位疫苗(大肠杆菌源和昆虫细胞源)、Mhp灭活疫苗、HPS灭活疫苗(二价或三价)、PCV2、MPS二联灭活疫苗和PCV2、HPS二联灭活疫苗,主要以单苗或二联苗为主[22-25],而对于3种抗原的三联疫苗尚未见报道。本研究首次研制PCV2、Mhp和HPS三联灭活疫苗,猪体试验证明该疫苗可以提供对3种病原的有效保护。
本研究利用杆状病毒表达系统表达的PCV2 Cap蛋白抗原、Mhp灭活抗原、HPS 4型和5型灭活抗原,结合水溶性佐剂制备三联灭活疫苗。首先对制苗用抗原进行特异性检验,PCV2 Cap蛋白大小为28 kDa;对于Mhp菌体抗原,已鉴定清楚的有十几种免疫相关蛋白,主要包括细胞质蛋白P36,膜蛋白P46、P65和P74,黏附因子P97、P102、P110和P116等[26],本研究鉴定出多条大小相似的条带;HPS 4,5型菌体抗原的蛋白成分主要为外膜蛋白和酶[27-28],本研究出现相关大小的条带;结果均表明4种制苗抗原特异性良好。在安全性检验中,所有免疫猪精神、采食、呼吸、粪便和行为均未见异常,与对照猪无显著性差异,个别猪体温在接种疫苗后有一过性升高,24 h后恢复正常,未见局部和全身不良反应,与现行《中国兽药典》和《兽药质量标准》中猪用灭活疫苗安全性检验标准要求一致[29-30]。在抗体监测中,本研究以50 μg/头份剂量2次免疫试验猪,PCV2 ELISA抗体于二免后7 d全部转阳,与未免疫仔猪差异极显著(P<0.01)。刘国民等[31]报道杆状病毒表达蛋白以50 μg/头份剂量1次免疫,免后30 d抗体全部转阳。Mhp ELISA抗体于二免后14 d全部转阳(S/P≥0.4),与未免疫组差异极显著(P<0.01)。崔腾飞等[32]在Mhp二次免疫效果的跟踪检测中,抗体水平低于本研究疫苗。HPS 4,5型MAT抗体于二免后14 d达到1∶16以上,未免疫组为阴性(MAT抗体效价<1∶4)。以上结果表明疫苗免疫产生了针对3种病原的特异性抗体。在攻毒保护试验中,疫苗对PCV2强毒攻击的保护率达到80%(4/5);免疫猪较攻毒对照猪肺炎病变率减少了61.35%;疫苗对HPS 4型强毒攻击的保护率达到100%(5/5),对HPS 5型强毒攻击的保护率达到80%(4/5)。综上所述,本研究制备的三联灭活疫苗,在安全性、抗体水平和攻毒保护方面均达到较好效果,将为后续该三联疫苗的研制奠定坚实的基础。
