可燃工质氨的燃烧及阻燃机理的研究
2021-10-31翟瑞杨昭张勇吕子建陈裕博
翟瑞,杨昭,张勇,吕子建,陈裕博
(天津大学机械工程学院,天津 300350)
引 言
氨气,分子式为NH3,是一种有强烈刺激性气味的无色气体。密度0.7710 kg/m3,相对密度0.5971(空气=1.00)。易被液化成无色的液体。在常温下加压即可使其液化,临界温度为132.4℃,临界压力为11.2×106Pa,标准沸点-33.5℃,熔点-77.75℃,易溶于水、乙醇和乙醚。
氨作为一种天然制冷剂,环保性优异,全球变暖潜能值(GWP)和臭氧消耗潜能值(ODP)均为零,且其价格低廉,广泛应用于各种冷库系统中。特别是在当前全球变暖问题日益突出,氨作为制冷剂在冷冻冷藏行业中的使用率越来越高,近年来已高达90%以上[1]。近年来,国内外众多学者对氨制冷技术开展研究[2-6],旨在推动氨制冷技术的发展,扩大运用范围。
但是,氨并不是十全十美的,其具有一定的毒性、可燃性和易爆性。特别是氨的燃爆性给其应用场合造成了很大的安全隐患,需要进一步的深入研究[7-9]。近年来的氨泄漏事故也频发:2013年吉林宝源丰公司[10]和上海翁牌公司[11]接连发生的两起重大冷库工质泄漏燃爆事故,分别造成121死76伤和15死25伤;韩国利川市冷冻物流中心也曾发生工质燃爆火灾事故,造成40死10伤。赵育川[12]针对冷库泄氨发生的严重事故,给出冷库制冷系统中氨充注量指导,但只针对特定的制冷系统;史纪纯[13]根据设计规范中有关氨制冷机房防爆和防毒设计要求,提出了相关的技术要求和改进方法。周永浩等[14]测试了氨气在不同实验条件下的火焰形态和燃烧极限,为氨气的燃烧方式提供指导,其研究对象为叶轮型旋流燃烧器,与实际的制冷系统有一定的差距。
国外众多学者[15-19]针对氨在制冷系统中发生泄漏事故后的模拟研究,为氨的安全防护提供理论依据和数据参考,但主要是在宏观层面对氨泄露后的过程进行研究,有很大的不足。当前需进一步探究氨燃烧的深层次作用机理,特别是从制冷剂的角度考虑,开展氨气的微观燃烧反应机理的研究。值得注意的是,氨催化氧化和氨燃烧氧化是截然不同的两种反应。氨催化氧化反应的产物是NO,这与催化剂的催化作用有关。而氨的燃烧氧化的产物是N2,两反应的机理不同,不可混为一谈。本文利用量子力学密度泛函理论方法,研究氨燃烧氧化过程的微观反应机理,并据此提出阻燃剂对氨的阻燃作用机理。
1 计算方法
利用Gaussian 16W[20]量子化学模拟软件,采用密度泛函理论(density functional theory,DFT)方法,在M06-2X/6-311+G(d,p)[21-22]的计算水平上,优化了燃爆反应微观路径上的反应物、过渡态(transition states,TS)、中间产物(intermediate,IM)和最终产物的分子结构。在标准条件下(25℃,101325 Pa),对NH3燃烧反应过程中涉及的反应物、TS、IM和最终产物的分子结构进行基态优化,得到稳定分子构型,同时进行频率分析。对反应物、IM和最终产物来说,它们的稳定态分子无虚频;对TS分子来说,具有唯一虚频。此外,采用内禀反应坐标法(internal reaction coordinate,IRC)[23]确定反应物、过渡态和产物之间的势能面,来验证微观路径的准确性。同时,为了提高反应过程计算势能的准确性,对所有稳定点的单点能量计算进行了零点能(zero point energy,ZPE)校正。
2 结果与分析
NH3在空气中燃烧的氧化产物是N2而不是NO,其燃烧反应的方程式为:
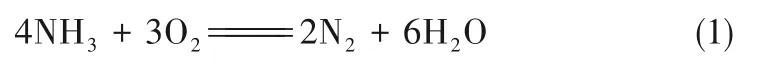
氨也有爆炸极限,氨和空气混合,遇点火源可发生爆炸。计算了NH3的三种不同类型的微观转变路径:单分子裂解反应(可燃分子的自分解);与氧气分子的碰撞反应;与自由基的碰撞反应(H、O和OH的自由基反应)。此外,还计算了典型的阻燃基团F和CF3对NH3燃烧的阻燃反应作用机制。下面将详细讨论这些可能的反应形式。
2.1 NH3燃烧机理
为确定NH3燃烧过程的微观反应机理,首先需明确NH3稳态分子的结构特征和原子运动规律,如图1所示,NH3的三条键长相同,故在与不同的分子或自由基发生反应时,只存在一条可能的反应路径。
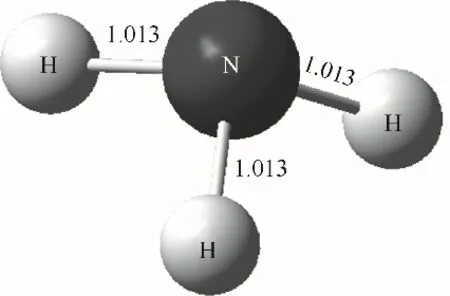
图1 NH3稳定分子构型Fig.1 Stable molecular conformation of NH3
NH3的单分子裂解反应为一个N—H键断裂,生成NH2和H自由基团,如图2所示,图中ΔH0f为焓变。该反应为吸热反应,吸热量为435.07 kJ/mol。该反应为NH3后续的燃烧链式反应提供活性自由基H,同时反应的中间产物会进一步发生裂解或碰撞反应,N原子最终生成产物N2。
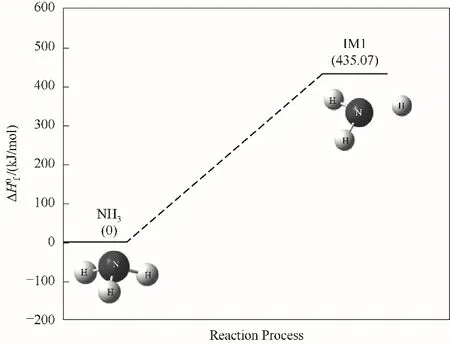
图2 NH3裂解反应路径的反应能垒变化Fig.2 Reaction energy barrier change of NH3 cleavage reaction path
NH3与氧气分子的碰撞反应是O2分子的O O双键断裂成O—O单键,并夺取NH3分子上的一个H原子,使得N—H键断裂,生成NH2和OOH自由基团,如图3所示。该反应存在过渡态TS2,其反应能垒为193.76 kJ/mol,反应吸热,吸热量为16.52 kJ/mol。对比其自身裂解反应,该反应的反应能垒降低很多,反应吸热量也较小。为NH3后续的燃烧链式反应引入O原子,提供活性自由基OOH。虽然OOH不能直接与NH3反应,但是OOH可分解生成O和OH自由基,为后续反应提供活性自由基。
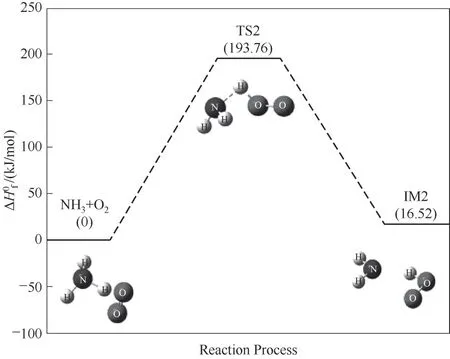
图3 NH3与O2反应路径的反应能垒变化Fig.3 Reaction energy barrier change for the reaction path of NH3 and O2
NH3与H自由基的碰撞反应是H自由基夺取NH3分子上的一个H原子,使得N—H键断裂,生成NH2自由基团和H2,如图4所示。该反应存在过渡态TS3,其反应能垒为53.19 kJ/mol,反应吸热,吸热量为16.76 kJ/mol。对比其自身裂解以及和氧气碰撞反应,该反应的反应能垒降低很多,反应的优先级更高,反应更易发生。
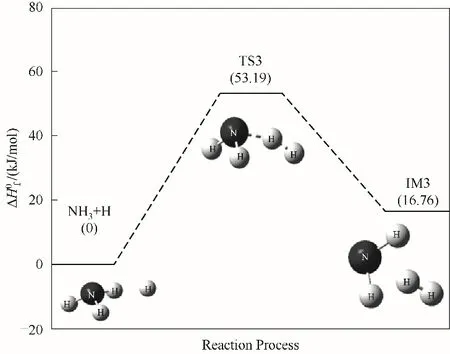
图4 NH3与H自由基反应路径的反应能垒变化Fig.4 Reaction energy barrier change for the reaction path of NH3 and H
NH3与O自由基的碰撞反应是O自由基夺取NH3分子上的一个H原子,使得N—H键断裂,生成NH2和OH自由基团,如图5所示。该反应存在过渡态TS4,其反应能垒为42.06 kJ/mol,该反应为吸热反应,吸热量为8.65 kJ/mol。该反应可为后续反应提供活性自由基OH。
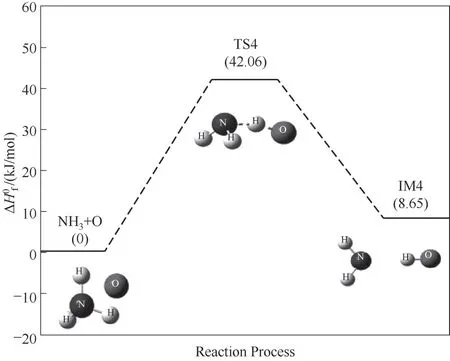
图5 NH3与O自由基反应路径的反应能垒变化Fig.5 Reaction energy barrier change for the reaction path of NH3 and O
NH3与OH自由基的碰撞反应是OH自由基夺取NH3分子上的一个H原子,使得N—H键断裂,生成NH2自由基和H2O,如图6所示。该反应存在过渡态TS5,其反应能垒为3 kJ/mol,反应放热,放热量为58.63 kJ/mol。值得注意是经过该反应,使得NH3中的H原子与OH基团结合,生成最终产物H2O。而由NH3的总反应方程式可知,其H原子最终与O原子结合生成最终产物H2O。
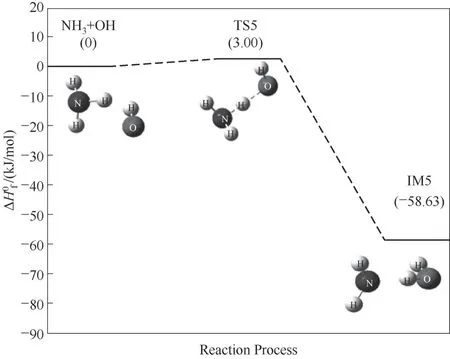
图6 NH3与OH自由基反应路径的反应能垒变化Fig.6 Reaction energy barrier change for the reaction path of NH3 and OH
上述NH3的燃烧微观反应计算结果表明,该燃烧过程是一个逐步反应过程,单分子裂解反应和与氧气分子的反应是起始反应阶段,与活性自由基(H、O和OH自由基)的反应构成了燃烧链式反应过程的主体,使燃烧过程进入快速反应阶段。
2.2 NH3阻燃机理
为减弱NH3的可燃可爆性,又进一步计算了不同的阻燃基团对可燃分子NH3的阻燃微观反应路径,包含两种阻燃基团F和CF3,计算结果见图7和图8。
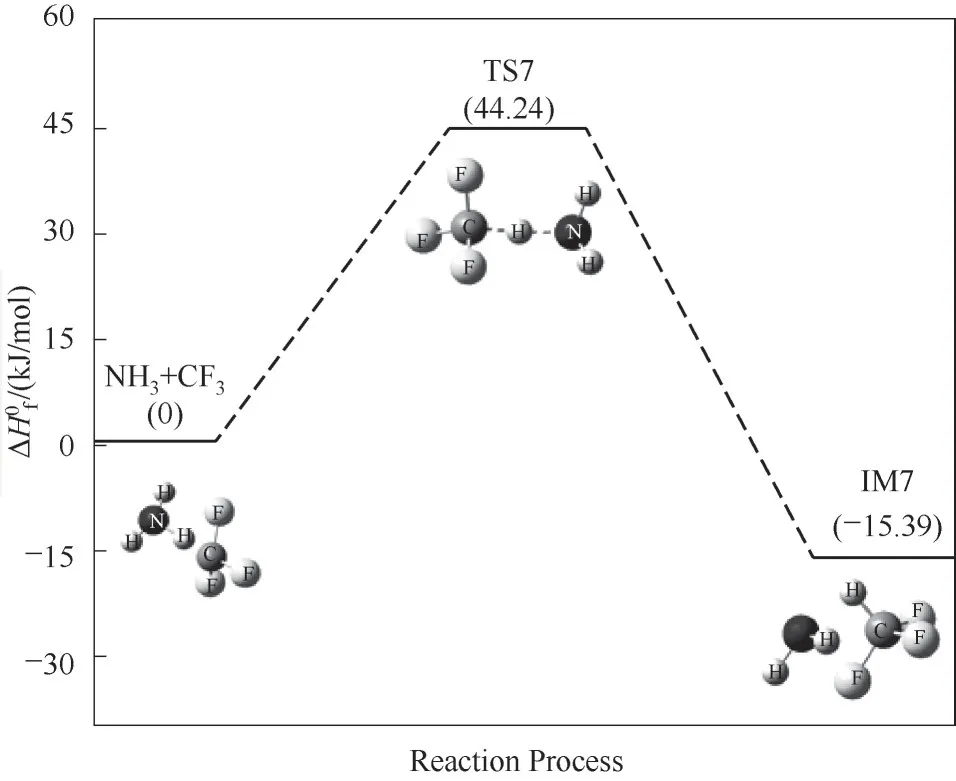
图8 NH3与CF3自由基反应路径的反应能垒变化Fig.8 Reaction energy barrier change for the reaction path of NH3 with CF3 radicals
NH3与阻燃基F发生反应,F自由基夺取NH3分子上的一个H原子,使得N—H键断裂,生成NH2自由基和稳定产物HF,如图7所示。该反应存在过渡态TS6,计算结果表明该反应能垒为10.75 kJ/mol,说明F自由基极易与NH3分子发生反应,验证了卤族元素F具有阻燃效果。
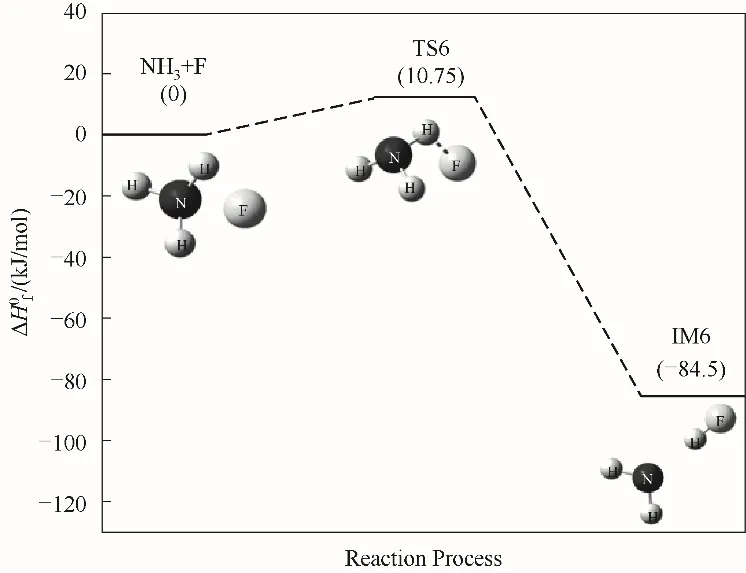
图7 NH3与F自由基反应路径的反应能垒变化Fig.7 Reaction energy barrier change for the reaction path of NH3 with F radicals
NH3与阻燃基CF3发生反应,CF3自由基夺取NH3分子上的一个H原子,使得N—H键断裂,生成NH2自由基和产物CF3H,如图8所示。该反应存在过渡态TS7,反应能垒为44.24 kJ/mol,反应放出热量。与NH3分子的燃烧微观反应路径的能垒比较,可知虽然阻燃基CF3与NH3反应需要具有一定的反应能垒,但是其能垒值较小,且反应放出部分热量作出了一些补偿。
上述两种阻燃基团F和CF3与NH3的阻燃微观反应计算结果表明,这两种阻燃基团均可与可燃分子反应,剥夺燃烧过程的反应物,以达到阻燃的效果。且通过对比两种阻燃基团的计算结果表明,F阻燃基的阻燃效果更好。对于常见阻燃剂如R134a(CH2FCF3)、R125(CHF2CF3)、R227ea(CF3CHFCF3)和R245fa(CF3CH2CHF2)来说,显然F和CF3基团均是其分子重要阻燃部分,而该部分的计算从微观上验证了阻燃剂是通过自身的阻燃基团与可燃工质反应来达到阻燃效果。
3 结 论
本文采用量子化学密度泛函理论方法对NH3的燃烧及阻燃机理进行了研究,开展了微观反应路径分析,得到主要结论如下。
(1)NH3的燃烧微观反应的起始路径可分为两种,一是NH3分子中N—H键断裂引起自身裂解,二是与氧气发生碰撞分解。
(2)NH3的燃烧微观反应的主要部分是与不同的活性自由基碰撞反应,得到NH3分子可与H、O、OH自由基反应,且反应能垒较低。
(3)两种阻燃基团F和CF3对可燃分子NH3的燃烧微观反应路径计算结果表明,反应路径TS6的能垒较低,反应TS7的优先级较高,从分子动力学反应机理来看,阻燃基团F和CF3均可通过与可燃工质分子反应,来消耗燃烧反应关键物质,以达到对可燃工质NH3燃爆的阻燃作用。
