响应面法优化超声辅助酶法制备无骨鸡爪胶原蛋白肽
2021-10-29卢方云吴瑀婕吴海虹张新笑徐为民王道营
周 婷,卢方云,黄 瑾,吴瑀婕,吴海虹,张新笑,徐为民,邹 烨,,王道营,
(1.南京农业大学食品科技学院,江苏南京 210095;2.江苏省农业科学院农产品加工所,江苏南京 210014)
胶原蛋白(Collagen)是一种几乎存在于所有动物体内的生物高分子聚合物,约占动物体内总蛋白的30%[1]。胶原蛋白肽是胶原蛋白的降解产物,是通过酸、碱和蛋白酶等水解得到的一系列短肽,相对分子质量分布范围在几百至几千道尔顿。目前,传统的胶原蛋白肽原料来源仍集中于牛骨、牛皮和猪皮等,但近年来疯牛病、口蹄疫、猪瘟等疾病的持续爆发和极高的传染性[2],人们对这些类胶原蛋白肽产品的安全性表示怀疑;另外由于宗教信仰和社会问题,来自牲畜的胶原蛋白肽产品在部分地区受到抵制。我国家禽业规模庞大,目前是世界上家禽第二生产国,2019 年的鸡肉产量高达1830 万吨,仅次于美国[3]。鸡爪是富含Ⅰ型胶原蛋白的产品,此胶原蛋白受热易溶出,所以其具有很高的营养价值和极佳的口感。当前国内外研究偏向于水产和海产胶原蛋白肽,对于从家禽中提取胶原蛋白肽的有关研究和报道偏少。
胶原蛋白肽具备许多优异的功能特性,如保水性、溶解性、乳化性、起泡性和抗氧化性等[4]。目前工业上通常采用化学方法(酸碱法)提取胶原蛋白肽,采用酸液或碱液的作用断开肽键的化学类方法,反应过程较为剧烈,得到的产物结构可能会被严重损坏。酶法相较于常规的化学方法,因其周期短、污染小、温和安全更占据优势;超声波设备操作简单,应用范围广且效率高效。由于酶解技术也存在一定的缺陷,所以动物胶原的提取一般采用复合法,通过一些辅助技术与酶法结合,此研究将超声波技术作为辅助技术,辅助酶处理可使细胞结构疏松,利于溶剂渗透到细胞中,缩短胶原蛋白肽提取时间,提高胶原蛋白肽得率。故本研究拟以无骨鸡爪为原料,考察料液比、酶解时间、超声功率对无骨鸡爪胶原蛋白肽得率的影响,旨在提高胶原蛋白肽的产率,并对其理化性质进行研究,有望为生产胶原蛋白肽提供一种新的途径,同时为畜禽类副产物的利用开辟新的途径,提供新的思路。
1 材料与方法
1.1 材料与仪器
单冻鸡爪 山东荣华食品集团有限公司,冰冻状态保存于实验室冷冻柜中,用蒸馏水清洗一下,低温通风晾干后分装好在−20 ℃保存备用;胃蛋白酶(猪胃粘膜)(USP 级,1:30000)、木瓜蛋白酶(800 U/mg)、胰蛋白酶(1:4000)、碱性蛋白酶(200 U/mg)、复合蛋白酶(120 U/mg) 源叶生物公司;氢氧化钠、无水碳酸钠和盐酸 国产分析纯,国药集团化学试剂有限公司;羟脯氨酸(Hyp)测试盒(消化法)和羟脯氨酸试剂标准品 南京建成生物工程研究所。
PTX-FA210S 电子天平 福州华志科学仪器;HTP-312 电子天平 上海花潮实业有限公司;国华78-1 磁力加热搅拌器、HH-4 数显恒温水浴锅 常州国华电器有限公司;SCIENTZ-IID 超声波细胞粉碎机 宁波新芝生物科技股份有限公司;DF-101S 数显集热式磁力搅拌器 上海易友仪器有限公司;FiveEasy Plus pH 计 梅特勒-托利多仪器(上海)有限公司;Eppendorf 离心机 德国艾本德股份公司;TG16-WS 台式高速离心机 湖南湘仪实验室仪器开发有限公司;XW-80A 微型漩涡混合仪 上海沪西分析仪器有限公司;Gen5 全波长酶标仪 美国伯腾仪器有限公司;Direct-Q3uv 超纯水机 美国Millipore 公司;Alpha1-2LDplus 实验室型冻干机德国Christ 公司。
1.2 实验方法
1.2.1 无骨鸡爪胶原蛋白肽的酶解工艺流程 无骨鸡爪的制备→脱脂和除杂→水洗→超声波辅助酶解→灭酶→离心→胶原蛋白肽提取液→冻干成粉末
1.2.2 工艺操作要点
1.2.2.1 鸡爪剔骨 将冷冻鸡爪进行流水解冻,用70~80 ℃的水浸泡3~6 min。把鸡爪依次捞出掌心朝上置于砧板,首先用刀在鸡爪跗跖骨末端和关节处横切,然后沿着跗跖骨竖切一刀,此时顺着刀口可取出跗跖骨;再用剪刀除去趾骨,在每根趾上竖切,依次取出趾骨,剩余部分则称为无骨鸡爪。然后将所得的无骨鸡爪分装于自封袋中,于−20 ℃中保藏备用。
1.2.2.2 无骨鸡爪脱脂 将一定量的皮块组织颗粒装入烧杯中,首先向其中加入5 倍蒸馏水(以皮块质量为基准),而后加入0.5%的NaOH 和0.5%的Na2CO3(以蒸馏水的质量为基准),混合均匀后在40 ℃搅拌1 h,后取出样品冷却淋干,再加入0.5%的Na2CO3(以蒸馏水的质量为基准),继续搅拌1 h,待冷却淋干后密封保存备用。
1.2.2.3 无骨鸡爪除杂 无骨鸡爪在0.1 mol/L的NaOH溶液(液料比10:1 mL/g)中浸6 h,溶液每3 h 更换一次,碱处理后的样品要用去离子水冲洗至中性。以除去其中多余杂质和非胶原成分。
1.2.2.4 真空冷冻干燥 将制得的无骨鸡爪胶原蛋白肽提取液倒入玻璃平皿中,在−18 ℃冰箱中冷冻24 h,放入冻干机中真空冷冻干燥48 h,得到无骨鸡爪胶原蛋白肽粉末,放置于干燥器中备用。
1.2.3 无骨鸡爪成分的测定 水分含量测定参照GB5009.3-2016 直接干燥法[5];灰分含量测定参照GB5009.4-2016 高温灼烧法[6];脂肪含量测定参照GB5009.6-2016 索氏抽提法[7];蛋白质含量测定参照GB5009.5-2016 凯式定氮法[8]。
1.2.4 羟脯氨酸含量的测定及胶原蛋白肽得率的计算 胶原蛋白肽被含有一定量氯化亚锡的盐酸溶液水解释放出羟脯氨酸,经过氧化剂氯胺T 氧化后,在一定温度条件下可与对二甲氨基苯甲醛溶液反映生成红色络合物,在550 nm 波长处具有最大吸收峰,因此,可用紫外分光光度法进行定量测定[9]。以下公式(1)和(2)分别是胶原蛋白肽含量和胶原蛋白肽得率。
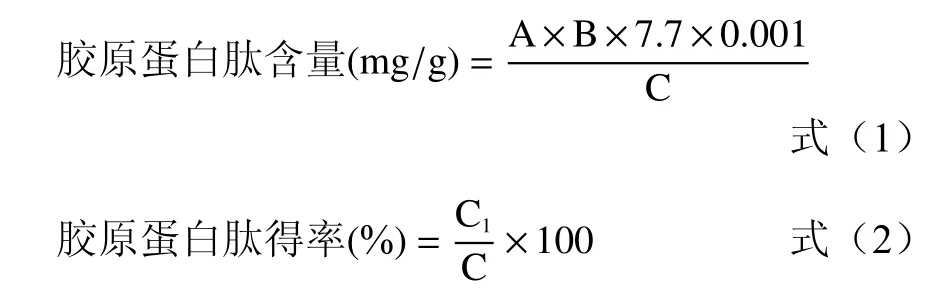
式中:A 为羟脯氨酸含量(μg/mL);B 为酶解过程提取液的体积(mL);7.7 为无骨鸡爪胶原蛋白肽含量与羟脯氨酸含量换算系数;C 为无骨鸡爪样品干重(g);C1为无骨鸡爪胶原蛋白肽提取液的冻干量(g)。
1.2.5 酶的选择 不同蛋白酶因其专一性具有不同的酶切位点[10],本次试验分别采用木瓜蛋白酶、胃蛋白酶、碱性蛋白酶、复合蛋白酶和胰蛋白酶对无骨鸡爪进行酶解,筛选出一种适用于提取无骨鸡爪中胶原蛋白肽的酶。取用一定量的无骨鸡爪进行预处理,测定其中胶原蛋白肽的含量。经过预处理的无骨鸡爪平均分成5 份,每份湿重约为10 g(干重为3.534 g),控制料液比为1:15,超声时间为30 min,超声功率为200 W,提取的pH 分别为7.5(木瓜蛋白酶)、2.0(胃蛋白酶)、9.0(碱性蛋白酶)、7.0(复合蛋白酶)和7.8~8.5(胰蛋白酶),酶解温度除了复合蛋白酶在55 ℃下提取,其它蛋白酶均在45 ℃下进行提取,酶解时间均为4.0 h,加酶量均为6000 U/g。
1.2.6 超声辅助酶法提取的单因素实验 将经过预处理(脱脂和除杂)后的无骨鸡爪称取湿重5 g(干重为1.767 g)左右,进行超声波(工作时间2 s、停止时间3 s)辅助提取,最终以胶原蛋白肽得率为指标,分别研究料液比、超声功率、超声时间和酶解时间四个因素条件的选择。
1.2.6.1 料液比对胶原蛋白肽得率的影响 往经过处理的无骨鸡爪中加入蒸馏水,固定料液比为1:5、1:10、1:15、1:20、1:25、1:30 g/mL,对其进行超声功率200 W,超声时间30 min 作用后,分别向其中加入0.0525 g的碱性蛋白酶(加酶量为6000 U/g),调节pH 使其稳定于9.0。而后放入45 ℃恒温水浴锅中酶解4 h,最后在100 ℃中灭酶10 min,取出冷却,在10000 r/min 离心10 min,取上清液测定其中羟脯氨酸含量,并将所得上清液冻干成胶原蛋白肽粉。
1.2.6.2 超声功率对胶原蛋白肽得率的影响 称取经过处理的无骨鸡爪5 g 左右,以1:15 g/mL的比例加入蒸馏水,对其分别进行超声功率100、150、200、250、300 W 作用,其余步骤同1.2.6.1。
1.2.6.3 超声时间对胶原蛋白肽得率的影响 称取经过处理的无骨鸡爪5 g 左右,以1:15 g/mL的比例加入蒸馏水,进行超声功率为200 W,超声时间分别为20、25、30、35、40 min 作用后,其余步骤同1.2.6.1。
1.2.6.4 酶解时间对胶原蛋白肽得率的影响 称取经过处理的无骨鸡爪5 g 左右,以1:15 g/mL的比例加入蒸馏水,进行超声功率为200 W,超声时间为30 min 作用后,向其中加入0.0525 g的碱性蛋白酶(加酶量为6000 U/g),调节pH 使其稳定于9.0,放入45 ℃恒温水浴锅中分别酶解3.5、4、4.5、5 h,其余步骤同1.2.6.1。
1.2.7 响应面优化试验 以单因素实验得到的结果为基础,以料液比、超声功率和酶解时间为响应因子,进行三因素三水平的Box-Behnken 试验,依据回归分析确定各工艺条件的影响因素,以胶原蛋白肽得率为响应值,分析优化的最佳提取条件,每一自变量的低、中、高实验水平分别以−1、0、1 进行编码,试验的各因素水平见表1。
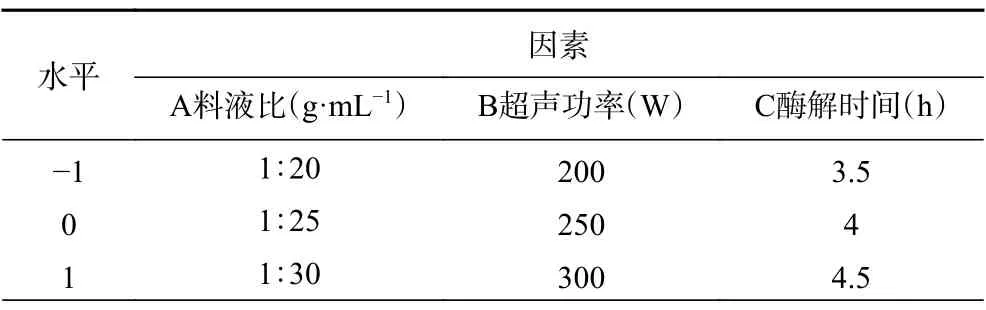
表1 Box-Behnken 试验因素水平设计Table 1 Factor level of Box-behnken test
1.2.8 无骨鸡爪胶原蛋白肽在不同pH 下的溶解度测定 为了验证经过响应面优化提取的无骨鸡爪的胶原蛋白肽的溶解性能,准确称取0.5 g(精确到0.001 g)响应面优化条件下制得的无骨鸡爪胶原蛋白肽样品(即在酶解时间为4 h 条件下得到的产物),加入50 mL的蒸馏水,用0.1 mol/L HCl 溶液或0.1 mol/L NaOH 溶液调节pH 为4.0、5.0、6.0、7.0、8.0、9.0、10.0,等pH 稳定后常温下用磁力搅拌器均匀搅拌肽液30 min,然后用离心机5000 r/min 离心15 min,吸取上清液并用考马斯亮蓝法测定蛋白质含量[11]。计算公式如下:

1.3 数据分析
试验结果采用Excel 2016、Origin 9.0、Design-Expert 8.0.6 对数据进行整理分析和作图。数据分析采用软件SPSS 18.0,运用单因素ANOVA-图基法对数据进行单因素检验分析,P<0.05 表示两组数据间具有显著性差异。Design-Expert 8.0.6 软件用于响应面分析,得出最优提取值。
2 结果与分析
2.1 无骨鸡爪的基础成分
无骨鸡爪的基础成分如表2 所示,无骨鸡爪蛋白质含量为48.68%,脂肪含量为19.87%,其蛋白质含量高脂肪含量低,是一种优质的蛋白质资源。根据以往相关文献[12]可得,猪肉中蛋白质含量约为10.88%~15.76%,鸡肉中蛋白质含量约为16.24%~19.42%,兔皮中蛋白质含量约为20.68%~28.43%,由此可见,无骨鸡爪中粗蛋白含量相对较高,有利于后期胶原蛋白肽的提取与优化。
2.2 酶的选择
试验结果以胶原蛋白肽得率作为指标,因此,通过测定酶解液中胶原蛋白肽含量即可选出适宜的酶进行接下来的实验。
从图1 可得出,以酶解所得胶原蛋白肽得率为指标,五种酶提取无骨鸡爪胶原蛋白肽的能力高低顺序为:碱性蛋白酶>胰蛋白酶>复合蛋白酶>胃蛋白酶>木瓜蛋白酶,即碱性蛋白酶作用最为显著(P<0.05),因此选用碱性蛋白酶提取无骨鸡爪胶原蛋白肽。碱性蛋白酶具有催化水解肽键的能力[13],与反应物结合,破坏无骨鸡爪中大分子物质的二级结构,最终使二级结构分解为分子量更小的肽链或氨基酸[14]。
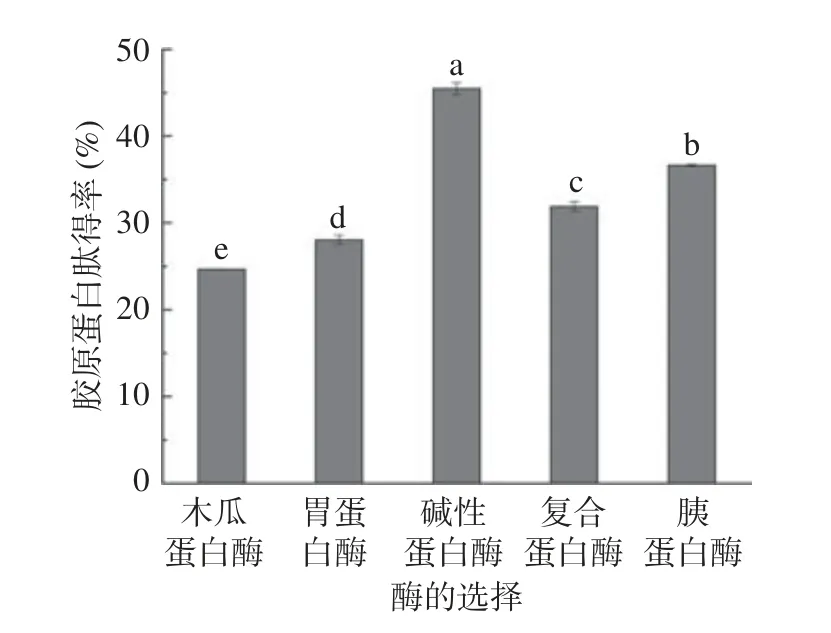
图1 酶的种类与无骨鸡爪胶原蛋白肽得率的关系Fig.1 Relationship between enzyme types and collagen peptide yield of boneless chicken feet
2.3 单因素实验结果
2.3.1 料液比对胶原蛋白肽得率的影响 适宜的料液比对胶原蛋白肽的提取至关重要,可直接影响酶与底物的接触面积和接触程度[15]。由图2 可知,无骨鸡爪胶原蛋白肽得率在料液比1:5~1:25 g/mL 之间整体呈现上升的趋势,当料液比达到1:25 g/mL 时,其得率达到最大,而后随着料液比增加,得率开始呈现缓慢下降趋势。随着料液比的增加,胶原蛋白肽得率增加是因为酶与底物充分结合使得反应完全[16];由于加入酶和皮块的质量是一定的,不同的液料比会影响其浓度,因而影响其酶解的速率,当液料比达到1:25 g/mL 时,无骨鸡爪组织变成足够疏松状态,此时继续增大料液比,对于整个反应体系来说,酶的浓度降低,其与底物不能达到最佳作用点[17−18],胶原蛋白肽得率不会继续增加,因此,最佳料液比选定为1:25 g/mL。
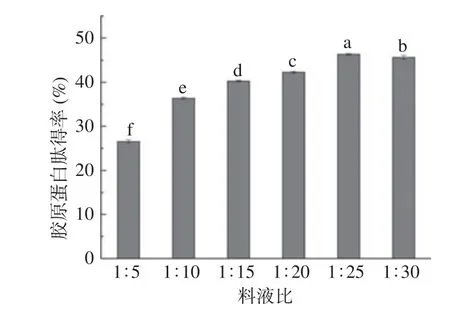
图2 料液比对胶原蛋白肽得率的影响Fig.2 Effect of the ratio of material to liquid on the yield of collagen peptide yield
2.3.2 超声功率对胶原蛋白肽得率的影响 超声波技术具有时间短,效率高的特点[19],有研究表明,经超声辅助制得的胶原蛋白肽得率与传统酶法相比提高了25%[20]。如图3 所示,无骨鸡爪胶原蛋白肽得率在超声功率为100~250 W 之间逐渐增加,当超声功率为250 W 时,胶原蛋白肽得率达到一个峰值,后随着超声功率的增加,其得率开始下降。由于适当的超声功率所产生的超声波可加快水的振动,使传质强化,同时增大样品组织间隙和加大细胞的破碎程度,促进后续酶的进入,有利于酶解反应的进行。在超声强度较低时,超声波强度越大所产生的空化效应越明显,但当超声强度增加到一定程度后出现过饱和现象,形成音障,阻碍超声波的传递,从而使超声作用减弱[21]。因此,最佳超声功率选定为250 W。
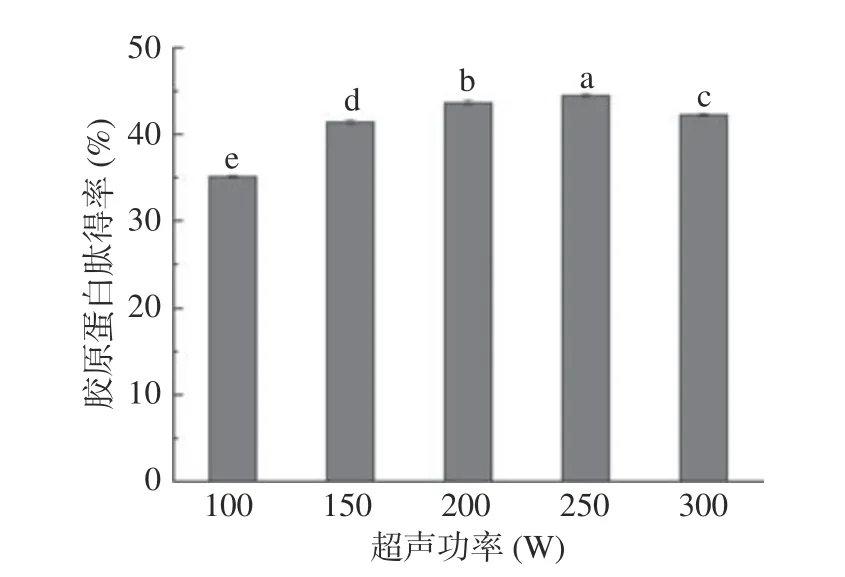
图3 超声功率对胶原蛋白肽得率的影响Fig.3 Effect of ultrasonic power on collagen peptide yield
2.3.3 超声时间对胶原蛋白肽得率的影响 随着超声时间的增长,产生的空化效应更加强烈,局部产生的高温高压有利于后期实验酶的融入,加快胶原蛋白肽的提取[22]。图4 结果显示,无骨鸡爪中胶原蛋白肽得率随着超声时间的增加变化显著,超声时间为25 min 时,胶原蛋白肽得率最大。随着超声时间的增加,超声体系的温度逐渐升高,有可能会破坏样品组织结构,使样品中胶原蛋白发生部分水解。超声时间在20~25 min 之间,无骨鸡爪中胶原蛋白肽得率增加,这是因为超声波在细胞内引起涡流扩散,加大细胞内外有效成分的浓度差,加速细胞溶质传质速率[23],无骨鸡爪中大量胶原蛋白迅速溶出。但超声提取时间过长,超声热效应更明显,一些胶原变性,使得溶解度逐渐降低,致胶原蛋白肽得率开始下降。因此,选择超声时间25 min 为最佳值。这与张晓洁等[24]的研究结果的变化趋势相符。
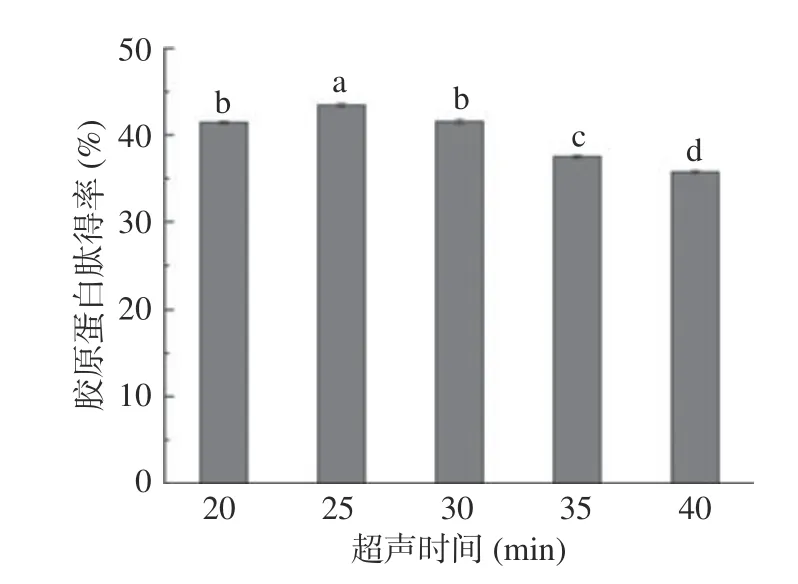
图4 超声时间对胶原蛋白肽得率的影响Fig.4 Effect of ultrasonic time on collagen peptide yield
2.3.4 酶解时间对胶原蛋白肽得率的影响 酶[25]作为一种生物催化剂,对底物的催化能力存在一定的饱和度,酶解时间反映酶与底物的接触时间,影响胶原蛋白肽最终得率,有研究表明[26]不同酶对相同底物和相同酶对不同底物的酶解时间均是不同的。在前期预实验中,发现碱性蛋白酶对无骨鸡爪酶解效果最佳,碱性蛋白酶的最佳pH 为9.0,因此选择pH9.0;关于加酶量,在前期预试验时对比过加酶量和酶解时间对胶原蛋白肽得率的影响,结果显示酶解时间对得率的影响更显著,因此选择酶解时间进行后续工艺优化。由图5 可知,无骨鸡爪中胶原蛋白肽得率在酶解时间在3.5~4.0 h 内为递增趋势,随着酶解时间的增加,底物与酶充分接触,这有利于胶原蛋白肽的提取。当酶解时间为4.0 h 时,其得率达到最大值,而后随着酶解时间的增加,其得率呈现缓慢下降趋势,这是由于当酶量一定时,酶提时间越长,部分胶原蛋白肽发生水解。当酶解时间<4.0 h 时,由于酶反应不完全,胶液浓度太稀,得率随反应时间增加而增加;当酶解时间>4.0 h 时,酶反应过度,部分胶原蛋白肽开始继续水解,使胶原蛋白肽的产品质量下降,得率随之降低。因此,最佳酶解时间为4.0 h。
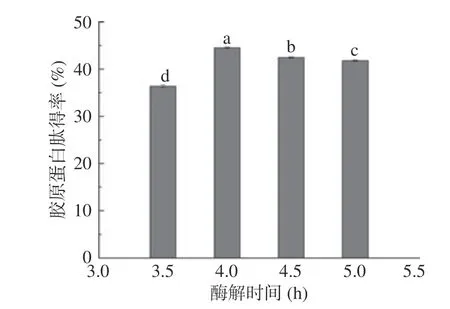
图5 酶解时间对胶原蛋白肽得率的影响Fig.5 Effect of enzymatic extraction time on collagen peptide yield
2.4 响应面试验结果与分析
2.4.1 数学模型的建立及显著性检验 通过 Design-Expert 8.0.6 数据处理软件对表3 结果进行回归拟合,得到A(料液比)、B(超声功率)、C(酶解时间)3 个因素与R1(胶原蛋白肽得率)之间的回归方程,多元二次回归模型方程(1)为R1=49.53+3.35A−0.64B−1.90C+2.43AB+2.22AC−0.27BC−7.33A2−6.10B2−2.20C2。由回归方程可知,方程(1)中A的系数最大,其次是C,最小的是B,这就表明A(料液比)对无骨鸡爪中胶原蛋白肽得率的影响作用最大。
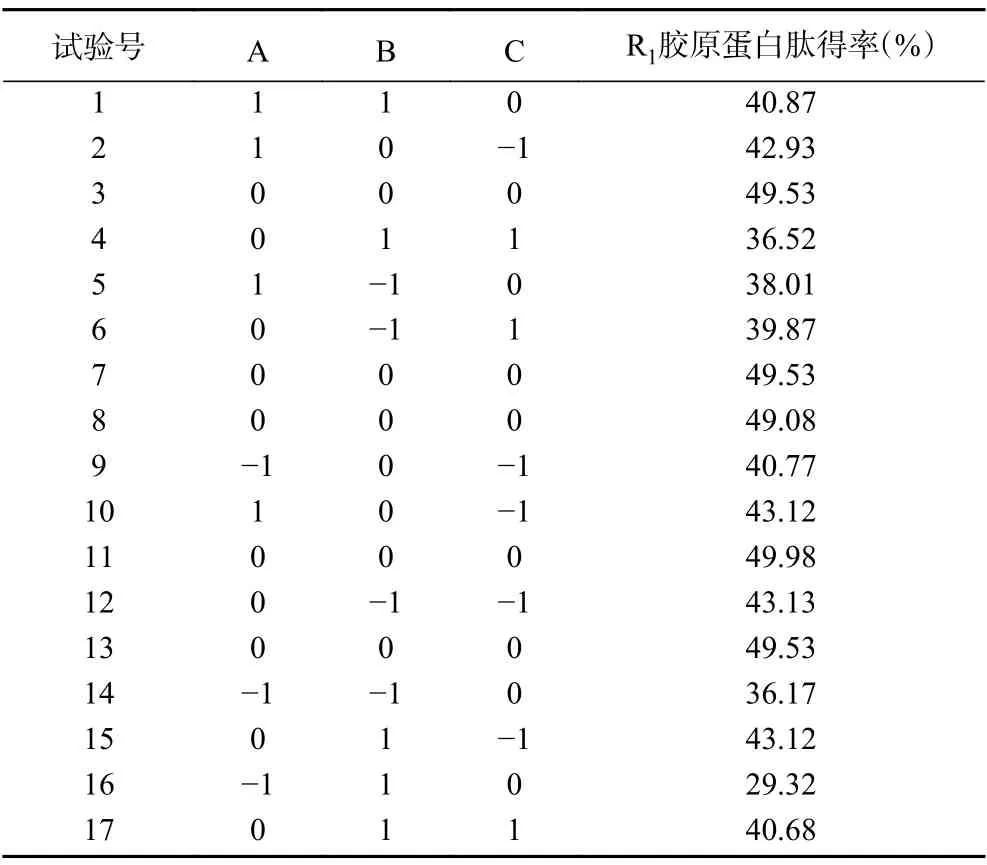
表3 Box-Behnken 试验设计及结果Table 3 Design and results of Box-Behnken experiments
由表4 可看出,模型的F=40.56>F0.01(14,4)=14.4,P<0.0001,表明本实验的模型是高度显著的,不同处理间的差异极显著;失拟项P>0.05,说明模型失拟度不显著;模型的决定系数R2=0.9570,实验值与预测值非常接近,其线性关系和二次关系是极显著的(P<0.0001),说明该模型可很好的解释响应值。模型的调整决定系数R2Adj=0.9547,说明该模型能解释95.47%响应值的变化,因而拟合程度较好,实验误差小,可用此模型对超声波辅助酶法提取无骨鸡爪中胶原蛋白肽进行分析和预测。对模型进行方差分析,结果见表4,一次项A 和C(P<0.05)显著,一次项B(P>0.05)不显著;交互项AB(P<0.05)显著,BC 和AC(P>0.05)不显著;二次项A2和B2(P<0.0001)极显著,C2(P<0.05)显著。这就表明料液比和酶解时间这两个因素对无骨鸡爪胶原蛋白肽得率具有显著的影响,料液比和超声功率的交互作用也对无骨鸡爪胶原蛋白肽得率具有显著的影响。
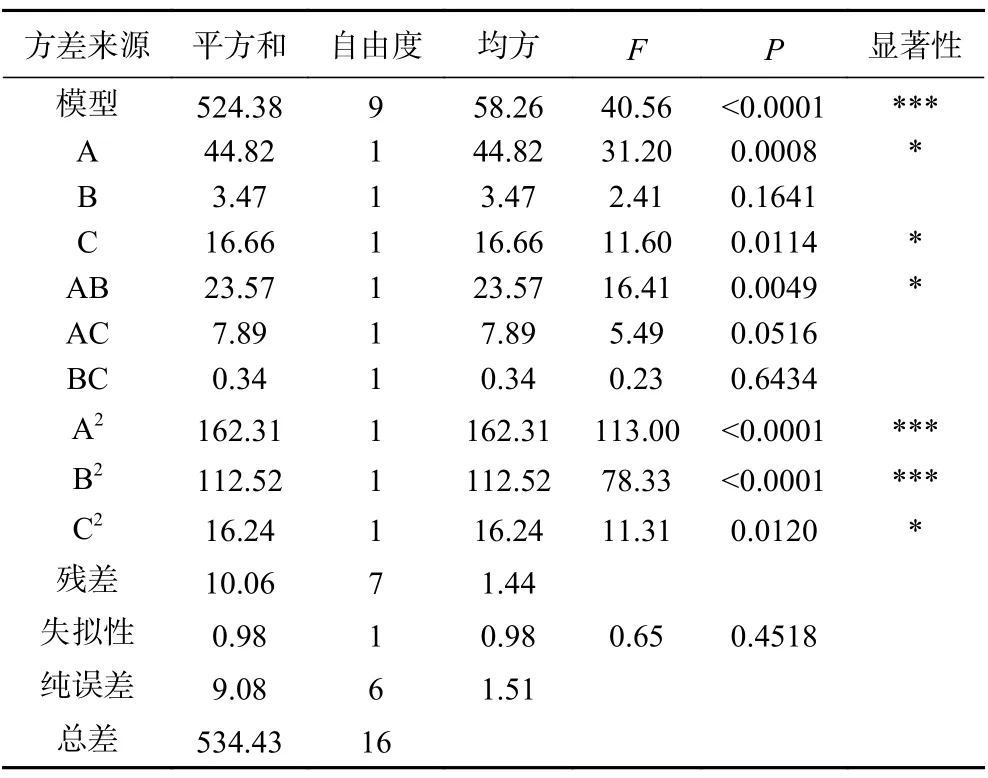
表4 回归模型方差分析Table 4 Regression model analysis of variance
2.4.2 响应面分析 超声功率、酶解时间、料液比的交互作用对响应值的影响分析如图6~图8 所示。通过响应曲面陡峭程度和三维等高线的形状,可以直观地判断两因素间交互作用程度。对比图6~图8 响应面的陡峭程度和等高线的形状可见,图6 整个坡面较陡,等高线呈现椭圆的形状,说明料液比和超声功率的交互作用对胶原蛋白肽得率影响较大。图7 和图8的响应面值坡面均较缓,等高线形状趋于圆形,可得出料液比和酶解时间的交互作用、超声功率和酶解时间的交互作用对胶原蛋白肽得率的影响均不大,这与方差分析的结果一致。所有的响应曲面图均开口朝下,这也就说明试验结果有最大值存在。
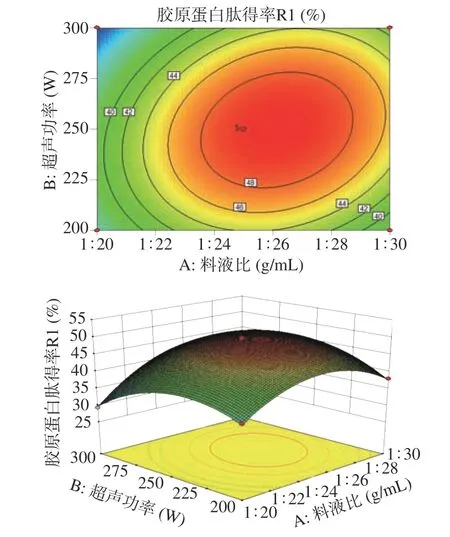
图6 料液比和超声功率对无骨鸡爪中胶原蛋白肽得率的影响的响应面图Fig.6 Response surface diagram of the effects of solid-liquid ratio and ultrasonic power on collagen peptide yield in boneless chicken feet
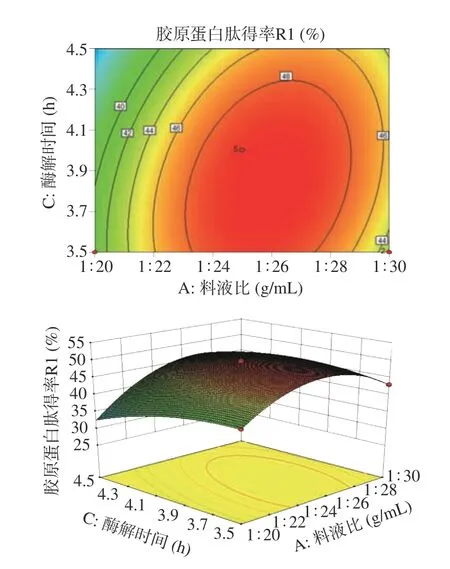
图7 料液比和酶解时间对无骨鸡爪中胶原蛋白肽得率的影响的响应面图Fig.7 Response surface diagram of the effects of feed-liquid ratio and enzymatic extraction time on collagen peptide yield in boneless chicken feet

图8 超声功率和酶解时间对无骨鸡爪中胶原蛋白肽得率的影响的响应面图Fig.8 Response surface diagram of the effects of ultrasonic power and extraction time were used to obtain collagen peptide from boneless chicken feet
2.4.3 无骨鸡爪胶原蛋白肽提取工艺参数的优化和模型验证 通过响应面法得到无骨鸡爪胶原蛋白肽的最优提取工艺为:超声波功率为249.50 W、酶解时间为3.83 h、料液比为1:25.87 g/mL,预期胶原蛋白肽得率为50.15%。考虑到实际工艺条件,将参数调整为:超声波功率250 W、酶解时间为4 h、料液比 1:26 g/mL。为了进一步验证模型的可靠性,在此条件下进行三次平行试验,胶原蛋白肽得率为49.24%±0.98%,与理论值较为接近,说明该响应面模型可用于优化无骨鸡爪胶原蛋白肽的提取。
2.5 pH 对无骨鸡爪胶原蛋白肽溶解度的影响
胶原蛋白肽溶解度是通过氮溶解指数来表示的,氮溶解指数(NSI)[27]是指在控制浸出条件下,蛋白质溶解在水中的氮占总氮的百分比,它是一个反映蛋白质水溶性大小的物理量。胶原蛋白是极其典型的两性聚电解质,pH 低于或高于等电点时,胶原蛋白将带一定电荷,即呈正离子或负离子状态,电荷互相排斥,分子分散性好,导致溶解度增高。溶液pH 偏离等电点越远,胶原蛋白所带净电荷越高,溶解度相应越高。在等电点时[28],胶原蛋白主要以两性离子状态存在,溶解度最低。在不同pH 下的溶解度差异很大,如果单一选定一个pH 值,则测得的值不准确,且不具备参考意义。图9 反映的是无骨鸡爪胶原蛋白肽在不同pH 下的溶解度,可得在pH 为4.0 时,溶解度最小;pH 为7.0 时,溶解度最大。胶原蛋白肽属于两性电解质,其溶解度大小和等电点密不可分[29],在等电点附近,胶原蛋白肽所带的静电荷几乎为零,分子间由于不存在静电斥力的作用,易于聚集沉降,因而溶解度较小;当所处pH 偏离等电点时,胶原蛋白肽带有一定量的静电荷,分子间存在静电斥力,倾向于分散,因而溶解度较大。无骨鸡爪胶原蛋白肽在pH4.0~5.0 之间有等电点,所以在pH 为4.0 时,其溶解度最小。随着酶解时间的增加,溶解度也在增长,这是由于经碱性蛋白酶水解后,大分子的蛋白质解链,变成多肽、短肽等,亲水性增加,从而溶解度增加[29]。
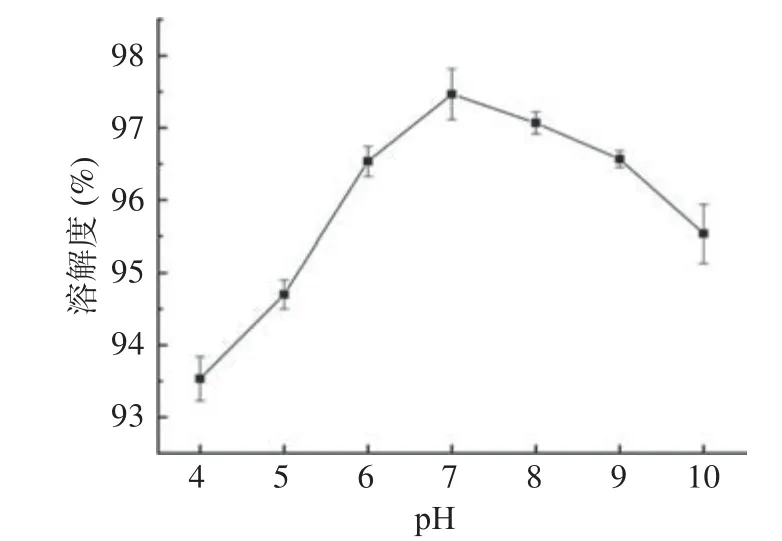
图9 pH 对无骨鸡爪胶原蛋白肽溶解度的影响Fig.9 Effect of pH on solubility of collagen peptide boneless chicken feet
3 结论
以胶原蛋白肽得率为考察对象,通过单因素实验和响应面优化试验,对无骨鸡爪胶原蛋白肽的提取工艺进行了优化,得到最佳提取工艺为:料液比为1:26 g/mL、超声波功率为250 W 和酶解时间为4 h。而影响无骨鸡爪胶原蛋白肽得率的三个因素影响程度大小顺序为料液比>酶解时间>超声功率,超声波辅助提取无骨鸡爪胶原蛋白肽得率可达49.24%±0.98%(占除杂后鸡爪干质量),符合响应面模型验证结果。
超声辅助碱性蛋白酶提取的无骨鸡爪胶原蛋白肽的溶解度在酶解时间4 h 时,可达到90%以上。经过响应面优化提取得到的无骨鸡爪高溶解度胶原蛋白肽可提高鸡爪的综合利用程度,提升鸡爪的潜在价值,为鸡爪的精深加工提供科学依据。
