冻融对冷藏藏羊肉保水性及蛋白氧化和溶解特性的影响
2021-10-29黄兰兰陈炼红蔡自建周昱宇王琳琳西南民族大学食品科学与技术学院四川成都610041
黄 倩,黄兰兰,陈炼红,蔡自建,周昱宇,毛 云,王琳琳(西南民族大学食品科学与技术学院,四川成都 610041)
欧拉藏羊肉产于高海拔无污染地区,营养物质丰富且味道鲜美,是纯天然绿色肉食品,近年来逐渐受到广大消费者的青睐[1]。冷冻技术是一种应用广泛、方便且有效的肉及其制品保藏方法,对于藏羊胴体的贮藏运输,冷冻技术具有较好的应用价值[2−3]。然而,因青藏高原藏区冷链运输技术不够完善,肉类在实际生产加工和冻藏运输过程中,温度波动较大,从而造成冷冻藏羊肉在运输和冻藏过程中经历冷冻-解冻反复冻融的循环过程,进而导致肌肉品质受到较大影响。
国内外研究结果表明,冷冻-解冻过程会导致肌肉变色、组织机械损伤和汁液流失加重[4],造成肌肉的新鲜度下降,同时也降低肌肉及其制品的商品价值。此外,冻融循环还会使蛋白质发生氧化变性和溶解度改变,最终使肌肉保水性下降[5]。Boonsumrej 等[6]发现,冷冻-解冻次数增加会导致虾肉的蛋白盐溶性减小、肌纤维之间的间隙增大、肌纤维发生弯曲甚至断裂,最终导致肌肉品质下降。同时,因温度波动变化引起的反复冻融会进一步引发一系列生理生化反应,进而影响肌肉品质[7]。李婉竹等[8]研究发现,冻融循环次数增多会加剧牦牛肉蛋白质的氧化程度,并导致肌肉保水性的显著下降。目前,关于反复冻融对宰后肌肉品质影响方面的研究主要集中在猪肉[9]、黄牛肉[10]、牦牛肉[8]、绵羊肉[11]、鸡肉[12]、兔肉[13]、鱼肉[14]等原料肉,而欧拉藏羊肉因其常年生活在高海拔缺氧地区,经过冻融循环处理后对其品质影响可能不同于上述种类肌肉,同时反复冻融处理对高原欧拉藏羊肉保水性影响方面的研究尚未见报道。因此,有必要开展反复冻融循环处理对藏羊肉在冷藏期内保水性及相关指标变化影响的研究,这对提高高原地区藏羊肉品质具有重要意义。
本文以经反复冻融处理后的冷藏藏羊肉背最长肌为研究对象,测定冷藏期内肌肉保水性(解冻损失、滴水损失、加压损失)、MP 氧化特性(羰基含量、总巯基含量、表面疏水性)、蛋白溶解度(全蛋白溶解度、MP 溶解度、肌浆蛋白溶解度)、肌纤维显微结构等指标,探究不同冻融循环次数对肌肉保水性、蛋白氧化和溶解性质以及肌肉显微结构的影响以及与保水性之间的关系,以期为青藏高原地区藏羊肉的加工利用提供理论参考。
1 材料与方法
1.1 材料与仪器
欧拉藏羊 广汉市盛大食品有限公司;多聚甲醛 国药集团化学试剂有限公司;磷酸钠、磷酸钾北京中杉金桥生物技术有限公司;甲醛、无水乙醇、氯化镁 成都海兴化工试剂厂;二甲苯 福晨(天津)化学试剂有限公司;苏木素染液、伊红染液 武汉赛维尔生物技术有限公司;碘化钾、硫酸铜、中性树胶、乙二胺四乙酸、2,4-二硝基苯肼、浓硫酸、三氯乙酸、乙酸乙酯、盐酸胍、2-硝基苯甲酸、尿素、溴酚蓝成都市科龙化工试剂厂(以上试剂均为分析纯)。
YYW-2 型电动应变式无侧限压力仪 南京土壤仪器有限公司;UV-6100 紫外分光光度计 上海美谱达仪器有限公司;转轮式切片机 德国徕卡仪器有限公司;TSJ-Ⅱ型全自动封闭式组织脱水机、BMJ-Ⅲ型包埋机、PHY-Ⅲ型病理组织漂烘仪 常州市中威电子仪器有限公司;BA400Digital 数码三目摄像显微镜 麦克奥迪实业集团有限公司;图像分析软件2020120148-19-Pro Plus 6.0 美国Media Cybernetics 公司。
1.2 实验设计
随机选取1~2 岁发育正常、健康无病、体重相近的欧拉藏羊,参考国内外对动物福利的相关要求,集中屠宰后45 min 内取背最长肌,4 ℃成熟5 d 后切分成块(质量100 g 左右),并将分割好的肉样随机分为4 组,第1 组不进行冻融处理(T0,对照组),其余3 组分别进行1 次(T1)、3 次(T3)、5 次(T5)冻融处理(−18 ℃冷冻12 h,4 ℃解冻12 h),用自封袋包装并手动挤压排出包装中的空气,然后将反复冻融处理后的肉样置于4 ℃条件下避光冷藏1、3、5、7 d,在相应时间点取样。
1.3 测定项目与方法
1.3.1 解冻损失的测定 参照文献[8]方法,将冻结肉样放在自然流通的空气中进行解冻。对解冻前的肉样进行准确称重(m1,g),然后用吸水纸擦去解冻后肉样表面的渗出液并准确称重(m2,g)。计算公式如下:

1.3.2 滴水损失的测定 将肉样切分成3 cm×2 cm×2 cm 左右大小的肉块,将肉块称重(m3,g)后用线固定并置于充气的保鲜袋中,保证肉样不与保鲜袋接触的情况下,置于4 ℃冰箱,隔24 h 取出后对肉样再次进行称重(m4,g)。计算公式如下:
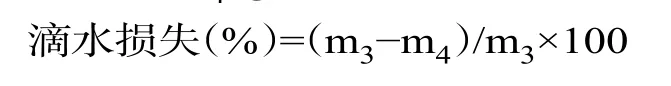
1.3.3 加压损失的测定 参照文献[8]方法。沿垂直肌纤维方向取圆形肉柱(1.0 cm 厚、横截面积为5 cm2),称重(m5,g)。用双层纱布包裹后再用定性滤纸包裹(上、下各16 层)。在无侧限压力仪上加压35.0 kg,保持5 min,去除滤纸和纱布后,再次称重(m6,g)。计算公式如下:

1.3.4 MP 提取 参考Park 等[15]的方法。准确称取2 g 切碎肉样,切碎后加入8 mL 缓冲盐溶液(0.1 mol/L NaCl、2 mmol/L MgCl2、10 mmol/L Na3PO4、1 mmol/L EGTA,pH7.0),匀浆后离心(4 ℃2000 r/min,15 min),对离心后所得沉淀重复洗涤和离心两次,再加入8 mL 0.1 mol/L NaCl 溶液洗涤和离心两次,用200 目的筛子在最后一次离心前对溶液进行过滤,用0.1 mol/L的HCl 将滤液pH 调至6.0,并用双缩脲法测定蛋白浓度。
1.3.5 羰基含量的测定 参考Levine 等[16]的方法。MP 溶液依照1.3.4 步骤提取并向0.5 mL MP 蛋白溶液中加入0.5 mL 含0.02 mol/L 2,4-二硝基苯肼的2 mol/L HCl 溶液,空白组也加入0.5 mL 2 mol/L HCl 溶液(不含2,4-二硝基苯肼),混匀后在25 ℃下反应40 min,再加入2 mL 三氯乙酸(质量分数20%),混匀后离心(4 ℃,11000 r/min,5 min),弃上清后,用1 mL 乙醇-乙酸乙酯溶液(1:1,v/v)对沉淀洗涤3 次,并用3 mL 6 mol/L 盐酸胍溶液对蛋白溶液进行悬浮并在37 ℃条件下水浴保温30 min 溶解沉淀,再将反应液10000 r/min 离心5 min 除去不溶物质,以空白组为对照,测定吸光度值(波长为370 nm)。计算公式如下:

式中,A 为370 nm 波长处的吸光度;n 为稀释倍数;ε为摩尔吸光系数22000,L/mol·cm−1,ρ 为蛋白质质量浓度,mg/mL。
1.3.6 总巯基含量的测定 参考Srinivasan 等[17]的方法。MP 溶液依照1.3.4 步骤提取并将其分散在25 mmol/L 磷酸钠缓冲液中(pH6.25),将蛋白溶液浓度调至2 mg/mL,取0.5 mL 稀释后的MP 溶液依次加入2 mL 尿素-SDS 溶液(含8.0 mol/L 尿素,30 g/L SDS,0.1 mol/L 磷酸钠缓冲液,pH7.40)和0.5 mL 10 mmol/L DTNB 试剂(溶解在0.1 mol/L,磷酸钠缓冲液中,pH7.40),空白组不含DTNB,室温下反应15 min 后,测定吸光度值(波长为412 nm)。计算公式如下:

式中,A 为412 nm 波长处的吸光度;n 为稀释倍数;ε为摩尔吸光系数11400,L/ mol·cm−1,ρ 为蛋白质质量浓度,mg/mL。
1.3.7 表面疏水性的测定 参考Chelh 等[18]的方法。MP 溶液依照1.3.4 步骤提取并用磷酸盐缓冲液(pH7.40)将其浓度调至5 mg/mL,向1 mL 上述蛋白溶液中加入200 μL 1 mg/mL 溴酚蓝溶液后进行离心处理(6000 r/min,15 min),并对上清液进行10 倍稀释,以无MP的磷酸盐溶液为空白对照,测定吸光度值(波长为595 nm)。以溴酚蓝结合量来表示表面疏水性,计算公式如下:

式中,A1为空白对照组溴酚蓝吸光值;A2为样品吸光值。
1.3.8 蛋白溶解度的测定 蛋白溶解度的测定参照Joo 等[19]的方法。肌浆蛋白溶解度:1.0 g 肉样中加入10 mL 磷酸钾缓冲液(0.025 mol/L,pH7.20),冰上匀浆后4 ℃摇动抽提12 h,然后对抽提液进行离心处理(1500 r/min,20 min),用双缩脲法测定其蛋白含量。总蛋白质溶解度:1.0 g 肉样中加入20 mL 磷酸钾缓冲液(0.1 mol/L,1.1 mol/L 碘化钾,pH7.20),冰上匀浆后4 ℃摇动抽提12 h,然后对抽提液进行离心处理(1500 r/min,20 min),用双缩脲法测定其蛋白含量,以全蛋白溶解度和肌浆蛋白溶解度之间的差值表示MP 溶解度。
MP 溶解度(mg/g)=全蛋白溶解度(mg/g)−肌浆蛋白溶解度(mg/g)
1.3.9 肌肉显微结构观察 取经冻融循环处理的肉样去除脂肪和筋膜后沿肌肉纹理切割成边长约0.5 cm 大小的正方体块,置于10%的甲醛溶液中进行固定,并依次经过75%、85%、95%Ⅰ、95%Ⅱ、100%Ⅰ、100%Ⅱ的乙醇溶液进行脱水处理,并用二甲苯Ⅰ、二甲苯Ⅱ溶液浸泡至透明,用石蜡进行包埋。冷却后用切片机切成连续成蜡带状且厚度约为6 μm的薄片,切好的薄片置于载玻片上并在45 ℃条件下恒温烘干,并采用HE 染色法进行染色,并用BA400 Digital 数码三目摄像显微摄像系统对切片进行图像采集,每张切片先于40 倍下观察全部组织,观察整体情况,选择要观察的区域采集400 倍图片。
1.4 数据处理
用Microsoft 2016 Excel 对数据进行整理,用SPSS19.0 软件对试验数据进行方差分析和Duncan’s多重比较,用Origin 软件作图。每个试验重复测定三次。
2 结果与分析
2.1 冻融循环次数对藏羊肉保水性的影响
由表1 可知,解冻损失率随冻融循环次数的增加显著上升;T5 组较T3 组相比,其解冻损失率在1~7 d 分别显著增加了63.08%、43.20%、20.58%、16.20%(P<0.05),此研究结果与文献[8]一致,原因在于反复冻结-解冻过程使肌肉组织内部的水分会冻结形成不规则冰晶,加之其所产生的压力也会导致细胞膜的破裂和细胞器的损伤,因而在解冻后会产生大量的汁液流失,导致肌肉保水性下降[20];同时,T0~T5组解冻损失率随冷藏时间延长也整体显著上升(P<0.05);冷藏7 d 时,4 组肌肉的解冻损失率均达到最大值,尤其冻融循环次数越多,冷藏时间越长,肌肉的解冻损失越严重,保水性越差,可能由于反复冻融引起重结晶现象发生,所形成的冰晶数量少且体积大,对细胞结构损伤较重,且此过程持续时间越长对细胞组织结构的损伤就越严重;同时因自由基等促氧化分子的攻击作用所造成的蛋白质氧化程度也在逐渐加重,最终导致解冻损失增加,肌肉的保水性不断下降。

表1 冻融循环次数对藏羊肉冷藏过程中保水性的影响Table 1 Effect of freezing-thawing cycle times on water holding capacity of Tibetan sheep meat during chilled storage
由表1 可知,滴水损失也随冻融循环次数的增加显著上升,在贮藏期间T5 组较T0 组相比,其滴水损失率分别显著增加了29.16%、21.09%、22.16%、25.47%(P<0.05);同时,随冷藏时间延长,T0~T5 组肌肉的滴水损失率呈先上升后下降变化,并在冷藏3 d 时达到最大值,随后下降,此研究结果与肌肉在自然成熟过程中的滴水损失变化规律不尽一致[21],原因可能是所用实验材料种类及前期处理方式不同。以上结果说明,反复冻融处理和冷藏过程均会降低肌肉的保水性,此研究结果与前人报道结果相类似[22−23]。
由表1 所示,加压损失随冻融循环次数增加呈先上升后下降变化,并在冻融循环3 次后达到最大值;在贮藏期间T3 组和T0 组相比,其加压损失率分别显著增加了23.76%、20.45%、21.17%、20.15%(P<0.05);冻融循环5 次后加压损失变化缓慢,T5 组和T3 组相比,加压损失无显著差异(P>0.05),此研究结果与文献[24]报道相一致,可能因冻融循环次数的增加,而导致肌肉水分丢失达到饱和,从而使冻融循环5 次后的加压损失有所降低;同时,随冷藏时间延长,T0~T5 组的加压损失率呈先上升后下降变化(P<0.05),说明加压损失除了受到冻融循环次数的影响,还受到冷藏过程的影响,此过程中肌肉内部发生的多种复杂的生理生化反应,导致与保水性相关的蛋白的亲水性下降,加之冰晶对也肌肉细胞和组织有一定的损伤作用,最终导致肌肉保水性下降。
2.2 冻融循环次数对藏羊肉MP 氧化特性的影响
2.2.1 冻融循环次数对藏羊肉MP 羰基含量的影响 羰基含量是评价蛋白氧化发生程度的代表性指标[25]。由图1-a 可知,不同冷藏时间点肌肉羰基含量随冻融循环次数的增加呈上升变化,T5 组和T0 组相比,在贮藏期间其羰基含量分别显著增加了64.52%、50.68%、36.32%、35.85%(P<0.05),此结果与前人报道相一致,均说明冻融循环次数越多越易造成MP的氧化损伤,造成上述结果的原因可能是冻融循环次数的增加进一步加剧了蛋白质侧链氨基酸发生脱氨反应并向羰基转化[8];同时,肌肉在反复冻融过程中,机体组织因受到损伤而导致内平衡逐渐丧失,抗氧化体系逐渐崩溃,自由基等促氧化成分含量急剧上升并对蛋白质分子进行攻击,导致蛋白羰基含量进一步增加[26]。不同冻融循环处理组羰基含量也随冷藏时间延长而上升,李梦琪等[1]研究也得到类似结论;冷藏7 d 时,与冷藏1 d 相比不同冻融循环处理组羰基含量分别显著上升了47.42%、31.66%、18.35%、21.73%(P<0.05),说明宰后冷藏过程也会加剧藏羊肉MP的氧化,但在后期羰基含量变化趋于缓慢。
蛋白质中的半胱氨酸残基中的巯基(-SH)是自由基攻击的主要对象,巯基含量也常被作为蛋白质氧化程度的另一重要评价指标[27]。由图1-b 可知,不同冷藏时间点肌肉MP 总巯基含量均随冻融循环次数的增加而减少;T1 组与T0 组样品总巯基含量差异不显著(P>0.05),T5 组总巯基含量均达到最小值,且T5 组和T0 组相比,总巯基含量分别显著下降了22.14%、23.35%、26.65%、24.43%(P<0.05);同时,随冷藏时间延长,不同冻融循环处理组总巯基含量也呈下降变化,冷藏7 d 时,与冷藏1 d 相比不同冻融循环组总巯基含量显著下降,为31.54%、34.83%、36.59%、33.56%(P<0.05),说明宰后冷藏过程会加剧MP的氧化作用,但在冷藏后期总巯基含量的变化趋于缓慢。同时,本文研究结果与文献报道的有关冻融循环对牦牛肉保水性及蛋白氧化和溶解特性方面的结果相类似[8],但各指标数据与本文有所区别,原因可能是虽然牦牛和藏羊的生存环境相似,但因物种间的差异性导致了数据结果的不同。

图1 冻融循环次数对藏羊肉MP 蛋白氧化特性的影响Fig.1 Effect of freezing-thawing cycle times on myofibril oxidation characteristics of Tibetan sheep meat during chilled storage
蛋白表面疏水性指数反映了蛋白质结合水的能力,蛋白表面疏水性指数越高,说明蛋白质与水的结合能力就越差[28]。由图1-c 可知,不同冷藏时间点肌肉MP 表面疏水性均随冻融循环次数的增加呈上升变化;经5 次冻融循环后表面疏水性均达到最大值,且T5 组和T0 组相比,其表面疏水性分别显著上升了39.54%、42.19%、32.02%、20.67%;同时,不同冻融循环处理组表面疏水性随冷藏时间延长也呈上升变化,且在冷藏7 d 时达到最大值,分别显著上升了64.38%、59.20%、47.21%、42.15%(P<0.05),说明冻融循环次数和冷藏过程均能影响MP的表面疏水性,原因可能是在冻融处理和冷藏过程中蛋白质的天然构象发生改变,蛋白质解折叠,使一些疏水性的脂肪族与芳香族氨基酸侧链基团从蛋白分子内部暴露,促进蛋白折叠的发生,从而导致表面疏水性的增加[8]。
2.3 冻融循环次数对藏羊肉蛋白溶解度的影响
宰后肌肉蛋白质的溶解度与肌肉的持水性和质地密切相关[29]。由图2-a 可知,在不同冷藏时间点肌肉的全蛋白溶解度均随冻融循环次数的增加呈显著降低(P<0.05);经5 次冻融循环后全蛋白溶解度均达到最小值,且T5 组和T0 组相比,全蛋白溶解度分别下降了31.35%、29.95%、29.65%、28.13%;同时,随冷藏时间延长,不同冻融循环处理组全蛋白溶解度呈上升变化,不同冻融循环组全蛋白溶解度分别显著上升了11.50%、17.53%、14.49%、16.72%(P<0.05)。以上结果说明,经反复冻融处理后随冻融次数增加全蛋白溶解度显著下降,原因可能是随着冻融循环次数的增加,蛋白质分子之间发生聚合、交联、断裂等氧化过程,使得基质蛋白类不稳定从而导致蛋白质溶解度的下降[22]。
如图2-b 所示,在不同冷藏时间点肌肉的MP 溶解度随冻融循环次数的增加也呈显著下降(P<0.05),原因在于冻结过程中MP 中的部分结合水所形成的冰晶,使得肌动球蛋白分子之间因相互形成的非共价键作用形成超大分子的不溶性凝集体,从而使MP 含量下降,此结果与文献报道相一致[8,29];同时,不同冻融循环处理组MP 溶解度随冷藏时间的延长呈先下降后上升变化,并在冷藏3 d 时达到最低值,T0~T5 分别为94.16、80.31、64.49、56.51 mg/g,可能因在宰后冷藏初期,MP 氧化后会使其天然构象发生改变,使原分子内的疏水基团暴露,产生的疏水相互作用使蛋白质分子间进一步发生聚集,进而造成MP 溶解度的下降;同时,因蛋白质被一定程度地温和氧化而交联形成的聚合物为可溶性的低聚体,而在冷藏后期MP 溶解度会有所回升[30]。
由图2-c 可知,不同冷藏时间点肌浆蛋白溶解度随冻融循环次数增加而下降,T5 组和T0 组相比,肌浆蛋白溶解度在贮藏期间分别下降了18.16%、17.03%、18.89%、21.01%,肌浆蛋白的减少可能是由于冻循环过程中,汁液损失的不断增加;同时,不同冻融循环处理组肌浆蛋白溶解度随冷藏时间延长呈先上升后下降变化,并在冷藏3 d 时达到峰值,分别为73.17、70.66、65.70、60.71 mg/g。综上所述,在反复冻融循环过程中,3 种蛋白质溶解度均随冻融循环次数的增加显著下降(P<0.05),这与肌肉保水性指标变化一致。

图2 冻融循环次数对藏羊肉蛋白溶解度的影响Fig.2 Effect of freezing-thawing cycle times on protein solubility of Tibetan sheep meat during chilled storage
2.4 冻融循环次数与各指标相关性分析
由表2 可知,冻融循环次数与保水性3 个评价指标均呈极显著正相关(P<0.01),说明冻融循环次数的增加对肌肉保水性下降有直接影响;冻融循环次数与蛋白氧化程度和蛋白溶解度之间也呈极显著相关性(P<0.01),说明冻融循环在影响肌肉保水性的同时,还对肌肉内部的化学变化产生一定影响,并可能因此影响了蛋白质的溶解性;羰基含量和保水性3 个评价指标之间均呈极显著正相关性,总巯基含量、表面疏水性与解冻损失和加压损失之间的相关性也极显著(P<0.01),说明冻融循环次数的增加导致的MP的交联、聚集和变性均会影响肌肉的保水性;同时,全蛋白溶解度、MP 溶解度与保水性3 个评价指标之间均呈极显著相关性,且肌浆蛋白与解冻损失之间也呈极显著相关(P<0.01),进一步说明冻融循环次数的增加所造成的蛋白质溶解度的下降最终弱化了肌肉组织对水分的吸收能力,导致肌肉保水性下降。

表2 冻融循环次数与各指标相关性分析Table 2 Correlation analysis between freezing-thawing cycle times and each indicator
2.5 冻融循环次数对藏羊肉肌纤维显微结构的影响
由图3 所示,T0 组肌肉组织结构较致密均匀,肌纤维较为饱满且完整性较好,肌纤维横断面呈圆形或多边形,细胞核围绕在肌纤维周边且数量较多,肌纤维间的空隙很小;随着冷藏时间的延长,T0 组肌纤维间隙逐渐增大,冷藏7 d 后细胞核体积增大数量减少,部分细胞发生溶解。与T0 组相比,不同冷藏时间点T1 组、T3 组和T5 组肌纤维之间的间隙逐渐增大,肌纤维逐渐出现分散状态,肌肉组织结构的致密性和均匀性均呈下降变化,细胞边缘发生溶解,细胞核不断减少并与肌细胞分离;冻融循环5 次后,肌纤维组织结构破坏更加严重,肌纤维溶解加重,细胞间隙较大。同时,在冷藏1~7 d 过程中,不同冻融处理组肌肉显微结构变化也较为明显,尤其7 d 时,T0~T5 组肌纤维之间的间隙均达到最大,肌肉组织结构的致密性和均匀性最差,细胞核数量与1 d 时相比明显减少,肌细胞结构破坏最为严重,肌肉组织中出现大小不等的空泡且肌束间的平行排列受到较大程度破坏,此变化与肌肉保水性的变化整体呈正相关关系,说明冻融循环过程非常不利于肌肉保水性的维持,且冻融循环次数越多肌肉保水性越差,上述研究结果与国内外学者的研究结果相一致[7−8,20]。

图3 冻融循环次数对藏羊肉肌纤维显微结构的影响Fig.3 Effect of freezing-thawing cycle times on muscle fiber microstructure of Tibetan sheep meat
3 结论
冻融循环次数的增加对冷藏过程中藏羊肉保水性有较大影响,表现为反复冻融显著加剧了肌肉蛋白质的氧化程度,导致蛋白质生化特性发生改变而进一步降低肌肉保水性,肌纤维显微结构损伤程度也随冻融循环次数的增加而加重;同时,冷藏时间的延长也会进一步加重反复冻融处理肌肉保水性品质的下降。本文研究结果与前人研究的反复冻融处理对其他种类肌肉保水性及蛋白氧化和溶解特性影响的结论相类似,但因原料肉种类及前期处理方式的不同个别指标的变化存在一定差异,且反复冻融对肌肉保水性的影响除通过影响蛋白氧化特性外,是否还通过影响脂质氧化、肌纤维蛋白降解等其他生化机制有待进一步研究。综上所述,冻融循环次数越多,肌肉蛋白氧化程度和肌纤维显微结构破坏越严重、蛋白溶解度越低,越不利于维持肌肉的保水性。因此控制和避免藏羊肉在贮运和销售过程中的反复冻融对维持肌肉品质具有重要作用。
