抑制瞬时感受器电位香草素受体亚家族Ⅳ型通道对大鼠视网膜缺血-再灌注损伤后细胞凋亡与新生血管生成的作用▲
2021-10-27齐新刚顾永欣
齐新刚 顾永欣 肖 云 杜 雷
(1 中国人民解放军新疆军区总医院北京路医疗区全军眼科中心,乌鲁木齐市 830013,电子邮箱:qx98210@163.com;2 新疆医科大学基础医学院,乌鲁木齐市 830011)
视网膜缺血-再灌注损伤(retinal ischemia-reperfusion injury,RIRI)是眼科视网膜疾病中一种较为常见的病理过程,主要发生在青光眼、糖尿病性视网膜病变和视网膜血管疾病等有关疾病中,RIRI是导致视力障碍或失明的主要原因[1-2]。研究表明,RIRI可能与众多因素密切相关,例如氧自由基损伤、细胞内钙超载及细胞凋亡,最终导致视功能障碍[3]。因此,有必要探讨其有效的防治措施。
瞬时感受器电位香草素受体亚家族Ⅳ型(transient receptor potential vanilloid 4,TRPV4)是一种在生物体内普遍表达的非选择性阳离子通道,作为瞬时感受器电位(transient receptor potential,TRP)通道家族成员之一,TRPV4通道可被包括低渗、温度、pH和户外紫外线辐射等一系列刺激所激活[4]。目前,已有研究证明TRPV4参与调节多个细胞内信号传导途径和病理生理过程,例如TRPV4通道拮抗剂HC-067047可在口腔、内脏和神经性疼痛疾病中起到镇痛作用[5],并具有减轻肺损伤和神经元损伤的作用[6-7]。本研究探讨TRPV4通道拮抗剂HC-067047对RIRI后视网膜细胞凋亡和新生血管形成的作用,以期进一步阐明其在RIRI中的作用机制。
1 材料与方法
1.1 材料 实验动物为清洁级雄性SD大鼠30只,4周龄,体质量 180~220 g,购自新疆医科大学实验动物中心[合格证号:SCXK(新)2018-0002]。主要试剂:TRPV4抑制剂HC-067047(英国Abcam公司,批号:ab145868),苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒(北京百奥莱博公司,批号:YT165),脱氧核苷酸末端转移酶介导的dUTP 缺口末端标记(terminal deoxynucleotidyl transferase-mediated dUTP nick end labeling,TUNEL)凋亡检测试剂盒与免疫组化试剂盒(北京中杉生物公司,批号:ZK8005、ZK9600),TRIzol试剂(美国Invitrogen公司,批号:15596-018)、Prime ScriptTMRT试剂盒与SYBR Premix Ex TaqTMPCR试剂盒(日本TaKaRa公司,批号:RR047A、RR420A),二喹啉甲酸(bicinchoninic acid,BCA)蛋白浓度测定试剂盒、RIPA裂解缓冲液与ECL化学发光液(上海碧云天生物研究所,批号:P0012S、P0013C、P0018S),兔抗大鼠血管内皮生长因子(vascular endothelial growth factor,VEGF)、色素上皮衍生因子(pigment epithelium-derived factor,PEDF)、胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)抗体(美国Santa Cruz公司,批号:SC-7269、SC-390172、SC-33673),兔抗大鼠半胱氨酸天冬氨酸蛋白酶(cysteinyl aspartate specific proteinase,Caspase)-3、B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)及辣根过氧化物酶标记的羊抗兔IgG抗体(美国Abcam 公司,批号:ab32351、ab32124、ab182733、ab181602、ab205718)。
1.2 方法
1.2.1 大鼠RIRI模型的建立:采用大鼠眼球前房内灌注生理盐水法建立大鼠RIRI模型[8]。大鼠腹腔注射戊巴比妥钠(100 mg/kg)全身麻醉后,将大鼠侧卧位放置并固定在固定板上,在右眼球上滴加托吡卡胺滴眼液。使用27 G针头连接生理盐水输液袋,打开输液袋阀门通道,将针尖自大鼠右眼虹膜边缘缓缓刺入前房,待前房充入生理盐水胀大后继续进针,以与右眼虹膜呈45°夹角进针刺破角膜,操作过程中避免损伤虹膜与晶状体,固定针头方向,并缓慢松开输液袋导管夹,使前房内压力达到 110 mmHg(1 mmHg=0.133 kPa)。采用检眼镜观察大鼠眼睛,见眼底苍白、水肿且前房变深即为造模成功。持续60 min后关闭输液阀门通道,拔出针头,在眼球表面涂抹红霉素眼膏防止眼球感染。
1.2.2 大鼠分组、给药及处理:采用随机数字表法将30只SD大鼠分为3组:对照组、RIRI组和RIRI+HC-067047组,每组10只。RIRI组和RIRI+HC-067047组大鼠按照1.2.1的方法进行RIRI造模,RIRI+HC-067047组大鼠分别在造模后5 h、10 h通过侧脑室注射HC-067047(5 μmol/μL)2 μL,对照组和RIRI组大鼠同时给予同等剂量的生理盐水。分别记录3组大鼠在治疗后第7天、第14天与第21天的体质量。造模与治疗过程中无大鼠死亡。在饲养第 21 天时处死所有大鼠,迅速取出大鼠右眼球视网膜组织,一部分置于4%多聚甲醛液中固定,一部分在液氮中冷冻后保存于-80℃冰箱。
1.2.3 HE染色观察大鼠视网膜组织形态变化:取出固定于4%多聚甲醛液中的各组大鼠视网膜组织,磷酸缓冲盐溶液冲洗后使用梯度酒精脱水,石蜡包埋,并切成厚度约为4 μm的薄片,脱蜡至水后,苏木精染色5 min,流水冲洗3次,5 min/次,伊红染色液染色3 min,经酒精脱水、二甲苯透明后,中性树胶封片,在WMS-1033光学显微镜(上海豫光仪器)200倍下观察图像并拍照分析。
1.2.4 TUNEL染色检测大鼠视网膜神经节细胞凋亡情况:将大鼠视网膜组织石蜡切片置于60℃下烤片2 h脱蜡,加入20 μg/mL不含DNase的蛋白酶K,室温孵育30 min,然后加入50 μL TUNEL检测液,在37℃下孵育1 h,再加入50 mL过氧化物酶转化剂37℃孵育30 min,磷酸缓冲盐溶液冲洗3次,5 min/次,滴加4′,6-二脒基-2-苯基吲哚染液(博士德生物工程有限公司,批号:AR1177),室温避光孵育10 min,中性树胶封片,于光学显微镜下随机选择5个高倍(×100)视野,计数1 000个细胞中TUNEL阳性细胞数,阳性细胞数占总细胞数的百分比为凋亡指数。TUNEL染色阳性表现为视网膜组织阳性凋亡细胞的细胞核固缩,染色呈绿色。
1.2.5 免疫组织化学染色检测Caspase-3、VEGF蛋白阳性表达情况:将大鼠视网膜组织石蜡切片脱蜡至水,将柠檬酸钠修复液稀释50倍,取50 mL加热至95℃,浸入切片进行组织抗原修复,3% H2O2中孵育10 min以封闭内源性过氧化物酶活性,将山羊血清封闭原液用磷酸缓冲盐溶液稀释,配制成10%工作液,直接滴在组织切片上,在37℃下孵育1 h,滴加兔抗大鼠Caspase-3(1∶1 000)、VEGF(1∶500)4℃孵育过夜。次日,采用磷酸缓冲盐溶液洗涤3次,5 min/次,在室温下与辣根酶标记链霉卵白素(美国EarthOx公司,批号:E030100)孵育1 h。用磷酸缓冲盐溶液再次冲洗3次,5 min/次,滴加二氨基联苯胺染色,苏木精复染,使用二甲苯透明,中性树胶封片,在光学显微镜下观察图像,阳性细胞呈褐色至棕褐色,随机选择5个高倍(×100)视野,计数100个细胞中的阳性细胞数,阳性率为阳性细胞数占总细胞数的百分比。
1.2.6 实时荧光定量PCR法检测各组大鼠视网膜组织中VEGF、核因子E2相关因子2、缺氧诱导因子1-α mRNA的表达水平:使用TRIzol试剂提取大鼠视网膜组织总RNA。通过Prime ScriptTMRT试剂盒反转录合成cDNA。以cDNA为底物进行实时荧光定量PCR 扩增,根据SYBR Premix ExTaqTMPCR试剂盒说明书进行操作,内参基因为GAPDH。PCR扩增体系为cDNA 2 μL,上下游引物各1 μL,SYBR Premix Ex Taq Ⅱ 12.5 μL,无酶水8.5 μL。扩增条件为95℃,10 min;在以下参数下进行40个循环:95℃ 30 s,56℃ 30 s,72℃ 1 min。各基因引物序列由上海生工生物有限公司合成。引物序列如下:VEGF上游引物:5′-GGCGAGGCAGCTTGAGTTAC-3′,下游引物:5′-CTGTCGACGGTGACGATGGT-3′;核因子E2相关因子2(nuclear factor E2 related factor 2,Nrf2)上游引物:5′-CCTTCCTCTGCTGCCATTAGT-3′,下游引物:5′-CCTTCCTCTGCTGCCATTAGT-3′;缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)上游引物:5′-CGCGAACGACAAGAAAAAGGC-3′,下游引物:5′-CGTATATAAAGATGCGAACTCAC-3′;GAPDH上游引物:5′-GTATGACTCCACTCACGGCA-3′,下游引物:5′-CTCGCTCCTGGAAGATGGT-3′。采用2-ΔΔCt法计算各基因mRNA的相对表达水平。
1.2.7 蛋白质免疫印迹法检测各组大鼠视网膜组织中PEDF、GFAP、Caspase-3、Bax及Bcl-2蛋白表达水平:取出在液氮中冷冻后置于-80℃冰箱保存的大鼠视网膜组织,剪碎后加入RIPA 裂解缓冲液提取总蛋白,使用BCA试剂盒检测蛋白浓度。以50 μg蛋白加样后,通过10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离蛋白质,电转印至硝酸纤维素膜上。5%脱脂奶粉室温封闭2 h,TBST洗膜3次,5 min/次。加入稀释后的兔抗大鼠PEDF(1∶5 000)、GFAP(1∶5 000)、Caspase-3(1∶5 000)、Bax(1∶5 000)及Bcl-2(1∶5 000)为一抗,以GAPDH为内参,4℃下孵育过夜。TBST洗膜3次,5 min/次,加入辣根过氧化物酶标记的二抗(1∶5 000),室温下孵育1 h,TBST洗膜3次,5 min/次,滴加ECL化学发光液显色曝光,采用凝胶成像系统拍照,采用Image-Pro Plus图像分析系统对蛋白条带进行分析。
1.3 统计学分析 采用SPSS 20.0软件进行统计学分析,计量资料以(x±s)表示,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P<0.05表示差异具有统计学意义。
2 结 果
2.1 各组大鼠不同时间点体质量的比较 实验前以及治疗后第7、14天,三组的大鼠体质量差异均无统计学意义(均P>0.05);治疗后第21天,RIRI组大鼠体质量低于对照组(P<0.05)。见表1。
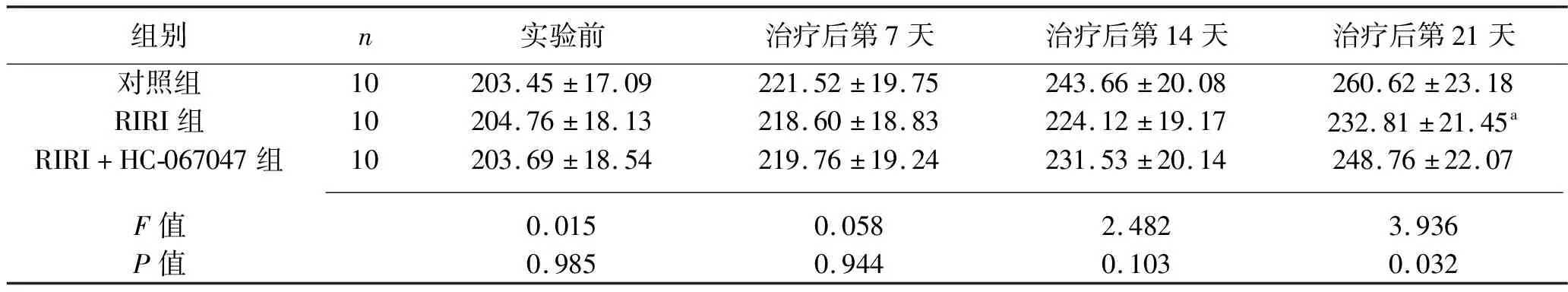
表1 各组大鼠不同时间点体质量的比较(x±s,g)
2.2 各组大鼠视网膜病理组织学观察 对照组大鼠视网膜组织结构清楚、各层细胞排列整齐;RIRI组大鼠视网膜组织各层细胞排列杂乱;RIRI+HC-067047组大鼠视网膜厚度增加,视网膜内各层细胞排列趋于规则。见图1。
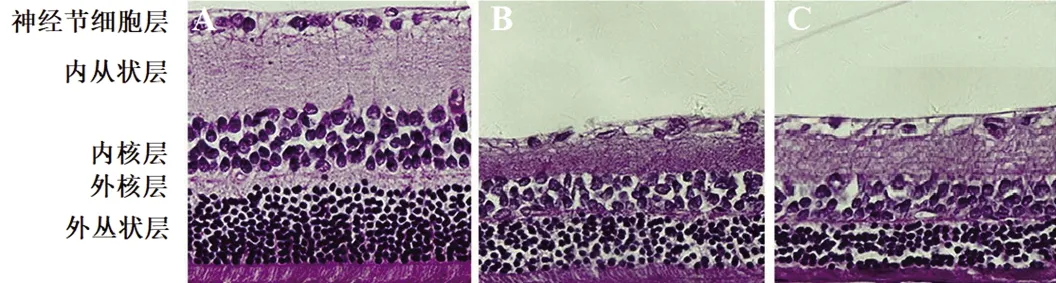
图1 各组大鼠视网膜病理组织学图像(HE染色,×200)
2.3 各组大鼠视网膜神经细胞凋亡情况 对照组大鼠视网膜几乎无TUNEL阳性细胞,RIRI组大鼠视网膜出现较多TUNEL阳性细胞,RIRI+HC-067047组大鼠视网膜有少量TUNEL阳性细胞,见图2。RIRI组和RIRI+HC-067047组细胞凋亡指数均高于对照组,但RIRI+HC-067047组细胞凋亡指数低于RIRI组(P<0.05),见表2。
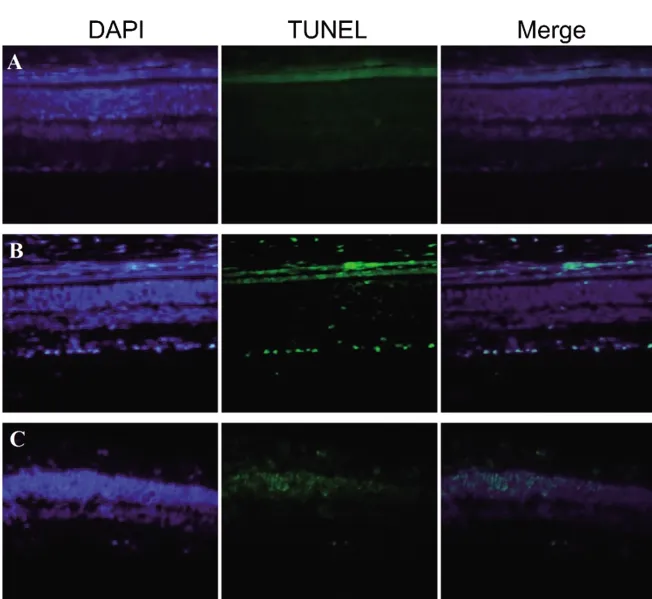
图2 各组大鼠视网膜神经细胞凋亡情况(TUNEL染色,×100)
2.4 各组大鼠视网膜组织Caspase-3、VEGF蛋白阳性表达情况 RIRI组和RIRI+HC-067047组大鼠视网膜组织中Caspase-3、VEGF蛋白阳性表达率均高于对照组,但RIRI+HC-067047组的Caspase-3、VEGF蛋白阳性表达率低于RIRI组(P<0.05)。见表2、图3、图4。
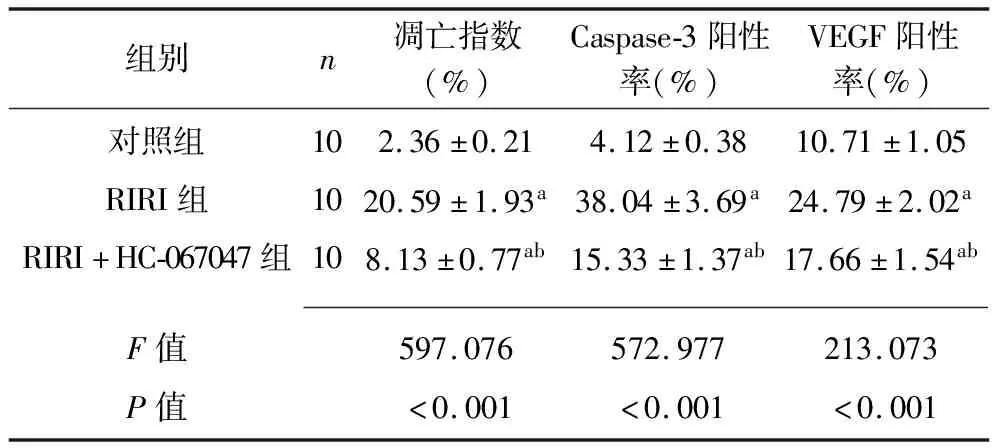
表2 各组大鼠视网膜组织神经细胞凋亡指数、Caspase-3与VEGF蛋白阳性表达情况的比较(x±s)
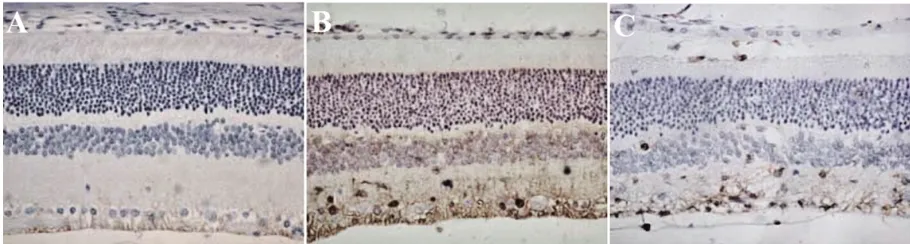
图3 各组大鼠视网膜组织Caspase-3表达检测(免疫组织化学染色,×100)

图4 各组大鼠视网膜组织VEGF表达检测(免疫组织化学染色,×100)
2.5 各组大鼠视网膜组织中Nrf2、VEGF、HIF-1α mRNA相对表达水平的比较 RIRI组和RIRI+HC-067047组大鼠视网膜组织中Nrf2、VEGF、HIF-1α mRNA相对表达水平均高于对照组,而RIRI+HC-067047组大鼠视网膜组织中Nrf2、VEGF、HIF-1α mRNA相对表达水平低于RIRI组(P<0.05),见表3。
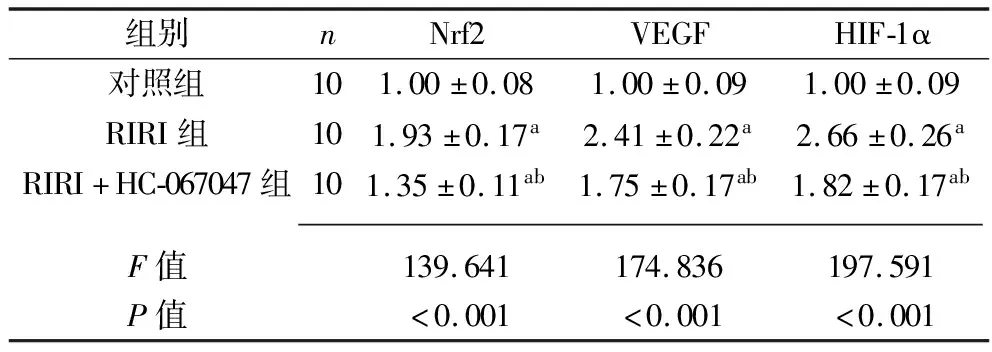
表3 3组大鼠视网膜组织中Nrf2、VEGF、HIF-1α mRNA相对表达水平的比较(x±s)
2.6 各组大鼠视网膜组织中PEDF、GFAP、Caspase-3、Bax、Bcl-2蛋白表达水平的比较 RIRI组和RIRI+HC-067047组大鼠视网膜组织中PEDF、Bcl-2蛋白表达水平较对照组下降,GFAP、Caspase-3、Bax蛋白表达水平较对照组升高(P<0.05);与RIRI组比较,RIRI+HC-067047组中PEDF、Bcl-2蛋白表达水平升高,GFAP、Caspase-3、Bax蛋白表达水平下降(P<0.05),见图5与表4。
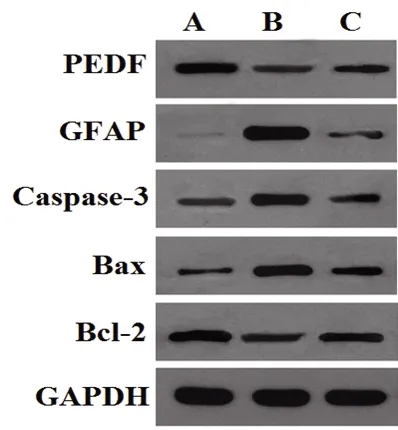
图5 各组大鼠视网膜组织中PEDF、GFAP、Caspase-3、Bax及Bcl-2蛋白表达检测
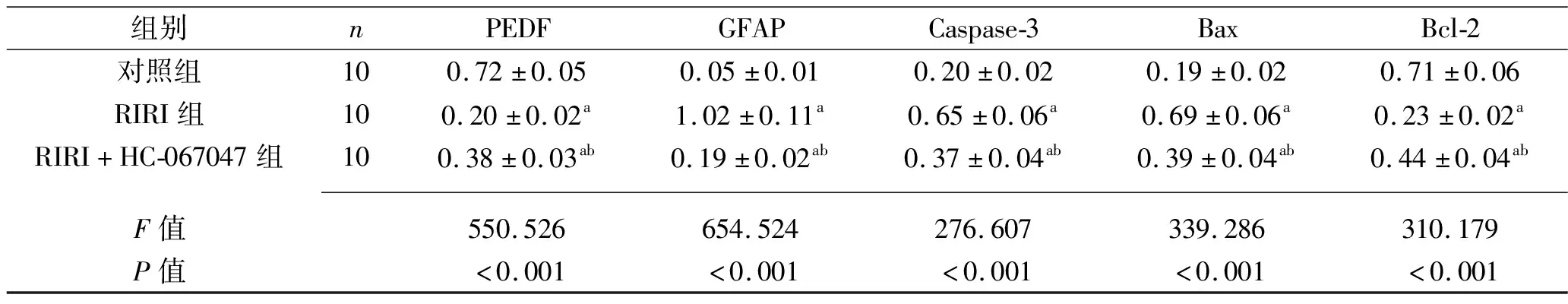
表4 3组大鼠视网膜组织中PEDF、GFAP、Caspase-3、Bax及Bcl-2蛋白相对表达水平的比较(x±s)
3 讨 论
RIRI是常见的眼科临床疾病,主要发生在视网膜内侧。视网膜缺血是由于视网膜血液供应减少而导致氧气和其他营养元素向视网膜内部层输送减少所致,缺血后血液的再灌注与氧化应激、炎症反应等密切相关[9-10]。RIRI可引起神经元损失、视网膜形态变性以及视网膜功能的丧失,最终将会导致失明。急性高眼压时视网膜氧分压降低,且缺血缺氧会导致视网膜病理学改变与一系列的代谢障碍[11]。本研究运用前房生理盐水灌注法来构建大鼠RIRI模型,观察发现RIRI组大鼠视网膜组织结构发生明显的变化,各层细胞排列杂乱,且视网膜神经纤维层较正常大鼠变薄。此外,体质量可反映或长或短时间内营养状况的变化,它能评价体内的营养情况,尤其是放映能量的摄取与消耗是否平衡以及脂肪在体内的增加或减少的一个重要指标,也是反映疾病严重程度和预后的一个重要指标。本研究结果显示,治疗后第21天,RIRI大鼠的体质量较对照大鼠降低,提示大鼠体内出现了病变。
TRP通路包含大量阳离子通道,大部分可渗透Ca2+,类香草素受体为TRP亚家族之一,由TRPV1、TRPV2、TRPV3、TRPV4、TRPV5和TRPV6组成[12]。已有研究表明,TRPV4通道激活可引起Ca2+内流,在脑缺血再灌注损伤中具有至关重要的作用[13]。在本研究中,给予RIRI大鼠TRPV4抑制剂HC067047干预后,大鼠视网膜组织病理变化明显减轻,推测抑制TRPV4通道可能可以减轻 RIRI大鼠视网膜损伤。
RIRI引起代谢紊乱、能量消耗和一系列后续反应,例如自由基产生、线粒体功能障碍、炎症反应、钙蛋白酶和半胱天冬酶的活化,导致视网膜细胞凋亡[14]。作为细胞凋亡的经典途径,Caspase-3是Caspases的主要效应物,是细胞凋亡的关键执行蛋白。本研究结果显示,治疗后第21天,RIRI大鼠视网膜中TUNEL 阳性细胞增加,促凋亡蛋白Caspase-3和Bax表达增加,而抑凋亡蛋白Bcl-2表达减少(P<0.05)。经过HC067047干预后,RIRI大鼠视网膜中TUNEL阳性细胞数目明显减少,Caspase-3和Bax表达减少,Bcl-2表达增加(P<0.05)。说明抑制TRPV4通道可减少RIRI大鼠视网膜细胞凋亡,从而发挥保护视网膜的作用。
血管新生是一个多因子参与的复杂生理与病理过程,涉及多个信号通路之间的相互作用。在RIRI过程中,血管网向外不断延伸,血管通透性改变,导致血浆发生渗漏,玻璃体后皮质与视网膜分离,对视觉功能产生严重影响[15]。因此,视网膜新生血管形成是RIRI损伤的重要表现。VEGF和PEDF分别具有促进新生血管形成和抑制新生血管形成的作用[16],两者表达平衡对RIRI至关重要。GFAP 为中间丝骨架蛋白,对视网膜细胞胶质增殖起到重要作用[17]。而Nrf2可通过介导下游一系列抗氧化物的合成和表达来调节体内氧化平衡,HIF-1α不仅可以通过介导相关转录因子来适应机体组织的缺氧,还可以通过调节VEGF的表达来促进新生血管形成[18]。与RIRI组大鼠比较,经过HC067047干预后,RIRI大鼠视网膜组织中VEGF细胞阳性率下降,Nrf2、VEGF、HIF-1α的mRNA相对表达水平下降,同时PEDF蛋白表达水平升高而GFAP蛋白表达水平下降(P<0.05)。由此推断,抑制TRPV4通道可抑制RIRI大鼠视网膜新生血管的形成。
综上所述,抑制TRPV4通道能够减少视网膜细胞凋亡,并且可以抑制视网膜新生血管的形成,从而对RIRI大鼠视网膜损伤发挥保护作用。但RIRI 病理机制复杂,HC-067047的应用是否存在副作用仍需深入研究探讨。
