抗真菌药在体外膜肺氧合患者中的剂量调整Δ
2021-10-25刘灵灵
刘灵灵,白 楠,王 瑾,蔡 芸#
(1.中国人民解放军总医院医疗保障中心药剂科药物临床研究室,北京 100853;2.中国人民解放军总医院研究生院,北京 100853)
体外膜肺氧合(extracorporeal membrane oxygenation,ECMO)是一种长时间心肺支持技术,适用于病情可能逆转且常规治疗无效的急性严重心功能或肺功能衰竭患者。在挽救新型冠状病毒肺炎患者急性呼吸衰竭、重症心肌炎过程中,ECMO的作用不容小觑[1]。但有文献表明,ECMO是心脏移植后侵袭性真菌感染(invasive fungal infection,IFI)的重要危险因素,也是念珠菌感染的独立危险因素[2-3]。ECMO期间院内感染病原体中,念珠菌居前3位,仅次于凝固酶阴性葡萄球菌、铜绿假单胞菌[4-5]。数据显示,ECMO期间的真菌感染率为0.04%~0.5%,患者如在应用ECMO之前或期间发生真菌感染,将直接导致死亡率升高,升高幅度因年龄、感染时间而异[6-7]。因此,及时、适当地使用抗真菌药对于根治病原体至关重要。然而,大多数IFI患者往往患有严重的基础疾病及并发症,影响抗真菌药的吸收、分布、代谢和排泄。ECMO更是加剧了这一复杂性,给临床治疗带来了困难,如何在ECMO条件下合理使用抗真菌药预防或治疗IFI备受关注。本文基于近年来发表的关于ECMO患者应用抗真菌药的相关研究,对ECMO条件下抗真菌药的药动学(pharmacokinetics,PK)/药效学(pharmacodynamics,PD)影响因素以及剂量调整等内容进行综述,以期为临床ECMO患者的个体化治疗提供剂量参考和循证证据。
1 ECMO条件下药物PK/PD的影响因素
ECMO条件下,药物在患者体内的PK/PD会受到药物自身特点、ECMO支持方案和患者个体差异3个方面因素的影响。
1.1 药物
1.1.1 亲脂性:有研究结果显示,亲脂性药物可能更容易被ECMO回路吸附,药物辛醇-水分配系数(octanol-water partition coefficient,LogP)可预测其吸附程度[8-10]。LogP<1提示水溶性,LogP为1~2提示弱水溶性或脂溶性更大,LogP>2提示脂溶性。绵羊动物模型研究结果亦认为,LogP越大,药物吸附越多,如LogP>2.3被认为是高亲脂性药物,回收率降低[11]。而且,ECMO支持期间,亲脂性药物的稳态表观分布容积(apparent volume of distribution at steady state,Vss)可能增加,清除率(clearance,CL)降低。
1.1.2 血浆蛋白结合率:血浆蛋白结合率<30%,表示低血浆蛋白结合率;血浆蛋白结合率为30%~70%,表示中等血浆蛋白结合率;血浆蛋白结合率>70%,表示高血浆蛋白结合率。高血浆蛋白结合率(>80%)药物在ECMO回路中更易损失,回收率更低[10]。ECMO回路在吸附药物的同时也会吸附血浆蛋白,药物的净回路损失可能是回路吸附、血浆蛋白结合之间平衡的结果[10]。ECMO期间,高血浆蛋白结合率药物的CL、Vss同时降低的现象也在绵羊动物模型中得到验证[11]。
1.1.3 药物稳定性:药物自身的稳定性也会显著影响ECMO期间的PK。药物稳定性指药物保持其物理、化学、生物学和微生物学性质的能力[12]。药物在室温(25 ℃)或生理温度(37 ℃)条件下能否保持稳定,将会影响ECMO回收率[10]。例如,4 g/100 ml的美罗培南溶液在37 ℃下6 h降解超过10%[13];虽然其LogP(-0.6)和血浆蛋白结合率(2%)均很低,但其24 h平均药物回收率仅为20%[10]。米卡芬净具有光敏性[14-15],而ECMO回路缺乏避光措施,故可能会发生光降解[16]。
常用抗真菌药的基本理化性质见表1[17]。
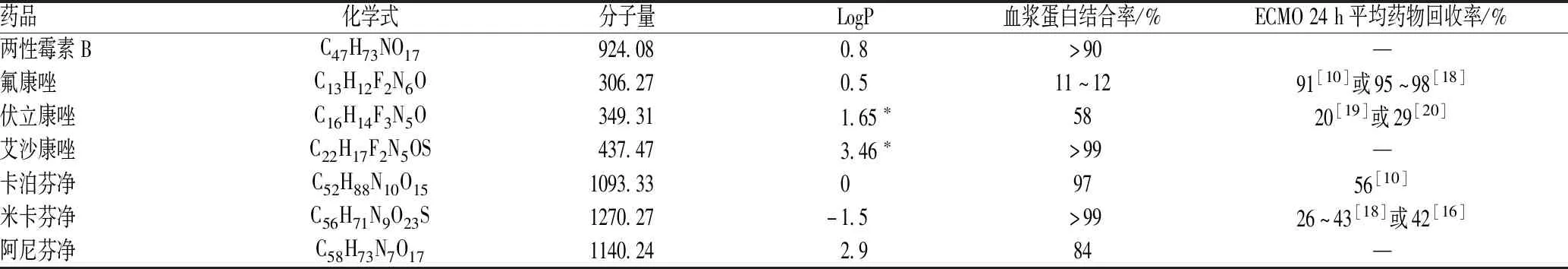
表1 常用抗真菌药的基本理化性质Tab 1 Basic physicalchemical properties of commonly used antifungal drugs
1.2 ECMO
ECMO有2种模式,一种为静-静脉模式(venovenous,VV),仅提供呼吸支持,患者需依赖自身的循环功能;另一种为静-动脉模式(venoarterial,VA),除提供呼吸支持外,也能提供血流动力学功能。VA模式较VV模式更易发生获得性感染;另外,ECMO期间感染率也随着支持时间的延长而升高[5,21]。
1.2.1 ECMO回路容积:ECMO回路容积为250~400 ml,约相当于3 kg体重新生儿的循环血容量(250 ml),而仅占70 kg体重的成人血容量(5 L)的8%。因此,灌注量对婴幼儿表观分布容积(apparent volume of distribution,Vd)的影响更大。
1.2.2 管路及氧合器类型:有研究结果显示,芬太尼在无氧合器的聚氯乙烯(polyvinylchloride,PVC)管路的吸附率为80%,而在含氧合器的PVC管路的吸附率为83%~86%,大部分药物被PVC管路吸附,约5%被氧合器吸附[22]。重组人白蛋白/肝素涂层PVC管路对头孢菌素和碳青霉烯类等亲水性药物的吸附较少[23]。就氧合器类型而言,与硅橡胶氧合器相比,聚甲基戊烯中空低纤维膜氧合器回路对药物的吸附较少[9]。
1.2.3 离心泵:与滚轮泵相比,离心泵回路中咪达唑仑、芬太尼的药物回收率较高[9]。
1.2.4 灌注液的种类和温度:由于灌注液的种类及温度不同,可能会对药物的稳定性产生影响,从而影响药物的PK参数。体外模拟ECMO回路的研究结果显示,回路灌注晶体溶液(如复方氯化钠注射液)、血液(人全血)时,氨苄西林的24 h回收率分别为28.2%、84.6%,头孢唑林24 h回收率分别为78.4%、78.1%。自发降解实验中,氨苄西林晶体溶液、全血样品24 h自发性降解率分别为0%、38.6%,头孢唑林晶体溶液、全血样品24 h自发性降解率分别为21.9%、29%,伏立康唑血液24 h回收率、24 h自发性降解率分别为29%、14.8%[20]。
1.3 患者
1.3.1 年龄:随着年龄增长,患者生长发育,肝血流量变化,肝药酶活性变化,全身含水量降低等,新生儿、儿童和成人的PK出现明显差异[24]。例如,伏立康唑在儿童中的生物利用度为40%~60%,而成人接近100%;2~12岁儿童表现为线性PK代谢,而在给药剂量>7 mg/kg时2~12岁儿童与成人表现相似,为非线性代谢;儿童的伏立康唑Vd低于成人[25]。
1.3.2 自身疾病状态:自身免疫性疾病、全身炎症反应综合征、毛细血管渗漏综合征、低蛋白血症和多器官功能衰竭等会影响药物处置过程[21]。使用ECMO的人群中,危重症患者占有较大比例,对于该类患者,额外液体补充,或血浆蛋白浓度或特性改变,使药物Vd增加[26]。肝肾功能也会影响药物代谢和清除。
1.3.3 联合用药:ECMO患者往往病情复杂,需要联合应用多种药物,而药物之间的相互作用会影响PK/PD。例如,当患者同时使用CYP2C19抑制剂奥美拉唑和伏立康唑时,伏立康唑的药时曲线下面积(AUC0~t)可增加39%[27]。
1.3.4 合并其他治疗:连续性肾脏替代疗法(continuous renal replacement therapy,CRRT)包括连续性静脉-静脉血液滤过(continuous venovenous hemofiltration,CVVH)、术后(应激状态)等也会对药物的PK/PD产生影响。
1.3.5 遗传变异:患者基因型的不同会引起肝药酶活性差异,导致药物代谢速率不同。例如,伏立康唑在CYP2C19酶超快代谢者(CYPC19*17/*17)、快代谢者(CYPC19*1/*17)体内代谢加快,需要增加剂量才能达到与正常代谢者(CYPC19*1/*1)相同的治疗效果[28]。
2 ECMO条件下抗真菌药的剂量调整
2.1 两性霉素B
两性霉素B脂质体(liposomal amphotericin B,L-AMB):Servais等[29]报道了1例29岁肺芽生菌病继发急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)的男性患者,ECMO支持期间L-AMB剂量由5 mg/(kg·d)增至7.5 mg/(kg·d),维持6 d后回调为5 mg/(kg·d),患者结局良好,未见不良反应。考虑到L-AMB的高脂溶性和高血浆蛋白结合率,其在管路中更易损失,因此,可适当提高L-AMB的剂量。Zhao等[30]也报道了1例26岁相似患者,接受VA-ECMO及CRRT支持治疗,真菌培养结果持续阳性,L-AMB剂量由5 mg/(kg·d)加倍至10 mg/(kg·d)后,药峰浓度(Cmax)升至92.5 μg/ml,达到Cmax>83 μg/ml的治疗目标;同时,氧合器前、后L-AMB浓度分别为91.8、63.3 μg/ml,存在L-AMB回路吸附现象;临床改善不佳,加用艾沙康唑200 mg,1日2次联合治疗17 d后,真菌培养结果转阴。但 Foulquier等[31]报道了1例33岁ARDS伴肺曲霉病的女性患者,VV-ECMO支持期间给予L-AMB 4 mg/(kg·d),Vd为0.4 L/kg,CL为16.2 ml/(h·kg),AUC0~24 h为133 μg·h/ml,与健康受试者、危重症患者等的PK参数相近,认为无需调整L-AMB的剂量。Vallero等[32]报道了1例10岁急性早幼粒细胞白血病男性患儿,使用L-AMB 3 mg/(kg·d)联合卡泊芬净50 mg/(m2·d)治疗肺烟曲霉感染,启动ECMO并加用奥司他韦抗甲型流感治疗,期间未调整L-AMB及卡泊芬净的剂量,ECMO支持14 d后撤离,抗真菌疗效显著,且肝肾功能正常。但是,有1篇个案报道基于应用L-AMB致ECMO回路压力急剧增加,推荐优先使用非脂质体两性霉素B[33]。由于上述两性霉素B的使用基本为个案报道,治疗经验有限,缺乏大样本研究数据,研究结论存在争议,故对其进行治疗药物监测(therapeutic drugs concentration monitoring,TDM),更为合理。非ECMO患者抗真菌药的常用剂量方案及PK参数见表2。
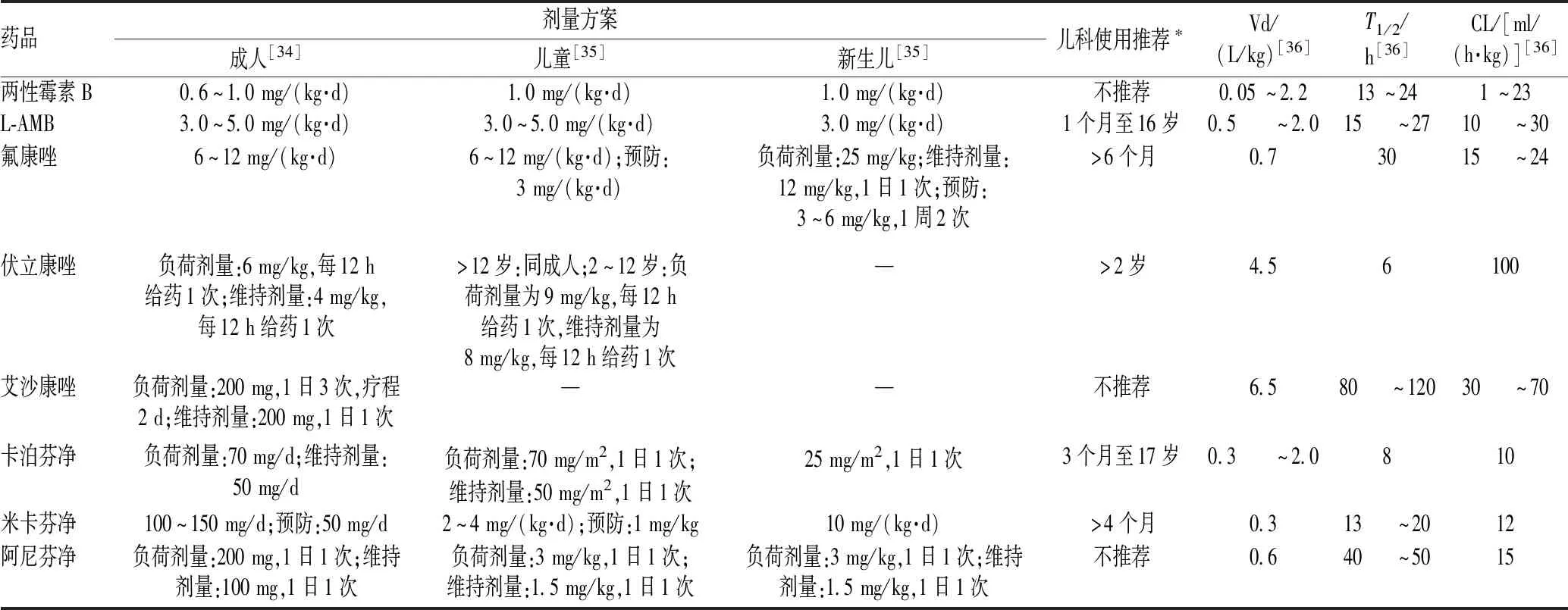
表2 非ECMO患者抗真菌药的常用剂量方案及PK参数Tab 2 Common dose regimens and PK parameters of antifungal drugs in non-ECMO patients
2.2 三唑类药物
2.2.1 氟康唑:Watt等对氟康唑在ECMO儿科患者中的剂量调整进行了系列研究。(1)2012年对10名日龄19 d的新生儿开展预防或治疗侵袭性念珠菌感染研究,其中9名新生儿预防性应用氟康唑25 mg/kg,1周1次,1名新生儿治疗性应用氟康唑12 mg/kg,1日1次[37]。结果显示,ECMO回路氟康唑平均回收率为98%,ECMO患儿氟康唑的Vd较非ECMO患儿升高50%~90%(1.3~1.7 L/kg与0.8~1.4 L/kg比较),两者CL相似[17 ml/(h·kg)与18 ml/(h·kg)比较];预防给药能达到与免疫功能低下的成人预防给药50~200 mg/d的相似暴露水平(AUC0~24 h为50~200 mg·h/L);12 mg/(kg·d)治疗给药时,AUC0~24 h为299 mg·h/L,未达到治疗目标水平(AUC0~24 h>400 mg·h/L),建议剂量可增至30~40 mg/kg。(2)2015年,该团队基于40名日龄22 d的新生儿预防和治疗侵袭性念珠菌感染的数据(21名新生儿接受ECMO),建立了群体药动学模型[38]。结果显示,ECMO患儿的氟康唑Vd增加,建议预防方案为负荷剂量12 mg/kg,维持剂量6 mg/kg,1日1次;治疗方案负荷剂量为35 mg/kg,维持剂量为12 mg/kg。(3)随后,该团队开发的生理药动学模型亦支持氟康唑负荷剂量35 mg/kg用于治疗0~18岁ECMO患儿侵袭性念珠菌感染[39]。
2.2.2 伏立康唑:(1)Jung等[40]报道了1例54岁ARDS、败血症伴多器官功能衰竭的女性患者,启用VV-ECMO后给予伏立康唑300 mg/d,烟曲霉阳性,加用卡泊芬净50 mg/d,7 d后撤离ECMO,烟曲霉转阴,患者康复。(2)Ruiz等[41]报道了1例31岁暴发性心肌炎继发心源性休克的女性患者,予以VA-ECMO和CVVH支持,伏立康唑由初始方案负荷剂量6 mg/kg,1日2次,维持剂量4 mg/kg,1日2次,增至8 mg/kg,1日2次,联合卡泊芬净70 mg,1日1次,治疗烟曲霉感染。2、3 d后,测得伏立康唑血药浓度仅为0.5、<0.2 mg/L,提示ECMO对伏立康唑血药浓度影响较大,停用伏立康唑,改为卡泊芬净与L-AMB和氟胞嘧啶联合治疗,患者结局良好。(3)Spriet等[42]报道了1例17岁中毒性巨结肠伴休克的男性患者,予以伏立康唑负荷剂量400 mg,1日2次,维持剂量280 mg,1日2次治疗疑似侵袭性肺曲霉病和脑曲霉病。使用ECMO前,伏立康唑谷浓度(Cmin)、Cmax分别为 7.2、7.5 μg/ml,Vd为1.58 L/kg,CL为47.91 ml/min。6 d后,予以VV-ECMO支持,伏立康唑维持剂量增至400 mg,1日2次。ECMO支持2 d后,伏立康唑Cmax、Cmin大幅升高,提示其吸附具有饱和性;平均Cmin为9.65 μg/ml,Cmax为13.91 μg/ml,Vd为1.38 L/kg,CL为49.33 ml/min,相较于健康受试者[43]常规剂量下(Cmax为5.4 μg/ml,Vd为1.39 L/kg,CL为140 ml/min),该患者的Cmax升高,CL降低。该患者的基因型为CYP2C19野生型,排除了基因所致的代谢能力低,患者肾功能正常,也排除药物相互作用,但使用ECMO前伏立康唑的Cmax、Cmin均较高,提示患者自身代谢能力低。(4)Brüggemann等[44]报道1例5岁急性淋巴细胞白血病的男性患儿,予以VV-ECMO和CVVH支持,伏立康唑6.7 mg/kg,1日2次,治疗侵袭性肺曲霉病,伏立康唑血药浓度仅为0.7 mg/L。为达到Cmin为1 mg/L的治疗目标,伏立康唑剂量增至14 mg/kg,1日2次。患儿稳态Cmin为4.22 mg/L,Cmax为8.2 mg/L,AUC升至64 mg·h/L,CL为0.22 L/(h·kg),AUC0~24 h/最低抑菌浓度达53.8,远超目标靶值(20~25)。此时,患儿氨基转移酶升高至正常值上限的3倍,血肌酐为13~34 μmol/L。ECMO支持19 d后,患儿死于凝血功能紊乱。该研究建议儿童使用伏立康唑的最高剂量不超过10 mg/kg。
2.2.3 艾沙康唑:(1)如“2.1”项下所述,Zhao等[30]报道的1例26岁肺芽生菌病继发ARDS的男性患者,L-AMB剂量加倍至10 mg/(kg·d)后,临床改善不佳,联合应用艾沙康唑200 mg,1日2次,其Cmin由1.9 μg/ml升至4.1 μg/ml,达到Cmin>3 μg/ml的治疗目标;同时,氧合器前、后艾沙康唑浓度为3.7、3.4 μg/ml,提示艾沙康唑存在回路吸附现象;高剂量联合治疗17 d后,真菌培养结果转阴。(2)一项治疗IFI的多中心队列研究评价了艾沙康唑200 mg,每8 h给药1次,2 d后予以维持剂量200 mg,1日1次的方案[45]。3例接受ECMO的患者中,1例患者给药12 d后,艾沙康唑血药浓度为1.79 μg/ml。第2例患者给药第1、4日的艾沙康唑血药浓度分别为0.74、0.57 μg/ml;第6日ECMO撤离后,艾沙康唑血药浓度升至2.44 μg/ml。第3例患者ECMO期间的艾沙康唑血药浓度为1.7 μg/ml;第12日,加用CRRT支持,艾沙康唑血药浓度降至0.8 μg/ml;第15日,ECMO撤离,仅予以CRRT支持,艾沙康唑血药浓度仍<0.9 μg/ml。该研究结果显示,ECMO、CRRT的患者使用艾沙康唑的血药浓度差异较大,建议进行TDM,以达到目标血药浓度(>1 μg/ml)。
2.3 棘白菌素类药物
2.3.1 卡泊芬净:(1)一项基于30例危重症患者(10予以ECMO支持,21例予以CRRT支持)使用卡泊芬净预防真菌感染的临床试验,负荷剂量为70 mg,维持剂量为50 mg,1日1次,群体药动学研究结果显示,给药后1~3 d的中央室表观分布容积(V1)分别为6.04、7.32和7.70 L;平均CL为0.709 L/h,与药品说明书相近(0.72 L/h);AUC0~24 h分别为89、68(降低24%)和50(降低44%)mg·h/L,无法达到最低有效靶值AUC0~24 h(98 mg·h/L);并认为ECMO不会显著影响卡泊芬净的PK,无需调整剂量[46]。(2)有研究报道了1例41岁胰腺炎继发败血症休克的男性患者,VV-ECMO期间给予卡泊芬净70 mg,1日1次,其Cmax为11.95 μg/ml,Vd为8.22 L,CL为6.9 ml/min,与健康受试者(Cmax为9.5~12 μg/ml,Vd为8~10 L,CL为10~12 ml/min)[47]相差不大,提示ECMO期间卡泊芬净所受影响较小[42]。(3)Koch等[48]报道了1例11个月龄严重念珠菌肺部感染的女婴,予以VV-ECMO支持,应用伏立康唑4 d后Cmin较低,换用卡泊芬净首剂78 mg/m2,维持剂量78 mg/m2,1日1次。首剂后的Cmax为7.43 mg/L,Cmin为1.02 mg/L,均低于文献报道(Cmax为11.95 mg/L,Cmin为3.73 mg/L);AUC为69 mg·h /L,低于标准剂量为50 mg/m2儿童的平均AUC(140 mg·h /L);CL为0.04 L/(h·kg),高于文献报道[42]。患儿在调整剂量前死于多器官功能衰竭。ECMO回路的总容积为360 ml,约占该患儿总循环容积的60%,因此,建议在婴儿应用ECMO过程中进行TDM。
2.3.2 米卡芬净:一项研究为针对12名日龄59 d的ECMO婴儿预防或治疗侵袭性念珠菌感染的研究[16]。结果显示,预防组婴儿给予米卡芬净4 mg/(kg·d),疗程为8 d,第1、4日的AUC分别为 74、117 mg·h/L,均处于甚至高于预防目标暴露水平(37.5~69.5 mg·h/L)。治疗组婴儿给予米卡芬净8 mg/(kg·d),疗程为6 d,第2、5日的AUC分别为213、178 mg·h/L,超出治疗目标暴露水平(75~139 mg·h/L)。ECMO婴儿的Vd(0.64 L/kg)较非ECMO婴儿(0.34~0.54 L/kg)增加20%~90%,CL[0.041 L/(kg·h)]较非ECMO婴儿[0.020~0.039 L/(kg·h)]略增加。该研究建议,ECMO患儿米卡芬净的预防、治疗剂量可分别调至2.5、5 mg/(kg·d)。
2.3.3 阿尼芬净:Aguilar等[49]报道了1例69岁的ARDS男性患者,ECMO支持后给予阿尼芬净负荷剂量200 mg,1日1次,维持剂量100 mg,1日1次,治疗侵袭性念珠菌感染。该患者的Cmax为13.5 mg/L,Cmin为2.19 mg/L,Vss为 18.9 L,CL为0.933 L/h,氧合器前、后的AUC0~24 h分别为107、111 mg·h/L,与危重症成人患者、一般患者和健康受试者相同剂量下的PK参数相近(Cmax分别为7.7、7.2和7.0 mg/L,Cmin分别为3.0、3.3和3.1 mg/L,Vss分别为38.8、34.5和35.2 L,CL分别为1.3、1.0和1.0 L/h,AUC0~24 h分别为92.7、110.3和105.9 mg·h/L[50]),因此,无需调整阿尼芬净的剂量。
3 TDM
目前,常针对具有明确的暴露-反应关系,但PK特征不可预测或者治疗浓度范围狭窄的抗真菌药进行TDM,如氟胞嘧啶、伊曲康唑、伏立康唑和泊沙康唑。由于ECMO患者应用抗真菌药存在较大的变异性,如L-AMB、艾沙康唑存在ECMO回路吸附现象,进行TDM以优化ECMO患者的抗真菌感染治疗更为可行(其TDM治疗目标见表3)。基于目前的证据,ECMO成人患者应用氟康唑、棘白菌素类药物无需进行TDM;ECMO患儿应用卡泊芬净时,建议进行TDM。

表3 抗真菌药的治疗药物监测靶值Tab 3 Therapeutic drug monitoring target values of antifungal drugs
总之,如何对使用ECMO的患者进行抗真菌药剂量优化已经引起临床的广泛重视。但由于该类患者疾病的复杂性、使用的药物特性及ECMO自身因素,个体差异较大,患者的PK/PD变化规律并不一致。少数研究建立了群体药动学模型或生理药动学模型,对于某一特定人群进行了剂量模拟和推荐,但仍有待于设计严谨的临床随机对照试验予以验证。目前,仍建议在有条件的情况下,尽量对使用ECMO的患者进行TDM,保证治疗的有效性和安全性。
