基于消化酶和肠道益生菌作用的枇杷叶降血糖作用研究
2021-10-14陈蓉范丽丽卢佳如祁静申迎宾
陈蓉 范丽丽 卢佳如 祁静 申迎宾










摘 要:目的:通过研究枇杷叶提取液消化前后对肠道益生菌的生长和代谢产生的影响,以及在消化过程中对消化酶活力的影响来探讨枇杷叶提取液的降血糖作用。方法:通过体外试验,考察了不同浓度的枇杷叶提取液对3种益生菌的增殖作用及对肠道消化酶的活性影响,并探讨了枇杷叶提取液经消化酶消化后对肠道益生菌的增殖作用。结果:(1)一定浓度的枇杷叶提取液对单独培养的双歧杆菌有显著的促进作用,但其对嗜酸乳杆菌的生长代谢无显著影响。(2)枇杷叶提取液经消化酶作用后对肠道益生菌的促生作用显著降低,甚至表現出抑制作用。(3)试验组代谢产物中的丙酸含量要明显高于对照组,而其他两种酸的含量差别并不显著。(4)浓度为6 g/L的枇杷叶提取液对蛋白酶活力的促进作用最为显著,而所研究的不同浓度枇杷叶提取液对胰淀粉酶活力均表现出抑制作用,对胰脂肪酶的活力无显著影响。结论:枇杷叶提取液可能是通过降低淀粉酶的活性及通过增加益生菌代谢产物中的丙酸含量来达到降低血糖浓度的目的。
关键词:枇杷叶;肠道益生菌;消化酶;模拟消化;降血糖
枇杷叶是蔷薇科枇杷(Eriobotrya japonica)的干叶,在中国主要分布在江苏、安徽、江西、福建、四川、云南等地。枇杷叶中的主要功能物质为黄酮类、三萜酸类、有机酸类、挥发油类等,具有抗炎、祛痰、止咳、抗肺纤维化、抗氧化、降血糖、抗肿瘤、抗恶心等药理作用[1]。目前,关于枇杷叶止咳平喘、抗炎、抗氧化、抗肿瘤等药理作用的研究以及降血糖的研究已有不少[2-7],但从调节肠道菌群的角度来探讨枇杷叶降血糖的作用研究却未见报道。石学魁等[8]研究表明,枇杷叶水煎液能使盐酸可霉素灌服导致的肠道菌群失调小鼠模型中肠杆菌、肠球菌、乳杆菌、双歧杆菌数量恢复到正常范围,说明其具有调节肠道菌群的作用。枇杷叶富含的黄酮类和三萜类成分是良好的降血糖、抗肥胖的活性成分[9],具有较高的开发价值和广阔的应用前景。
肠道益生菌主要有四大类,即双歧杆菌、乳杆菌、球菌和芽孢杆菌,具有促进营养物质的消化吸收[10]、提高机体免疫力[11]等多种功能。相关研究表明,益生菌能够改善胃肠道粘膜的微生态或酶的平衡,从而达到提高机体免疫力的作用[12]。本研究探讨了枇杷叶提取液对肠道益生菌繁殖代谢和肠道消化酶的作用,可为枇杷叶的降血糖作用研究提供科学依据。
1 材料与方法
1.1 材料与仪器
1.1.1 主要仪器 759S紫外可见分光光度计,上海仪电分析仪器有限公司;洁净工作台,苏州安泰空气技术有限公司;电热恒温鼓风干燥箱,上海精宏实验设备有限公司;BM1800双目显微镜,南京江南永新光学有限公司;高压蒸汽灭菌锅,上海博迅实业有限公司;生化恒温箱,上海博讯实业有限公司;生化恒温箱,韶关市泰宏医疗器械有限公司;电子天平,北京赛多利斯科学仪器有限公司;高速台式离心机,上海安亭科学仪器厂;数显恒温水浴锅,国华电器有限公司。
1.1.2 试验菌种 青春双歧杆菌BNCC134301(Bifidoba-cterium adolescentis)、两歧双歧杆菌BNCC186304(Bifido-bacterium bifidum)、嗜酸乳杆菌BNCC185342(Lactobacillus acidophilus),均由BNCC苏州北纳创联生物技术有限公司提供。
1.2 方法
1.2.1 基础培养基的配制 MRS培养基(嗜酸乳杆菌):5.00 g酪蛋白胨、1.00 g柠檬酸三胺、0.10 g七水硫酸镁、1.00 g磷酸氢二钾、10.00 g葡萄糖、2.88 g酵母膏、5.75 g牛肉膏、0.03 g硫酸锰、2.50 g乙酸钠、0.50 g吐温80,加蒸馏水溶解,调节pH至6.0~6.4,然后用蒸馏水定容至500 mL。于121 ℃下高压灭菌20 min,放至室温后于4 ℃冰箱中储藏。
BBL培养基(双歧杆菌):2.50 g氯化钠、7.50 g大豆蛋白胨、0.10 g七水硫酸镁、1.00 g磷酸氢二钾、10.00 g葡萄糖、14.40 g酵母膏、0.25 g可溶性淀粉、0.03 g硫酸锰、1.00 g柠檬酸氢二胺、0.25 g L-半胱氨酸、1.00 g吐温80,加蒸馏水溶解,调节pH至7.0,然后定容至500 mL容量瓶中。转移至三角瓶中并于121 ℃下高压灭菌20 min,放置至室温后于4 ℃冰箱中储藏。
混合培养基(混合菌):2.50 g氯化钠、7.50 g大豆蛋白胨、0.10 g七水硫酸镁、1.00 g磷酸氢二钾、10.00 g葡萄糖、14.40 g酵母膏、0.25 g可溶性淀粉、0.03 g硫酸锰、1.00 g柠檬酸氢二铵、0.25 g L-半胱氨酸、1.00 g吐温80、5.00 g酪蛋白胨、5.75 g牛肉膏、1.00 g柠檬酸铵、2.50 g乙酸钠,加蒸馏水溶解,调节pH至7.0,最后定容至500 mL容量瓶中。转移至三角瓶中并于121 ℃下高压灭菌15 min,放置至室温后于4 ℃冰箱中储藏。
1.2.2 增殖培养基的配制 选择对益生菌促生作用最显著的枇杷叶浓度来配制增殖培养基,以最适浓度的枇杷叶提取液来溶解相应试剂配制的培养基即为增殖培养基。
1.2.3 消化液培养基的配制 胃肠消化液的配置根据Alvito等[1]报道的研究方法稍加修改,具体配置方法及步骤:(1)模拟胃液电解质溶液(SGF)及肠液电解质溶液(SIF)的配制:分别配制浓度为0.5 mol/L的KCl溶液、0.5 mol/L 的KH2PO4溶液、1 mol/L 的NaHC03溶液、2 mol/L 的NaCl溶液、0.15 mol/L 的MgCl2(H2O)6溶液、0.5 mol/L 的(NH4)2CO3溶液。SGF的配制分别按顺序加入上述溶液6.9、0.9、12.5、11.8、0.4、0.5 mL,用1 mol/L HCl溶液调节pH至3.0,加蒸馏水配制成500 mL溶液,然后在-20 ℃下储存。SIF的配制分别按顺序加入上述溶液6.8、0.8、42.5、9.6、1.1 mL,然后用1 mol/L HCl溶液调节pH至7.0,加蒸馏水配制成500 mL溶液,于-20 ℃下储存。
(2)模拟胃消化:取100 mL一定浓度的枇杷叶提取液与76 mL SGF混合,加入4 mL胃蛋白酶(2 000 U/mL,用SGF配制)及无水氯化钙(最终浓度为0.075 mmol/L),加入1 mol/L的HCl调节pH至3.0,最后加水至200 mL,在37 ℃恒温培养振荡器中消化2 h。
(3)模拟肠消化:200 mL胃消化液与152 mL SIF混合,加入8 mL胰酶(胰蛋白酶100 U/mL、胰脂肪酶2 000 U/mL、胰淀粉酶200 U/mL,均使用SIF配制),加入4 g胆盐及无水氯化钙(最终浓度为0.3 mmol/L),加入1 mol/L NaOH调pH至7.0,最后加水至400 mL,在37 ℃恒温培养振荡器中消化2 h。
(4)配制BBL消化液培养基及MRS消化液培养基:称取相应基础培养基的试剂后,用上述经消化后的消化液将所有试剂溶解,然后分别调节pH至7.0及6.2~6.4,于121 ℃下高压灭菌15 min,放置至室温后储藏于4 ℃冰箱。
1.2.4 活化菌种 在超净工作台上将益生菌冻干粉用少量生理盐水溶解,充分振荡使菌体分散均匀,以涂布的方式接种于2个10 mL固体培养基上,在37 ℃下,用厌氧袋培养48 h,传代2次,挑取一部分单菌落与50%的甘油混合放置于5 mL离心管中,于-80 ℃下冻存。
1.2.5 测定生长曲线 在10 mL试管中准确加入12 mL基础培养基排尽试管内空气,接入1 mL菌液,塞上试管塞,并用保鲜膜裹严试管口,放入37 ℃生化恒温箱中厌氧培养24 h,分别于0 h、2 h、4 h、……、24 h(每隔2 h)时在690 nm下测定吸光度,以空白培养基调零。每个时间点测定3组平行。以培养时间为横坐标,吸光度OD值为纵坐标,绘制生长曲线。
1.2.6 枇杷叶对益生菌的增殖作用(1)枇杷叶提取液的制备:称取50.0 g枇杷叶,用1 000 mL蒸馏水浸泡30 min后大火煮沸,保持微沸状态20 min,经四层纱布过滤,重复煮两次,合并两次药液。放置至室温后定容到1 000 mL容量瓶中,配制成浓度为50 g/L的枇杷叶提取液,分别取一定量该浓度的枇杷叶提取液制备一系列浓度梯度为1~20 g/L的药液250 mL。
(2)药液培养基的制备:BBL药液培养基:按照其基础培养基的组成称取相应试剂,分别用浓度为8~17 g/L的枇杷叶提取液溶解并定容至500 mL,调节pH至7.0,于121 ℃下高压灭菌20 min,放置至室温后于4 ℃冰箱中储藏。MRS药液培养基:按照其基础培养基的配方称取相应试剂,分别用浓度为1~10 g/L的枇杷叶提取液溶解后定容到500 mL,调节pH到6.0~6.4,于121 ℃下灭菌20 min,放置至室温后于4 ℃冰箱中储藏。
(3)不同浓度枇杷叶提取液对菌种生长的影响:①对照组:在10 mL试管中准确加入12 mL基础培养基以排尽试管内空气,接入1 mL菌液,塞上试管塞并用保鲜膜裹严试管口,放入37 ℃生化恒温箱中厌氧培养,根据上述测定的菌种生长曲线,培养至菌种的对数生长期,分别在不同菌种的各自对数期起始点取培养液在690 nm下测定吸光度,以不接菌的基础培养基调零。每个时间点测定3组平行,根据培养前后吸光度差值得出益生菌在对数生长期的生长量。②试验组:在10 mL试管中准确加入12 mL含有不同浓度枇杷叶提取液的培养基后,其余操作同上述对照组。
比较不同浓度的试验组和对照组生长量的差值,得出不同浓度的枇杷叶对益生菌的促生作用,差值越大,则说明该浓度的枇杷叶提取液对肠道益生菌生长的促生作用越显著,以促生作用最显著的浓度来配制增殖培养基。
1.2.7 枇杷叶对益生菌生长速率及pH值的影响 在10 mL试管中加入12 mL药液培养基排尽试管内空气,接入1 mL菌液,塞上试管塞,并用保鲜膜包裹试管口,放入37 ℃生化恒温箱中厌氧培养48 h,分别于0、8、12、16、20、24、30、36、42、48 h在690 nm下测定吸光值,以不接菌的药液培养基调零,每个时间点做3个平行。同时测定pH值,每个时间点测定2组平行。以培养时间为横坐标、吸光度OD值为纵坐标绘制生长曲线。以培养时间为横坐标、pH值为纵坐标绘制pH值变化曲线。将肠道益生菌在基础培养基中的生长曲线及pH值作为对照,操作同上。
1.2.8 枇杷叶经消化后对益生菌生长的影响(1)枇杷叶经消化对青春双歧杆菌生长曲线的影响:分别配制枇杷叶浓度为6 、8、10 g/L的消化液培养基,并做不加枇杷叶提取液的对照培养基。在10 mL试管中准确加入12 mL消化液培养基,接入1 mL菌液,塞上试管塞,并用保鲜膜包裹接口,放入37 ℃生化恒温箱中厌氧培养24 h,分别于0、2、4、……、24 h(每隔2 h)时取菌液在690 nm下测定吸光值,以不接菌的消化液培养基调零。每个时间点测定3组平行。以培养时间为横坐标、吸光度OD值为纵坐标,绘制生长曲线。(2)枇杷叶经消化后对两歧双歧杆菌生长曲线的影响:分别配制枇杷叶浓度为2、4、6 g/L的消化液培养基,并做不加枇杷叶提取液的对照培养基,生长曲线的绘制方法同1.2.6(1)。(3)枇杷叶经消化后对嗜酸乳杆菌生长曲线的影响:分别配制枇杷叶浓度为12、14、16 g/L的消化液培养基,并做不加枇杷叶提取液的对照培养基,生长曲线的绘制方法同1.2.6(1)。
1.2.9 枇杷叶对益生菌代谢产物的影响 根据田芬等[2]关于嗜酸乳杆菌和双歧杆菌的主代谢产物分析的报道,具体测定步骤:准备2支10 mL试管,在每支试管中加入12 mL培养基排尽试管内空气,接入1 mL菌液,在37 ℃生化恒温箱中厌氧培养24 h后取样4 mL,置于18 ℃下冻藏。测定代谢产物时,解冻后于12 000 r/min离心机下離心10 min,取上清液经0.22 μm针孔滤膜过滤,置于样品瓶,采用高效液相测定乙酸、丙酸、丁酸等短链脂肪酸的含量。首先绘制标准品乙酸、丙酸、丁酸的标准曲线,然后测定样品。色谱条件:色谱柱:HPX-87H(300 mm×7.8 mm,9 μm);检测器:RID214;流动相:5 mmol/L H2SO4,流速0.5 mL/min,温度50 ℃,进样量10 μL,分离时间30 min。
1.2.10 枇杷叶对消化酶活性的影响 (1)酶液的制备:准确称取1.00 g胰蛋白酶(≥10 000 U/mg),用蒸馏水稀释至500 mL;准确称取1.00 g胃蛋白酶(≥400 U/mg),用蒸馏水稀释至250 mL[3]。(2)胃肠消化液的体外模拟:模拟胃液:取16.4 mL盐酸(10.0%),用蒸馏水稀释至pH为1,于121 ℃下高压灭菌30 min,冷却至室温后,每100 mL加入1 mL胃蛋白酶酶液(≥400 U/mg)、0.5 g脂肪酶(100~500 U/mg),混匀后备用。模拟肠液:称取6.8 g磷酸二氢钾,加500 mL左右的蒸馏水溶解,用氢氧化钠溶液(0.4%)调pH至6.8,加水稀释至1 000 mL,于121 ℃下高压灭菌30 min,冷却至室温后,每100 mL加入1 mL胰蛋白酶酶液(≥10 000 U/mg)、0.5 g脂肪酶(100~500 U/mg)、0.5 g淀粉酶(≥10 U/mg),混匀备用。(3)枇杷叶提取液的制备:称取16 g枇杷叶,用1 000 mL蒸馏水浸泡30 min后大火煮沸,保持微沸状态20 min,经4层纱布过滤,重复煮2次,合并2次药液。放至室温后定容到1 000 mL容量瓶中,配制成16 g/L的枇杷叶提取液。分别取62.5、187.5 、375 mL的16 g/L枇杷叶提取液定容至500 mL容量瓶,配制成浓度分别为2 、6、12 g/L的枇杷叶提取液。(4)枇杷叶对消化酶活性的影响测定:取10 mL模拟胃液或模拟肠液置于50 mL烧杯中,分别加入5 mL不同浓度的枇杷叶提取液,空白对照组则加入5 mL蒸馏水,37 ℃水浴中反应30 min,然后测定α-淀粉酶、蛋白酶、脂肪酶的活力。(5)酶活的测定方法:α-淀粉酶活性测定参考赵蓉[13]的测定方法、蛋白酶活性测定参考GB23527蛋白酶制剂[14]的测定方法、脂肪酶活性測定参考GB23535脂肪酶制剂[15]的测定方法。
2 数据与分析
2.1 3种益生菌的生长曲线
根据图1A可知,青春双歧杆菌的迟缓期为8 h。由生长速率计算公式X=A(吸光度)h(培养时间)可知,于12 h时生长速率达到最大值0.049,于18 h后进入生长稳定期。图1B显示,两歧双歧杆菌的迟缓期为10个小时,12 h时生长速率为0.028,从此进入对数生长期,于18 h后进入生长稳定期。由图1C可知,嗜酸乳杆菌的迟缓期为4个小时,于10 h生长速率达到最大值0.054,16 h后进入生长稳定期。
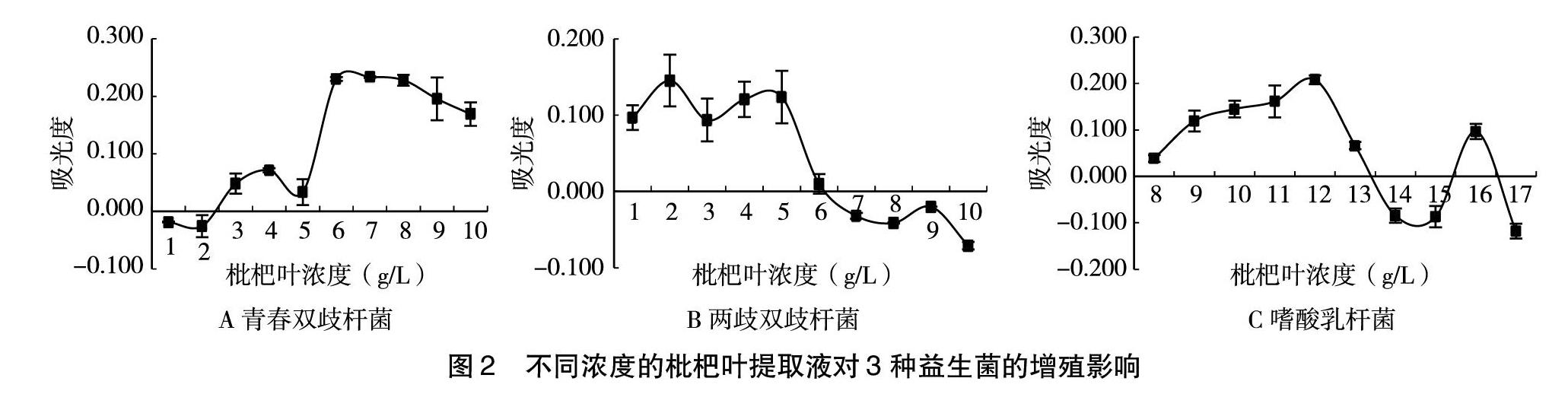
2.2 枇杷叶对三种益生菌的增殖影响
根据预试验结果,选取浓度梯度为1~10 g/L的枇杷叶浓度来配制药液培养基,以基础培养基为对照组。试验组与对照组相比较,得出不同浓度的枇杷叶提取液对青春双歧杆菌生长的增殖作用。如图2A所示,浓度为1 g/L和2 g/L的枇杷叶对青春双歧杆菌表现出抑制作用,枇杷叶浓度为6 g/L时,青春双歧杆菌的增殖量达到最大。此结果说明,枇杷叶在一定浓度范围有利于青春双歧杆菌的生长繁殖,从而有利于维持肠道微生态平衡,保持肠道健康,从而能够促进代谢废物的排泄以及营养物质的代谢,间接降低血液中的葡萄糖水平。
根据预试验结果,选取浓度梯度为1~10 g/L的枇杷叶浓度来配制药液培养基,以基础培养基为对照组。试验组与对照组相比较,得出不同浓度的枇杷叶提取液对两歧双歧杆菌生长的增殖作用。如图2B所示,枇杷叶提取液浓度为1~5 g/L时,两歧双歧杆菌的增殖量在0.1~0.15之间上下波动,枇杷叶浓度为2 g/L时,两歧双歧杆菌的增殖量达到最大值。之后随着枇杷叶浓度的增大,增殖量总体表现出下降趋势,且枇杷叶提取液浓度大于6 g/L时,对两歧双歧杆菌的生长表现出抑制作用。此结果说明,存在一定浓度范围内的枇杷叶提取液对两歧双歧杆菌的生长起促进作用,肠道中益生菌数目的增多,有利于维持肠道微生态的平衡,从而能够促进代谢废物的排泄以及营养物质的代谢,间接降低血液中的葡萄糖水平。
根据预试验结果,选取浓度梯度为8~17 g/L的枇杷叶提取液来配制药液培养基,以基础培养基为对照组。经过与对照组相比,得出不同浓度的枇杷叶提取液对嗜酸乳杆菌生长的增殖作用。如图2C所示,枇杷叶浓度为8~12 g/L时,随着枇杷叶浓度的增大,嗜酸乳杆菌的增殖量也越大,并于12 g/L达到最大值。当枇杷叶浓度超过12 g/L之后,嗜酸乳杆菌的增殖量以x轴为中线上下波动。当枇杷叶提取液浓度为14、15、17 g/L时,对嗜酸乳杆菌表现出抑制作用。此结果说明,当枇杷叶提取液的浓度大于13 g/L时,对嗜酸乳杆菌生长的作用不显著。
2.3 枇杷叶提取液对肠道益生菌生长速率的影响及pH值变化
2.3.1 浓度为6 g/L的枇杷叶提取液对青春双歧杆菌生长速率的影响及pH值变化 由图3A可知,在0~8 h内,青春双歧杆菌在两种培养基中的生长速率基本保持一致;在8~12 h内,青春双歧杆菌在增殖培养基中的生长速率显著高于其在基础培养基中的生长速率,且生长量也较高;在增殖培养基中,青春双歧杆菌在12 h后一直保持在生长量较高的水平,但在基础培养基中,青春双歧杆菌在12 h后进入到衰亡期,菌量持续降低,20 h后进入到平稳状态。由此可得出,枇杷叶在一定浓度下对青春双歧杆菌具有益生作用,且能显著延长其生长期。根据图3B可知,在0~16 h内,菌液的pH值呈下降趋势,但在增殖培养基中,菌液的pH值下降趋势较缓;16 h后,菌液pH值基本重合。由此初步说明,虽然枇杷叶对青春双歧杆菌具有显著增殖作用,但对其代谢产生的脂肪酸总量无显著影响,且pH的缓慢变化有利于维持肠道微生态平衡,保持肠道健康,从而能够促进代谢废物的排泄以及营养物质的代谢,间接降低血液中的葡萄糖水平。
2.3.2 浓度为2 g/L的枇杷叶提取液对两歧双歧杆菌生长速率的影响及pH值变化 根据图4A可知,在0~12 h内,两歧双歧杆菌在增殖培养基和基础培养基中都处于对数生长期,且均在培养时间为8 h时生长速率达到最大值;但在增殖培养基中的生长速率显著较高。在12~48 h内,两歧双歧杆菌在增殖培养基中的菌数基本稳定,且表现出继续生长繁殖的趋势;但在基础培养基中表现出衰亡的趋势,直至20 h后保持稳定。图4B表明,在0~12 h内,菌液的pH值呈现下降趋势,但增殖培养基的pH值下降速度更快;12 h后,两曲线基本重合。图4说明,枇杷叶在一定浓度范围内对两歧双歧杆菌同样具有显著的增殖作用;但对代谢产生的短链脂肪酸的总量无影响,且肠道益生菌的增加和pH的缓慢变化均有利于维持肠道微生态平衡,保持肠道健康,间接降低血糖水平。
2.3.3 浓度为12 g/L的枇杷叶提取液对嗜酸乳杆菌生长速率的影响及pH值变化
根据图5A可知,嗜酸乳杆菌在增殖培养基和基础培养基中的生长状况基本保持一致,甚至在24 h之前,嗜酸乳杆菌在基础培养基中的生长量高于在增殖培养基中的生长量。因此,枇杷叶提取液对嗜酸乳杆菌生长的增殖作用不显著。由图5B可见,在0~16 h内,菌液的pH值呈下降趋势,但在增殖培养基中,菌液的pH值下降趋势较缓;16 h后,菌液pH值基本重合。此结果说明,枇杷叶提取液有利于益生菌增殖,促进肠道代谢及废物的排泄,维持肠道微生态的稳定性,从而达到降低血糖浓度的目的。
2.4 消化后的枇杷叶提取液对肠道益生菌生长速率的影响
考虑到枇杷叶提取液经消化后功效可能会有所下降,因此选取了3个浓度的枇杷叶提取液进行对比,同时以未加枇杷叶提取液的消化液来做空白对照,其生长曲线如下图所示。据图6可知,试验组和对照组中肠道益生菌的生长量都较小,且对照组的生长量较高。结果表明,枇杷叶提取液经消化后对肠道益生菌的促生作用明显降低,甚至表现出抑制作用,说明枇杷叶经过胃肠道消化酶作用后,其功能性物质会被大量分解,从而导致其药效降低。
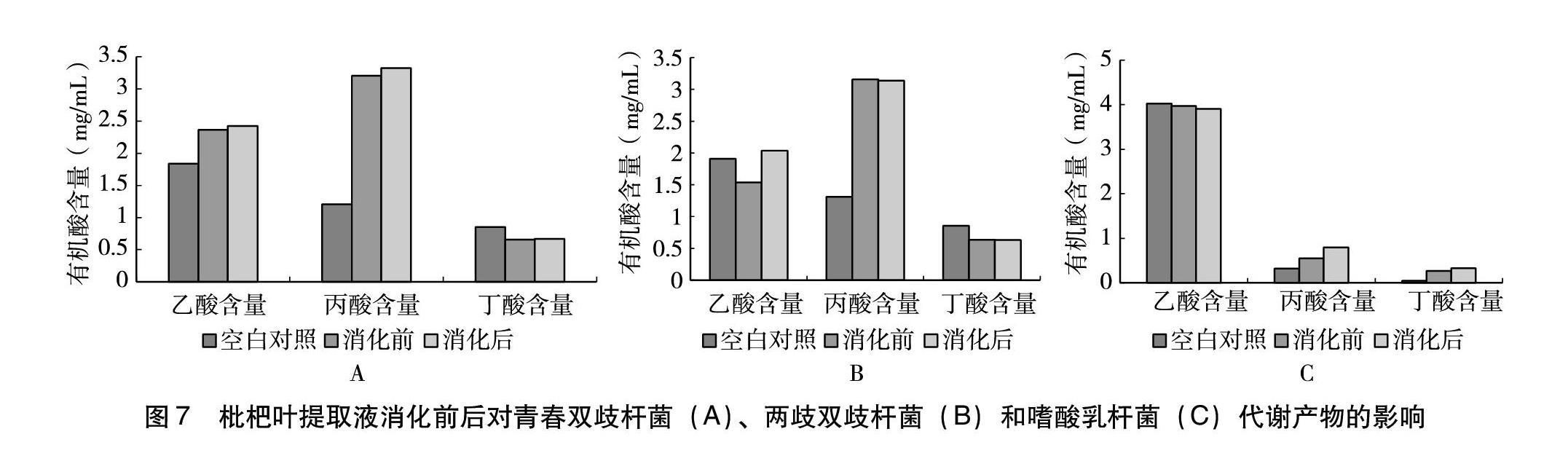
2.5 枇杷叶提取液消化前后对肠道益生菌代谢产物的影响
2.5.1 标准品检测结果 标准品检测结果见表2。
2.5.2 样品检测结果 以肠道益生菌在基础培养基中生长24 h后的代谢产物为空白对照,测定枇杷叶提取液消化前后对肠道益生菌代谢产物的影响。据图7可知,枇杷叶提取液改变了双歧杆菌产酸的比例,空白对照组的青春双歧杆菌三种代谢产物含量为乙酸>丙酸>丁酸;而在试验组中,青春双歧杆菌的三种代谢产物含量为丙酸>乙酸>丁酸。整体来看,试验组中丙酸含量要明显高于对照组,而其他两种酸的含量差别并不明显。王子花等[16]研究表明,丙酸经结肠吸收后由肝脏代谢用作能源,并可以抑制肝胆固醇的合成。且长期给予丙酸盐可降低空腹血糖浓度,这可能与抑制肝脏中肝糖原分解释放葡萄糖有关。因此可以推断枇杷叶提取液是通过改变代谢产物中丙酸的含量达到降低血糖浓度的作用。据图7C可知,试验组和空白对照组嗜酸乳杆菌三种代谢产物含量的区别并不明显,正如图5所示,枇杷叶提取液对嗜酸乳杆菌生长的增殖作用不显著。
2.6 枇杷叶提取液对消化酶活性的影响
2.6.1 蛋白酶活性 (1)浓度分别为2、6、12 g/L的枇杷叶提取液对胃蛋白酶活力的影响:据表3可知,在模拟胃液中,浓度为6 g/L的枇杷叶提取液能有效提高胃蛋白酶的活力,而浓度为2 g/L和12 g/L的枇杷叶提取液表现出对胃蛋白酶活力的抑制作用,抑制效果为:12 g/L>2 g/L,说明在一定浓度范围内,枇杷叶能够抑制胃的消化能力,从而降低食物的消化吸收率。(2)浓度分别为2 、6、12 g/L的枇杷叶提取液对胰蛋白酶活力的影响:据表4可知,在模拟肠液中,3种浓度的枇杷叶提取液均能有效提高胰蛋白酶活力,且促进效果为:6 g/L>2 g/L>12 g/L。说明在一定浓度范围内,枇杷叶可以显著提高小肠对蛋白质的消化能力。
2.6.2 胰淀粉酶活性 据表5可知,3个浓度的枇杷叶提取液都对胰淀粉酶活力表现出抑制作用,且抑制效果为12 g/L>6 g/L>2 g/L,这说明,枇杷叶可以通过降低淀粉在肠道中的消化率来起到降血糖的作用。
2.6.3 胰脂肪酶活性 根据表6可知,在模拟肠液中,不同浓度的枇杷叶提取液均对胰脂肪酶活力的影响不显著。因此,在所研究范围内,枇杷叶提取液对脂肪的消化吸收无显著影响。
3 讨论
(1)在确定不同浓度的枇杷叶提取液对肠道益生菌的增殖作用时,所选用的方法是比较其对数生长期的生长量,确定对数期的时间范围的依据是肠道益生菌在基础培养基中的生长曲线,因此在不同浓度枇杷叶提取液中肠道益生菌对数期的时间范围会有所差距,這就造成了肠道益生菌在增殖培养基中的生长曲线与上一步所测得的结果有所差距。(2)结合生长曲线图和pH值变化曲线图来看,肠道益生菌在生长曲线出现较大区别时pH值得变化曲线却基本重合,因此基本可以确定枇杷叶提取液没有改变肠道益生菌代谢物中短链脂肪酸的总含量。(3)枇杷叶提取液经体外模拟胃肠道消化后,培养基中出现沉淀物质,绝大部分为不溶于水的胆盐,在测量吸光度时可能会造成一定的误差;胆盐能刺激肠道的蠕动功能,抑制肠道细菌的生长,这也可能是出现抑制作用的原因。根据枇杷叶对消化酶活力影响的试验结果来看,可以推断出由于一定浓度的枇杷叶提取液促进了蛋白酶活力,造成了培养基中营养物质的损失,这也可能是肠道益生菌生长量减少的原因。
4 结论
(1)一定浓度的枇杷叶提取液对单独培养的双歧杆菌有明显的促进作用,浓度为6 g/L的枇杷叶提取液对青春双歧杆菌的增殖作用最显著,浓度为2 g/L的枇杷叶提取液对两歧双歧杆菌的增殖作用最显著。枇杷叶提取液对嗜酸乳杆菌的促进作用不明显。(2)枇杷叶提取液经消化后对肠道益生菌的促生作用明显降低,甚至表现出抑制作用。(3)在代谢产物测定的试验中,试验组中丙酸含量要明显高于对照组,而其他两种酸的含量差别并不明显,因此可以推断枇杷叶可能通过显著增加代谢产物中丙酸的含量达到降血糖的目的。(4)从枇杷叶提取液对消化酶活力影响试验可知,浓度为6 g/L的枇杷叶提取液对蛋白酶活力的促进作用最为显著;3种浓度的枇杷叶提取液对胰脂肪酶活力的影响可以忽略不计;但枇杷叶提取液都对胰淀粉酶活力表现出抑制作用,且抑制效果为:12 g/L>6 g/L>2 g/L,由此也可知,枇杷叶可以通过降低淀粉酶的活性来达到降血糖的目的。◇
参考文献
[1]Alvito P,McClements D J,Karakaya S,et al.A standardised static in vitro digestion method suitable for food-an international consensus[J].Food & Function,2014,5(6):1113-1124.
[2]田芬,陳俊亮,霍贵成.嗜酸乳杆菌和双歧杆菌的主代谢产物分析[J].中国食品学报,2013(6):220-226.
[3]黄群,陈林杰,李彦坡,等.冠突散囊菌黑茶发酵液对消化酶活性影响的研究[J].微生物学通报,2007(5):917-920.
[4]宋星,王婷婷,杨晓丹,等.枇杷叶中含科罗索酸提取物的分离纯化及降血糖活性研究[J].中国新药杂志,2017,26(2):214-219.
[5]Shih C C,Lin C H,Wu J B.Eriobotrya japonica improves hyperlipidemia and reverses insulin resistance in high‐fat‐fed mice[J].Phytotherapy Research,2010,24(12):1769-1780.
[6]Kim J Y,Hong J H,Jung H K,et al.Grape skin and loquat leaf extracts and acai puree have potent anti-atherosclerotic and anti-diabetic activity in vitro and in vivo in hypercholesterolemic zebrafish[J].International Journal of Molecular Medicine,2012,30(3):606-614.
[7]Lü H,Chen J,Li W L,et al.Hypoglycemic and hypolipidemic effects of the total triterpene acid fraction from Folium Eriobotryae[J].Journal of Ethnopharmacology,2009,122(3):486-491.
[8]石学魁,王雅贤,许惠玉,等.几种中草药水煎剂对小鼠肠道菌群的调整作用[J].牡丹江医学院学报,2004(6):7-9.
[9]Zong W,Zhao G.Corosolic acid isolation from the leaves of Eriobotrta japonica showing the effects on carbohydrate metabolism and differentiation of 3T3-L1 adipocytes[J].Asia Pac J Clin Nutr,2007,16(Suppl 1):346-352.
[10]张婷,刘晗璐,邢敬亚,等.乳酸菌微生态制剂对冬毛期北极狐生长性能、营养物质消化率及血清生化指标的影响[J].中国畜牧兽医,2017,44(1):94-99.
[11]翟云,托娅.益生菌的免疫调节作用及其相关应用研究进展[J].中国微生态学杂志,2018,30(2):235-239.
[12]杨小军,侯晓华.益生菌与胃肠道炎症和屏障功能[J].中国医师进修杂志,2007(13):3-5.
[13]赵蓉,李多伟,任涛,等.DNS比色法测定白芸豆中α-淀粉酶抑制剂活性的方法研究[J].中成药,2013(3):573-576.
[14]中华人民共和国国家标准.GB/T23527—2009.蛋白酶制剂[S].
[15]中华人民共和国国家标准.GB/T23535—2009.脂肪酶制剂[S].
[16]王子花,申瑞玲,李文全.短链脂肪酸的产生及作用[J].畜牧兽医科技信息,2007(2):12-13.
Hypoglycemic Effect of Loquat Leaves Based on Intestinal Enzymes and Probiotics
CHEN Rong1,FAN Li-li1,LU Jia-ru1,QI Jing1,SHEN Ying-bin2
(1College of Pharmacy,Guangxi University of Chinese Medicine,Nanning 530200,China;2School of Life Sciences,Guangzhou University,Guangzhou 510006,China)
Abstract:Objective The hypoglycemic effect of loquat leaf extract was discussed by studying the effects of loquat leaf extract on the growth and metabolism of intestinal probiotic bacteria before and after digestion,as well as the effect on digestive enzyme activity.Method The effects of different concentrations of loquat leaf extract on the proliferation of three kinds of intestinal probiotics and the activities of intestinal digestive enzymes were investigated by in vitro experiments.The effect of loquat leaf extract on intestinal probiotics was also discussed.Result A certain concentration of loquat leaf extract had significant promotion effect on the separately cultured bifidobacteria,but it had no significant effect on the growth and metabolism of L.acidophilus.The effect of loquat leaf extract on the intestinal probiotics after digestion was significantly reduced,and even showed inhibitory effect.The content of propionic acid in the metabolites of the experimental group was significantly higher than that of the control group,while the content of the other two acids was not significantly different.The loquat leaf extract with the concentration of 6 g/L had the most significant effect on promoting the activity of protease,however,the three concentrations of loquat leaf extract studied had inhibitory effect on pancreatic amylase activity,while vitality had no significant effect.Conclusion Blood glucose concentration was reduced might due to the amylase activity was inhibited by loquat leaf extract and the propionic acid content in probiotic metabolites was increased.
Keywords:loquat leaf;intestinal probiotics;digestive enzyme;simulated digestion;hypoglycemia
