基于盆腔基线MRI的直肠癌治疗前生存风险预测
2021-10-11赵青张红梅
赵青 张红梅
新辅助放化疗(neoadjuvant chemoradiotherapy,NCRT)联合根治性手术切除的多学科序贯综合治疗模式是目前针对局部进展期直肠癌(locally advanced rectal cancer,LARC:T3~4和/或N1~2期,M0)的标准治疗方法。然而,不同患者的放化疗敏感性不同[1],致使NCRT疗效及远期预后差别显著,尤其对于LARC患者群体中占比最大的T3期患者[2],部分达到完全缓解(cCR)者可实现“等待观察(wait-and-watch)”或局部切除,获得良好预后;而部分疗效差者则可能延误手术时机或增加手术并发症风险[3]。若能在治疗前精准评估上述患者的生存风险,将有利于临床医师制定个体化治疗及随访方案,改善预后。目前,磁共振成像(MRI)是直肠癌的最佳无创检查方法[4]。既往本研究团队已证实MRI可预测直肠癌患者的NCRT疗效[5-7],MRI结合临床及病理信息可预测患者生存情况[8],但NCRT的疗效并不能完全反映患者远期预后,且结合病理的生存预测只能在NCRT及手术之后进行,具有滞后性。
本研究将通过回顾T3期LARC患者基线盆腔MRI特征并进行生存分析,旨在探索影响该患者群体无进展生存(progress free survival,PFS)的治疗前影像学独立危险因素,为精准诊疗提供有效参考。
资料与方法
一、研究对象
本研究经所属机构伦理委员会审核批准并免除知情同意。回顾2008年1月至2012年12月于中国医学科学院肿瘤医院经病理诊断为直肠癌的连续患者临床资料,并进行生存随访。入组标准:(1)临床诊断为T3期LARC,既往未接受过相关治疗,进行NCRT及根治性手术切除;(2)NCRT前一个月内在影像诊断科进行基线盆腔MRI检查;(3)临床资料及随访资料可获取。排除标准:(1)既往接受过直肠癌相关治疗;(2)同期远处转移(术后6个月内)或合并其他恶性肿瘤;(3)未完成既定的NCRT治疗或非根治性治疗;(4)失访。最终共纳入符合标准的T3期LARC患者共157例。
二、治疗
所有入组患者均接受新辅助放化疗,放疗总剂量50~55 Gy,分次剂量1.8~2.0 Gy,共25~28次。同步化疗方案包括5-FU或卡培他滨。手术治疗:患者在新辅助治疗结束后6~8周接受根治性手术治疗,其中腹腔镜腹会阴联合切除术102例,低位前切除术45例,Hartmann's术10例。
三、MR检查方法
使用美国GE公司(Signa HDxt或Signa Excite HD)3.0 TMR扫描仪和8通道相控阵腹部线圈获得MR图像。检查前2~3小时使用10~20 mL开塞露进行肠道清洁。为了减少肠蠕动或痉挛,对除外有禁忌证的患者在检查前20~30分钟行10 mg山莨菪碱肌肉注射。所有患者取俯卧位扫描,常规扫描序列包括(具体参数见表1):斜轴位、矢状位及冠状位T2加权快速自旋回波序列、盆腔轴位T1加权序列及T2加权脂肪抑制序列、弥散加权序列。

表1 盆腔MR扫描序列及参数
四 MR图像分析
将患者的基线盆腔MR图像从扫描系统传输至图像存储与传输(picture achiving and communication system,PACS)工作站,由两名经验丰富的胃肠道肿瘤影像医师在未知病理及随访结果的情况下独立评估影像特征并达成一致意见[9-12]。评价的MRI征象包括(评价标准见表2):肿瘤位置、最长径、最大厚度、最大环周占比、T3亚分期、壁外静脉血管侵犯(extramural venous invasion,EMVI)分级、直肠系膜筋膜(mesorectal fascia,MRF)受累情况、是否为黏液腺癌亚型以及区域/侧方淋巴结转移情况。

表2 MRI征象及评价标准
五、复查随访
所有患者常规在术后第一年每3个月、此后每6个月行临床复查。每次复查包括临床查体、血清学检查、胸腹盆CT检查,若出现可疑转移病灶再进行针对性的MR/PET-CT检查或活检,以明确肿瘤进展(局部复发或远处转移)的诊断。记录患者首次发现肿瘤进展的日期及死亡日期。本研究的随访终点为患者出现肿瘤进展或死亡,末次随访日期为2018年1月31日。
六、统计学方法
应用SPSS 22.0软件进行统计学分析。PFS定义为手术至首次发现肿瘤复发或死亡的日期间隔。若患者在末次随访日期未出现复发或死亡,则认定为删失(censored)病例。基于基线盆腔MR影像特征使用Kaplan-Meier(K-M)曲线法和Cox回归法对患者进行生存分析(P<0.05认定为差异有统计学意义),对于连续变量使用中间值为界将其二分类。使用κ检验及组内相关系数(intraclass correlation coefficient,ICC)评价两位医师一致性。
结 果
一、患者基本资料
研究共纳入符合条件的患者157例,其中男性101例,女性56例,平均年龄(55±12)岁。所有患者均行R0切除。患者的中位随访时间为6.6(3.5~9.8)年,5年内35例出现进展,其中23例为远处转移,12例为局部复发;随访期间共46例出现进展,其中32例为远处转移,14例为局部复发。5年及随访期间累积PFS率分别为77.7%和70.7%。图1~2展示典型的MRI征象。
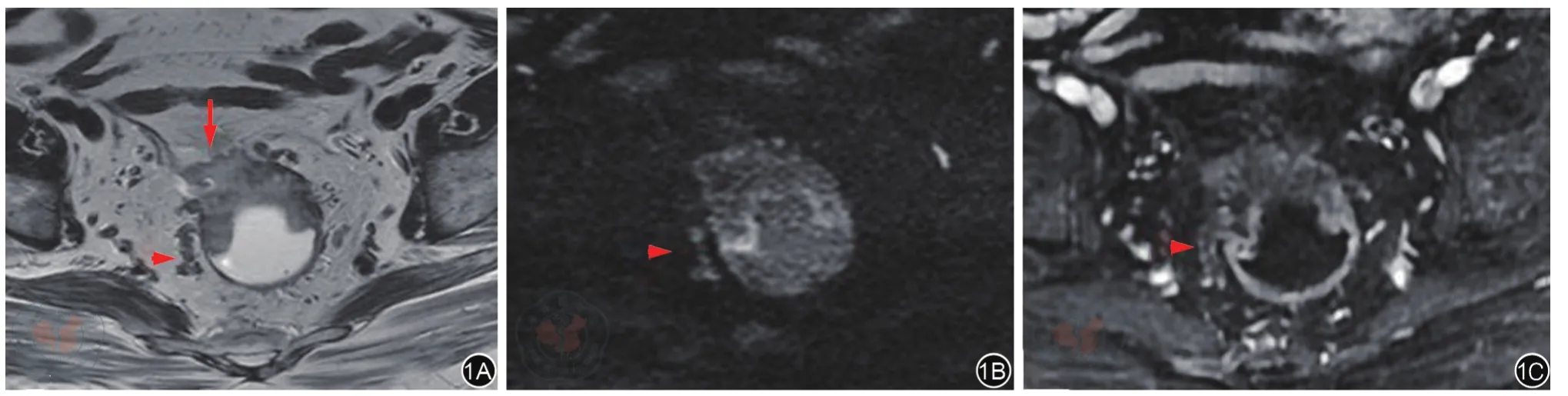
图1 T3c期黏液腺癌,EMVI 4级,MRF(+)。箭头指示肠壁外静脉血管结节状增粗,分别在斜轴位高分辨T2加权图像(图1A)表现为不均匀稍高信号,弥散加权图像(图1B)表现为高信号,T1加权增强扫描静脉期图像(图1C)表现血管内充盈缺损,提示肠壁外血管受肿瘤侵犯,EMVI 4级。图1A箭号提示肿瘤向前外侵累及MRF,表现为MRF凹陷、形态中断。

图2 T3b期非黏液腺癌,EMVI 3级,MRF(-)。箭头指示肠壁外静脉血管僵硬、光滑增粗,斜轴位高分辨T2加权图像(图2A)呈中高信号,T1加权增强扫描静脉期图像(图2B)可见血管内充盈缺损,提示肠壁外血管受肿瘤侵犯,EMVI 3级。EMVI:壁外静脉血管侵犯,MRF:直肠系膜筋膜
二、Kaplan-Meier生存曲线分析
两位医师评价MRI征象具有较高一致性(κ=0.750~0.885,ICC=0.938~0.971)。将患者年龄、性别及MRI征象结合随访的PFS信息进行K-M生存曲线分析(表3),结果显示盆腔基线MRI所反映的肿瘤位置、肿瘤最长径、最大厚度、最大环周比、T3亚分期、EMVI分级、MRF受累情况、黏液腺癌亚型及区域/侧方淋巴结转移情况等均不同程度影响患者的PFS。T3亚分期、EMVI分级及黏液腺癌亚型对PFS影响的K-M曲线见图3。患者年龄及性别均对PFS无显著影响。
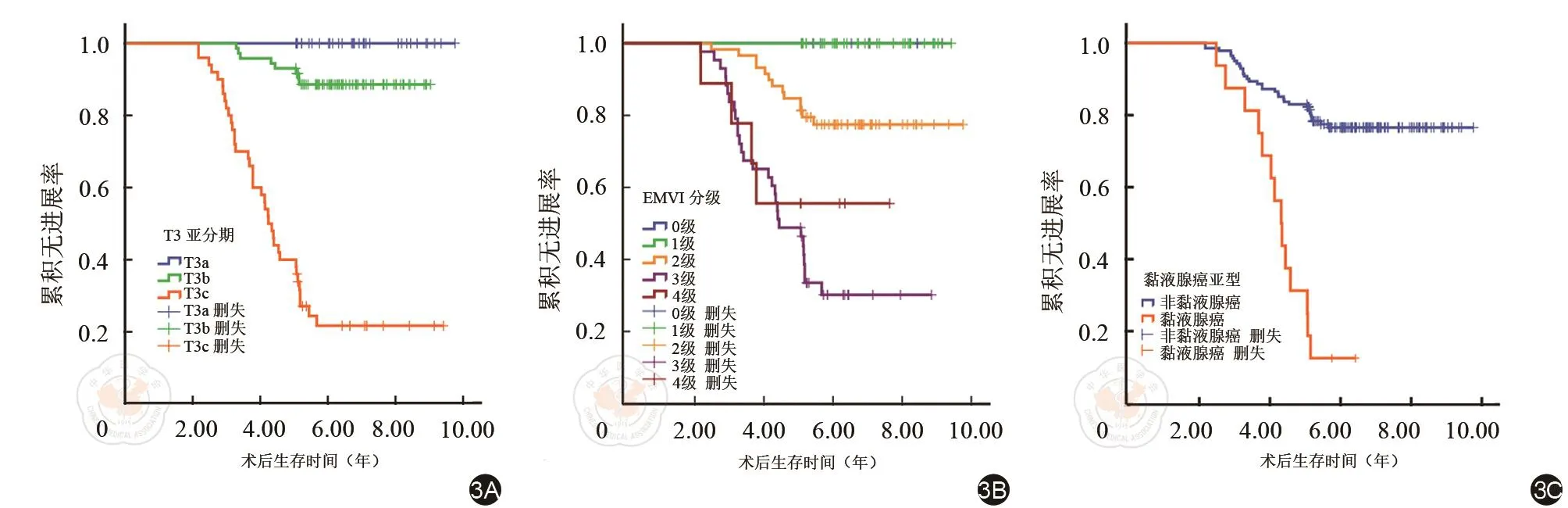
图3 K-M曲线。T3亚分期(3A)、EMVI分级(3B)及黏液腺癌亚型(3C)对PFS影响的K-M曲线,HR分别为13.06,2.88和6.05,P值均小于0.001。EMVI:壁外静脉血管侵犯,PFS:无进展生存期

表3 基于临床信息及MR影像特征的Kaplan-Meier生存分析
三、Cox生存回归
将K-M生存曲线分析中对PFS有显著影响的MR特征进一步纳入Cox回归分析(表4),结果显示在盆腔基线MRI评价的前述征象中,仅T3亚分期(HR=7.36,P<0.001),EMVI分级(HR=2.72,P<0.001)及黏液腺癌亚型(HR=2.36,P=0.024)是影响T3期LARC患者PFS的独立危险因素。

表4 Cox多元回归生存分析
讨 论
本研究通过回顾157例T3期LARC患者的盆腔基线MRI并基于此进行生存分析,证实基线MRI所反映的肿瘤特征与患者的PFS高度相关,且T3亚分期、EMVI分级以及黏液腺癌亚型是影响患者PFS的独立危险因素,其中以T3亚分期的相对风险比最高。因此我们认为应对T3期LARC患者进行全面精准的盆腔基线MRI评估报告,将有助于临床医师在治疗前为患者进行危险分层,制定个体化治疗随访方案,从而改善患者预后。
直肠癌T3亚分期是基于肿瘤壁外浸润深度(extramural depth,EMD)定义的危险分层,目前国际上认可度较高的是欧洲肿瘤内科学会(ESMO)和北美放射学会(RSNA)两种分期方法[9]。由于ESMO分期中将T3a定义为EMD<1 mm,影像评估误差较大,因此本研究采用的是RSNA分期法(T3a:EMD<5 mm;T3b:EMD=5~10 mm;T3c:EMD>10 mm)[13]。既往多项研究表明MRI或病理诊断的T3亚分期对于直肠癌患者(NCRT或直接手术)的远期生存均具有显著影响[13-16],并且将EMD<5 mm视为良好预后的独立影响因素。在本研究纳入Cox多元回归的10个MRI特征中,T3亚分期显示出了最大的独立不良预后效应,其原因可能在于肿瘤外侵范围越大则代谢活性体积越大,潜在的神经血管侵犯越显著,淋巴结转移率及直肠系膜侵犯率越高。K-M曲线显示T3c期患者的术后中位进展时间约为5年,多数T3b和T3c期患者术后出现肿瘤进展时间小于6年。因此对于T3b/c期的LARC患者,更积极的治疗策略以及术后6年内更密切的复查随访尤为重要。本研究中T3a期患者5年PFS率为100%,提示这类“低风险”患者预后良好,对于无其他危险因素者可考虑单纯手术治疗,这也与欧洲MERCURY研究[16]结果相符。
基线MR-EMVI状态对直肠癌患者生存的影响始终存在着争议[17-20]。国内孙应实教授团队[18]通过评价517例接受NCRT的局部进展期直肠癌患者的治疗前后盆腔MRI特征并进行生存分析,证实基线MR-EMVI状态是患者无局部复发、无远处转移生存,以及总生存的独立危险因素。Smith等[17]证实直肠癌患者基线MR-EMVI状态是其无复发生存的独立危险因素,并推断基线MR-EMVI分级可表征患者预后,不论其是否接受NCRT。Lee等[19]的研究中基线MR-EMVI并不影响直肠癌患者预后,但作者提出该回顾性研究结果可能受到其他临床和病理因素混杂效应以及患者群体的异质性、MR图像质量差异影响。本研究将EMVI状态进一步细化为5个评价等级[17],0~2级相当于阴性,3~4级相当于阳性。结果显示基线MR-EMVI分级是T3期LARC患者PFS的独立危险因素,这可能与肿瘤微环境缺氧所致的NCRT敏感性下降、血管重构所致的内皮生长因子高表达以及肿瘤细胞早期经循环扩散有关[18]。K-M曲线显示MR-EMVI阳性患者的中位进展时间约为4~5年,6年内MR-EMVI 2级患者进展率约20%。因此对基线MREMVI阳性及可疑阳性患者(MR-EMVI 2~4级)应予以更积极的治疗和更密切的随访。
黏液腺癌是直肠癌的一种组织学亚型,腺癌组织中含有大量细胞外黏液,并超过肿瘤成分的50%,MRI诊断准确率高[10],相比于活检具有便捷无创的优点。既往研究证实该亚型对于NCRT敏感性差,疗效不显著[21-22]。但其对于患者的生存影响,目前结论尚不统一[23-24]。本研究结果支持基线MRI诊断的直肠黏液腺癌亚型是影响T3期LARC患者PFS的独立危险因素。其原因可能在于黏液腺癌亚型抑癌基因P53表达受抑制,更容易出现微卫星不稳定及KRAS基因突变[23],确诊时通常有更高的T/N分期[24],且粘多糖的免疫干扰效应有助于肿瘤细胞扩散,而黏蛋白的分子屏障效应则阻碍化疗药物与肿瘤接触导致化疗不敏感[23]。我们推荐对盆腔基线MRI进行标准化报告,在既往常规的T分期及EMVI状态描述中进一步细化T3亚分期和EMVI分级,并评估是否为黏液腺癌亚型。
本项研究所涉及的其他基线MR特征均未在多因素分析中显示出独立的预后影响,可能与各危险因素之间的混杂效应有关。直肠癌体积是肿瘤负荷的反映,既往研究证实肿瘤代谢体积越大越易发生血行转移[25]。本研究中表征肿瘤体积的最长径、最大厚度及环周比例均未在多因素回归中显示独立的生存效应,除了混杂因素影响,可能还与直肠空腔结构形态多变、一维径线代表性不足有关。此外,NCRT可能削弱MRF受累对肿瘤复发及远期生存的影响(所有患者均为R0切除);而转移淋巴结的影像诊断标准不统一且准确率较低[4],可能是本研究中淋巴结转移评价不具有显著意义的原因。
本研究的局限性在于,单中心回顾性研究可能对结果造成偏倚,随访时长未达到患者的中位进展时间。未来我们将在此基础上开展多中心前瞻性研究,增加入组样本,延长随访时间,并构建生存预测模型。
综上所述,本研究证实盆腔基线MRI特征可反映T3期LARC患者的生存预后,其中T3亚分期、EMVI分级以及黏液腺癌亚型是影响患者PFS的独立危险因素。我们推荐对T3期LARC患者进行高质量的盆腔基线MR检查及全面精准的分析报告,为临床医师疗前生存危险分层提供参考,促进个体化诊疗,改善患者预后。
