猕猴桃叶斑病病菌生物学特性及室内药剂筛选
2021-09-28张凯东强遥刘冰李邦明赵尚高蒋军喜
张凯东 强遥 刘冰 李邦明 赵尚高 蒋军喜

摘要:为明确奉新县猕猴桃叶斑病病菌(Corynespora cassiicola)生物学特性,并筛选出有效防治药剂,采用菌丝生长速率法,测定其在不同温度、pH值、光照条件、培养基和碳氮源条件下的生长情况,并测定17种杀菌剂对该菌的毒力大小。结果表明,该菌在5~35 ℃内均可生长,其中30 ℃是最适生长温度;pH值范围在3~12时病原菌均可生长,最适生长pH值为6;全光照条件下最有利于病原菌的生长;PDA培养基是病原菌生长的最适培养基;甘露醇、硝酸钾分别为最适碳、氮源。供试的17种杀菌剂对病原菌的生长均有一定的毒力作用,其中50%咪鲜胺锰盐可湿性粉剂(WP)、50%苯甲·丙环唑乳油(EC)、40%氟硅唑EC和50%氟啶胺悬浮剂(SC)具有强毒力,EC50分别为0.157、0.574、0.740、0.783 μg/mL,80%乙蒜素WP和80%福美双水分散粒剂(WG)的毒力最弱,EC50分别为40.437、44.136 μg/mL。
关键词:猕猴桃叶斑病病菌;生物学特性;毒力测定;菌丝生长速率法;药剂筛选
中图分类号: S436.634 文献标志码: A
文章编号:1002-1302(2021)18-0106-05
收稿日期:2020-11-25
基金项目:江西省科技计划(编号:20181ACF60017);国家自然科学基金(编号:31460452)。
作者简介:张凯东(1995—),男,河南新县人,硕士研究生,主要从事分子植物病理学研究。E-mail:2534524603@qq.com。
通信作者:蒋军喜,博士,教授,博士生导师,主要从事植物病害综合治理研究。E-mail:jxau2011@126.com。
猕猴桃(Actinidia spp.)别称奇异果,属猕猴桃科猕猴桃属多年生藤本植物[1],起源于中国。猕猴桃作为一种新兴水果[2],其营养价值高,有“维生素C之王”的美誉,深受人们的喜爱。江西省奉新县是猕猴桃的主要种植区,种植面积目前约3 333 hm2,猕猴桃产业对当地经济发展有举足轻重的作用。近年来,江西省奉新县猕猴桃种植区发现一种新的猕猴桃叶部病害,病叶初期出现深褐色圆形小斑,后期形成外围呈深褐色,中央呈灰白色并具有轮纹状的圆形大病斑,严重时多个病斑会连成一片,造成早期大面积落叶,影响果实的正常成熟。
江西省奉新县猕猴桃叶斑病的病原鉴定已有过报道,其病原被鉴定为半知菌类棒孢属中的多主棒孢(Corynespora cassiicola)[3]。多主棒孢是一种重要的植物病原菌[4],其寄主范围广,症状类型多样,生理小种复杂[5],常常侵染植物叶片,也可侵染寄主的花、果实、茎、根[6-7]。目前奉新地区由多主棒孢(C. cassiicola)引起的猕猴桃叶斑病不断加重,其中红阳、东红、脐红、晚红等红心猕猴桃品种易被侵染,严重影响了当地猕猴桃产业的发展。目前关于该地区病原菌的生物学特性和杀菌剂筛选研究尚未见报道。本研究对奉新县猕猴桃叶斑病病菌开展生物学特性测定及杀菌剂筛选,旨在掌握该地区病原菌的生长特性,并筛选出具有良好防治效果的化学药剂,以期为江西省奉新县猕猴桃叶斑病的综合治理提供理论依据。
1 材料与方法
1.1 供试材料
供试菌株为奉新猕猴桃叶斑病病菌菌株SK-4(Corynespora cassiicola),于2019年11月由江西农业大学植物病理学实验室分离、鉴定并保存。
供试培养基为马铃薯葡萄糖琼脂(PDA)培养基、燕麦片琼脂(OMA)培养基、玉米片琼脂(CMA)培养基、苜蓿煎汁(AEA)培养基、烟草煎汁(TEA)培养基、胡萝卜(CA)培养基、查氏(Czapek)培养基、牛肉浸膏蛋白胨(NA)培养基、水琼脂(WA)培养基、红阳猕猴桃叶煎汁培养基等10种,配方参照文献[8]。
供试药剂信息见表1。
1.2 试验时间
本试验于2020年6—9月在江西农业大学植物病理学实验室进行。
1.3 病原菌生物学特性研究
1.3.1 温度对病原菌生长速率的影响
取直径为5 mm的适龄菌饼接种到PDA培养基平板中央,置于不同温度(5、10、15、20、25、30、35 ℃)的恒温培养箱中培养,每个温度重复3次,培养6 d后采用十字交叉法[9]测量菌落直径,并计算病原菌在不同温度下的生长速率。
生长速率=(菌落直径-菌饼直径)/生长时间。
1.3.2 不同pH值对病原菌生长速率的影响
用 1 mol/L HCl和1 mol/L NaOH将PDA培養基的pH值分别调为3、4、5、6、7、8、9、10、11、12,将直径为 5 mm 的适龄菌饼接种到PDA培养基平板中央,置于 30 ℃ 恒温培养箱中培养6 d。处理和观察方法同“1.3.1”节。
1.3.3 不同光照条件对病原菌生长速率的影响
将接菌的PDA培养基平板分别置于全光照、全黑暗和光—暗交替(12 h—12 h)的3种不同光照处理下,30 ℃恒温培养6 d。处理和观察方法同“1.3.1”节。
1.3.4 不同培养基对病原菌生长速率的影响
取直径为5 mm的适龄菌饼接种到PDA、OMA、CMA、AEA、TEA、CA、Czapek、NA、WA、红阳猕猴桃叶煎汁培养基平板中央,置于30 ℃恒温培养箱中培养6 d。处理和观察方法同“1.3.1”节。
1.3.5 不同碳、氮源对病原菌生长速率的影响
以Czapek培养基为基础培养基,以等量的葡萄糖、可溶性淀粉、α-乳糖、麦芽糖、甘露醇、山梨醇、纤维二糖和甜醇替换蔗糖,配制9种不同碳源培养基;同理以等量的硝酸钾、磷酸二氢铵、牛肉膏、蛋白胨、酵母膏、硝酸铵和氯化铵替换硝酸钠,配制8种不同氮源培养基[10]。取直径为5 mm的适龄菌饼接种到含不同碳、氮源的培养基平板中央,置于30 ℃恒温培养箱中培养6 d,处理和观察方法同“1.3.1”节。
1.4 病原菌室内药剂筛选
采用菌丝生长速率法测定17种杀菌剂对猕猴桃叶斑病病菌(C. cassiicola)的抑菌作用。用无菌水将每种药剂梯度稀释为9个不同浓度的药液,用移液枪吸取1 mL药液与已融化冷却至60 ℃的 9 mL PDA培养基混匀配制成含不同浓度(1.0×103、2.5×102、6.3×101、1.6×101、3.9×100、1.0×100、2.4×10-1、6.1×10-2、1.5×10-2 μg/mL)药剂的PDA培养基平板[11],并设不含药剂的PDA培养基平板作为对照。取直径为5 mm的适龄菌饼接种到各处理PDA培养基平板中央,每个处理重复3次,接菌后置于30 ℃恒温培养箱中培养6 d后用十字交叉法测量菌落直径,并计算抑菌率。用SPSS 21.0软件统计分析,计算得出毒力回归方程、半最大效应浓度(EC50)和决定系数(r2),根据EC50评价杀菌剂的抑菌效果。
抑菌率=对照组菌落直径-处理组菌落直径对照组菌落直径-菌饼直径×100%。
1.5 数据处理与分析
采用Excel 2016和SPSS 21.0软件进行数据处理,采用Duncans新复极差法进行差异显著性检验。
2 结果与分析
2.1 病原菌的生物学特性研究
2.1.1 不同温度对病原菌生长速率的影响
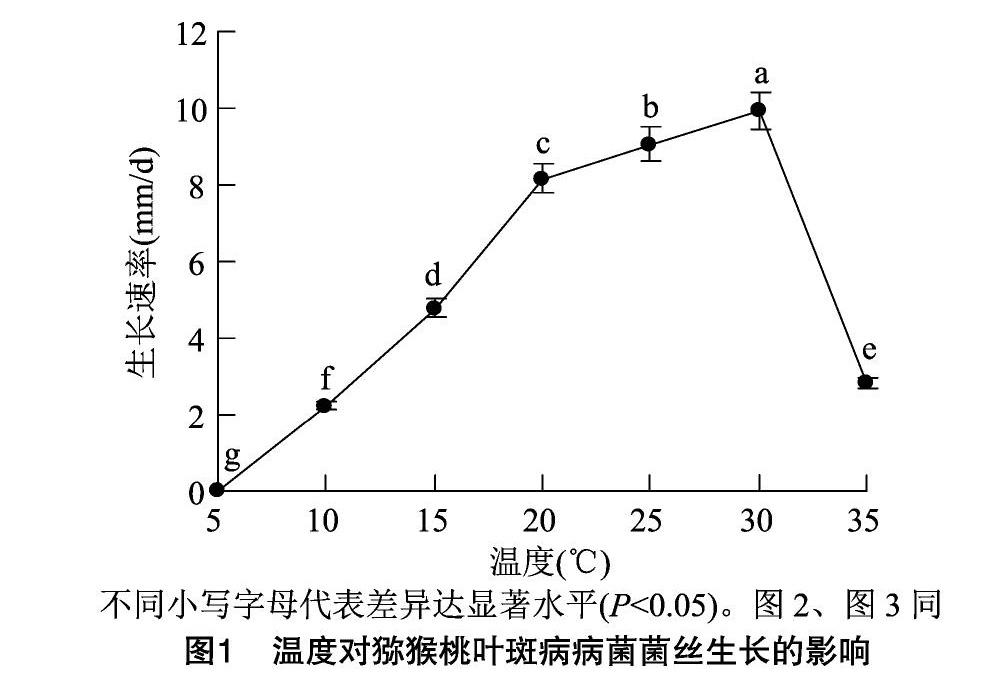
由图1可知,猕猴桃叶斑病病菌在20~30 ℃时生长较快,30 ℃时生长最快,此时病菌生长速率达 9.94 mm/d;10、15、35 ℃时病菌生长均较慢,5 ℃ 时病菌则停止生长。
2.1.2 不同pH值对病原菌生长速率的影响
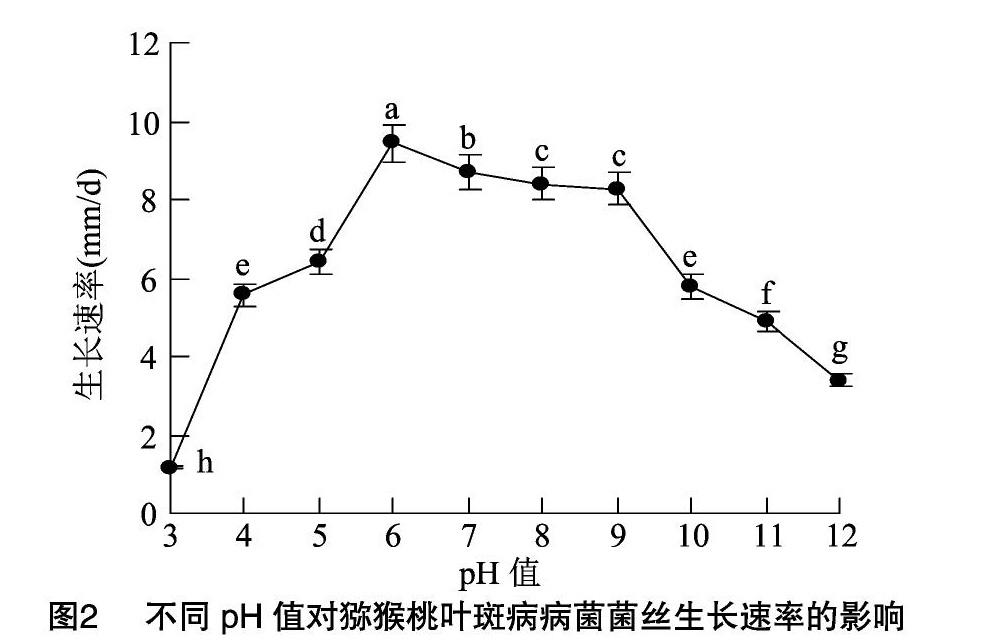
由图2可知,pH值为3~12时,猕猴桃叶斑病病菌均能生长,但以pH值为6~9时菌丝生长较快,pH值为6时菌丝生长最快,此时菌丝生长速率达 9.44 mm/d,其他pH值时菌丝生长均较慢。
2.1.3 不同光照条件对病原菌生长速率的影响
由图3可知,病原菌在3种不同的光照条件下生长均较快,但以全光照条件下生长最快,菌丝生长速率为9.78 mm/d,全黑暗条件下生长最慢,菌丝生长速率为8.83 mm/d,表明全光照条件最适宜该病菌生长。
2.1.4 不同培养基对病原菌生长速率的影响
由表2可知,病原菌在10种不同培养基上的生长情况各不相同,其中在PDA培养基上的生长速率最高,达 9.50 mm/d,为病原菌的最适生长培养基,其次是AEA培养基,病原菌的生长速率达9.00 mm/d。病原菌在WA培养基上生长最为缓慢,菌丝稀疏,生长速率仅为6.78 mm/d,不适宜该病菌的生长。
2.1.5 不同碳源对病原菌生长速率的影响
由表3可知,病原菌在9种不同碳源培养基上均能正常生长,但生长速率有显著差异。其中病原菌在甘露醇上生长最快,为最适碳源,生长速率为11.39 mm/d,山梨醇和葡萄糖次之,病原菌在可溶性淀粉和甜醇上生长最慢,生长速率仅分别为8.39、8.22 mm/d。
2.1.6 不同氮源对病原菌生长速率的影响
由表4可知,病原菌在以硝酸钾和蛋白胨为氮源的培养基上生长最快,其生长速率分别为9.17、9.11 mm/d,显著高于其他6种氮源培养基,硝酸钠次之,病原菌在磷酸二氢铵上生长最为缓慢且菌丝稀疏,生长速率仅为2.89 mm/d。
2.2 17种杀菌剂对病原菌的室内毒力测定
由表5可知,17种杀菌剂对病原菌菌丝生长存在不同的抑制作用,药剂的EC50范围为0.157~44.136 μg/mL。其中50%咪鲜胺锰盐WP、50%苯甲·丙环唑EC、40%氟硅唑EC、50%氟啶胺SC的毒力作用强,其EC50均小于1 μg/mL,分别为0.157、0.574、0.740、0.783 μg/mL;其次是75%戊唑·肟菌酯WG、75%戊唑·嘧菌酯WG、19%啶氧·丙环唑SC、43%戊唑醇SC、12%中生菌素WP和60%吡唑·代森联WG,这6种药剂的EC50在 1~10 μg/mL 范围内。50%异菌脲SC、40%嘧霉胺SC、80%乙蒜素WP和80%福美双WG的毒力作用较弱,其EC50均大于28 μg/mL。
3 结论与讨论
病原菌的生物学特性测定和化学药剂筛选是植物病害研究的重要内容。本研究明确了奉新县猕猴桃叶斑病病菌生长最适宜的温度、pH值、光照条件、培养基、碳氮源条件,并筛选到10多種有效药剂,这为该病害发生规律和防治研究奠定了较好的工作基础。本研究结果表明,奉新县猕猴桃叶斑病病菌在25~30 ℃条件下适宜生长,最适生长温度为30 ℃,病原菌生长的最适pH值为6,最适培养基为PDA培养基,全光照最有利于该病菌的生长,甘露醇和硝酸钾分别为最适碳、氮源。崔永亮对四川省猕猴桃褐斑病病菌的生物学特性测定结果显示,病菌最适生长温度范围为25~30 ℃,最适pH值为6,不同光照条件对病菌的生长影响不明显,最适培养基为PSA培养基[12];杨绍丽等对黄瓜靶斑病病菌的测定结果显示,病菌最适生长温度为 30 ℃,最适pH值为8,全光照有利于病菌生长,麦芽糖和硝酸钾分别为最适碳、氮源[13];陈旭玉等对广藿香棒孢霉叶斑病病菌的测定结果表明,病菌最适生长温度为28 ℃,最适pH值为6,全光照或光暗交替有利于菌丝生长[14];番华彩等对香蕉棒孢霉叶斑病菌的测定结果显示,病菌最适生长温度为 28 ℃,最适pH值为7,全黑暗条件下病原菌菌丝生长最快,乳糖和甘露醇、蛋白胨为最适碳、氮源[15];李俊香等对甜瓜靶斑病病菌的测定结果显示,病菌最适生长温度为 27 ℃,最适pH值为7,葡萄糖和硝酸钾分别为最适碳、氮源[16]。不同研究者的研究结果表明,来源于不同寄主的的多主棒孢菌生物学特性存在差异,这可能与生理小种间的差异和寄主植物不同有关[17]。
17种药剂的室内毒力试验结果表明,50%咪鲜胺锰盐WP、50%苯甲·丙环唑EC、40%氟硅唑EC和50%氟啶胺SC对奉新县猕猴桃叶斑病病菌具有较强毒力,EC50分别为0.157、0.574、0.740、0.783 μg/mL。这4种杀菌剂对其他植物多主棒孢叶斑病病菌也表现为强烈的抑菌效果。李俊香等对甜瓜靶斑病病菌的室内毒力试验结果表明,咪鲜胺锰盐的毒力作用最强,EC50为0.609 μg/mL[18];王进强等对橡胶树棒孢霉落叶病菌的毒力测定发现,苯甲·丙环唑和氟硅唑具有较好的毒力效果,EC50分别为0.620、0.760 μg/mL[19];Li等对黄瓜靶斑病防治药剂的筛选试验结果表明,氟啶胺具有较强的毒力作用,EC50为0.213 μg/mL[20]。本试验中药剂筛选结果是药剂在室内与病原菌菌丝直接接触而产生的抑菌效果,并不能完全代表其田间实际防效,药剂在田间的防效还受到来自寄主植物、病菌及环境条件的综合影响[21]。因此,要确定奉新县猕猴桃叶斑病最适防治药剂,尚有待于进一步的田间药效试验。
参考文献:
[1]徐小彪,张秋明. 中国猕猴桃种质资源的研究与利用[J]. 植物学通报,2003,20(6):648-655.
[2]张计育,莫正海,黄胜男,等. 21世纪以来世界猕猴桃产业发展以及中国猕猴桃贸易与国际竞争力分析[J]. 中国农学通报,2014,30(23):48-55.
[3]秦双林,王园秀,蒋军喜,等. 江西奉新县猕猴桃叶斑病病原菌鉴定[J]. 江西农业大学学报,2016,38(3):488-491.
[4] 李宝聚,高 苇,石延霞,等. 多主棒孢和棒孢叶斑病的研究进展[J]. 植物保护学报,2012,39(2):171-176.
[5]李博勋,冯艳丽,刘先宝,等. 我国热带作物多主棒孢种群多样性及致病力分化分析[J]. 热带作物学报,2019,40(12):2456-2465.
[6]Silva W K,Multani D S,Deverall B J,et al. RFLP and RAPD analyses in the identification and differentiation of isolates of the leaf spot fungus Corynespora cassiicola[J]. Australian Journal of Botany,1995,43(6):609-618.
[7]Silva W K,Wijesundera R C,Karunanayake E H,et al. New hosts of Corynespora cassiicola in Sri Lanka[J]. Plant Disease,2000,84(2):202.
[8]方中達. 植病研究法[M]. 北京:中国农业出版社,1998.
[9]田守波,朱为民,朱龙英,等. 番茄棒孢叶斑病病原鉴定及生物学特性研究[J]. 植物保护,2020,46(3):157-162,166.
[10]李 诚,王 禄,蒋军喜,等. 猕猴桃果实熟腐病菌生物学特性及其寄主抗病性鉴定研究[J]. 江西农业大学学报,2014,36(5):1061-1065.
[11]周 英. 奉新猕猴桃3种真菌病害病原鉴定、生物学特性及药剂筛选研究[D]. 南昌:江西农业大学,2019.
[12]崔永亮. 猴桃褐斑病的研究[D]. 雅安:四川农业大学,2015.
[13]杨绍丽,吴仁锋,马晓龙,等. 武汉地区黄瓜靶斑病病原鉴定及生物学特性研究[J]. 长江蔬菜,2015(4):58-61.
[14]陈旭玉,甘炳春,隋 春,等. 广藿香棒孢霉叶斑病病原菌生物学特性及药剂筛选[J]. 农药,2012,51(3):215-217,221.
[15]番华彩,郭志祥,白亭亭,等. 香蕉棒孢霉叶斑病病原菌生物学特性测定[J]. 南方农业学报,2018,49(3):481-487.
[16]李俊香,洪 霓,古勤生. 甜瓜靶斑病病原菌的生物学特性[J]. 中国瓜菜,2019,32(10):11-17.
[17]秦小芳,霍 行,周 琼,等. 白及疫病病原菌的生物学特性及侵染特性测定[J]. 湖南农业科学,2020(8):47-51.
[18]李俊香,洪 霓,古勤生.22种杀菌剂对甜瓜靶斑病菌的室内毒力测试[J]. 中国瓜菜,2018,31(9):13-16.
[19]王进强,张春霞,何明霞,等. 几种杀菌剂对橡胶树多主棒孢的毒力测定[J]. 农药,2010,49(7):524-526.
[20]Li T,Xiu Q,Zhang J,et al. Pharmacological characteristics and efficacy of fluazinam against Corynespora cassiicola,causing cucumber target spot in greenhouses[J]. Plant Disease,2020,104(9):2449-2454.
[21]蒋 妮,宋利沙,陈乾平,等. 罗汉果斑枯病菌主要生物学特性及防治药剂筛选[J]. 江苏农业科学,2019,47(24):78-81.
