黄芪多糖联合格列美脲对链脲佐菌素诱导的糖尿病小鼠认知功能障碍的保护作用
2021-09-27吴坚付瑛
吴坚,付瑛
1.赣州市人民医院,江西 赣州 341000;2.青岛市市立医院,山东 青岛 266500
糖尿病是一种长期血糖水平增高为特征的代谢性疾病,由于胰岛素绝对或相对不足及靶细胞对胰岛素敏感性降低引起的代谢紊乱综合征,常伴严重的并发症,严重影响着人们的生活质量。糖尿病中枢神经系统并发症是糖尿病常见并发症之一,可导致患者认知功能障碍,甚至发展为痴呆[1-2]。相关资料显示,60%~70%的糖尿病患者在疾病晚期存在不同程度认知功能障碍,但其导致认知功能障碍的神经内分泌机制尚不明了[3]。糖尿病认知功能障碍患者常表现为学习、记忆功能的减退,导致生活、社交及工作能力的降低甚至丧失,因此如何预防或延缓糖尿病认知功能障碍的发生具有重要意义。黄芪多糖是黄芪的主要活性成分之一,具有双向调节血糖的作用,可通过调节机体细胞免疫、体液免疫及细胞因子活性在糖尿病及其并发症治疗中发挥着重要作用,并可通过多途径延缓糖尿病并发症的发生发展[4]。格列美脲是新型第三代磺酰脲类降糖药,可刺激胰岛素分泌和释放,改善胰岛素抵抗,还可促进肌肉组织对外周葡萄糖的摄取,降低血糖[5]。本研究分析黄芪多糖联合格列美脲对糖尿病小鼠认知功能障碍的保护作用。
1 材料与方法
1.1 实验试剂与仪器
链脲佐菌素(上海明萱生物科技有限公司);黄芪多糖(上海韵泰信息科技有限公司);格列美脲(北京伊塔生物科技有限公司);戊巴比妥钠(中国医药集团上海化学试剂公司);DAB 显色试剂盒(北京伊塔生物科技有限公司);RIPA 裂解液(哈尔滨新海基因检测有限公司);MDA 试剂盒(上海江莱生物科技有限公司);SOD 试剂盒(上海广锐生物科技有限公司);葡萄糖测定试剂盒(艾美捷科技有限公司)。
高压蒸汽灭菌器(北京佳源兴业科技有限公司);恒温水浴箱(上海辅泽商贸有限公司);台式冷冻离心机(杭州诺丁科学器材有限公司);凝胶图像处理系统(上海辅泽商贸有限公司);全自动酶标仪(北京安麦格贸易有限公司);磁力搅拌器(北京益奥柏科贸有限公司);荧光正置显微镜(广州科适特科学仪器有限公司);Morris 水迷宫(上海玉研科学仪器有限公司);脑立体定位仪(深圳市瑞沃德生命科技有限公司);全自动生化分析仪(上海帝博思生物科技有限公司)。
1.2 实验动物造模及分组
选取雄性SPF 级ICR 小鼠40 只,6~8 周龄,体质量18~22 g,购于北京维通利华动物实验技术有限公司,所有动物实验均遵循国家动物饲养和使用指南,饲养于动物实验中心7 d,自由饮水摄食以适应周围实验环境。随机选取10 只小鼠为正常对照组,其余小鼠采用高脂饲料喂养4 周后,给予小剂量链脲佐菌素(STZ)40 mg/kg 腹腔注射,建立糖尿病小鼠模型,72 h 检测小鼠空腹血糖≥13.88 mmol/L 即为造模成功。将造模成功的小鼠随机分为模型组、格列美脲组、黄芪多糖联合格列美脲组(联合组),格列美脲组给予灌胃给药0.5 mg·kg-1·d-1,联合组给予灌胃给药黄芪多糖400 mg·kg-1·d-1、格列美脲0.5 mg·kg-1·d-1;正常对照组和模型组给予生理盐水灌胃,连续6 周。
1.3 检测方法
(1)体质量、空腹血糖:连续给药6 周后,测定小鼠体质量和空腹血糖,计算每组小鼠平均体质量和空腹血糖。(2)Morris 水迷宫实验:水迷宫为150 cm×50 cm×30 cm 的圆形水池,分为4 个象限,在距池壁一定距离的池内任何一个象限,在水面以下2 cm 处放置一个直径10 cm 的平台,并在水中加入墨汁,防止动物在清水下看平台。隐藏平台实验:每只小鼠分别从不同象限面朝池壁入水,记录寻找平台的逃逸潜伏期,并考察其学习能力。记录时间为90 s,如果在90 s 内没有发现平台,则将小鼠引导至平台并熟悉平台20 s。空间探索实验:取下平台后,将小鼠从平台对侧入水点放入水池,记录小鼠在90 s 内穿越平台次数,测试其记忆能力。(3)透射电镜:10%水合氯醛麻醉小鼠,收集胰腺尾部和海马组织,切成1 mm×1 mm×1 mm 大小,置于2.5%戊二醛中固定,组织经梯度脱水后用环氧树脂固定。超薄切片经200 目筛,用醋酸双氧铀和醋酸铅染色,透射电镜观察各组小鼠胰岛β 细胞、海马组织神经元超微结构。(4)海马组织葡萄糖依赖性促胰岛素多肽(glucose dependent insulinotropic peptide,GIP)和胰高血糖素样肽-1(gucagon like peptide-1,GLP-1)检测:根据默克密理博Milliplex MAP 试剂盒说明检测各组小鼠海马组织GIP、GLP-1 含量。(5)脑组织超氧化物歧化酶(superoxide dismutase,SOD)活力和丙二醛(malondialdehyde,MDA)含量:采用硫酸巴比妥法检测各组小鼠脑组织SOD 活力、黄嘌呤氧化酶法检测MDA 含量。
1.4 统计学方法
本研究数据均采用SPSS 21.0 软件进行分析,计量数据均采用表示,采用单因素方差分析多组间数据的比较,两组间数据比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 各组小鼠体质量、血糖的变化比较
给药处理后,格列美脲组、联合组小鼠体质量较模型组明显升高,空腹血糖较模型组明显降低,差异有统计学意义(P<0.05),且联合组小鼠体质量明显高于格列美脲组、空腹血糖明显低于格列美脲组(P<0.05),见表1。
表1 各组小鼠体质量、血糖的变化比较()
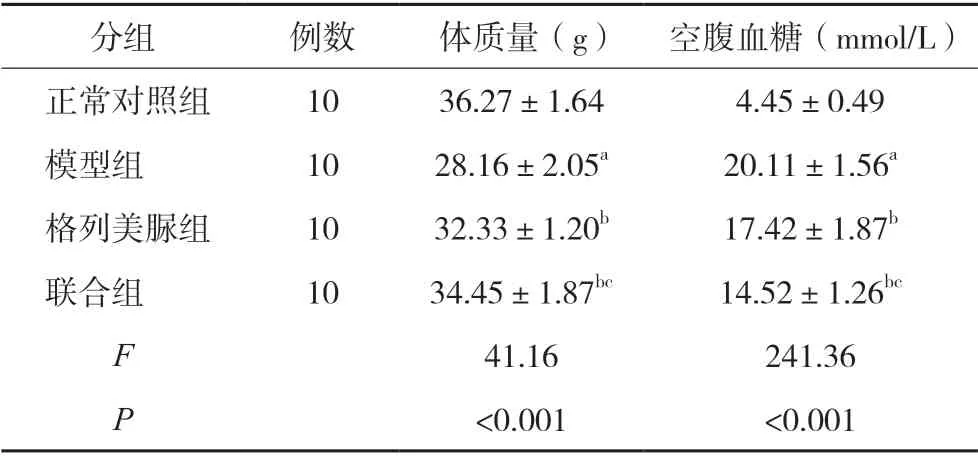
表1 各组小鼠体质量、血糖的变化比较()
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与格列美脲组比较,cP<0.05。
2.2 各组小鼠空间学习记忆能力比较
Morris 水迷宫实验显示,自第4 天开始格列美脲组、联合组小鼠逃避潜伏期明显短于模型组,差异有统计学意义(P<0.05);格列美脲组、联合组小鼠穿越平台次数明显高于模型组(P<0.05),且联合组明显高于格列美脲组(P<0.05)。见图1、2。
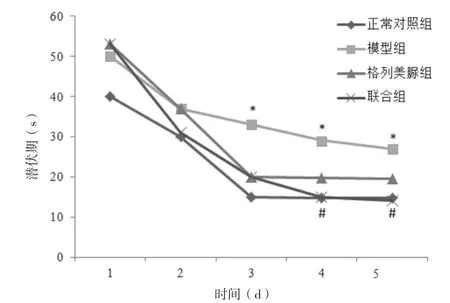
图1 各组小鼠逃避潜伏期
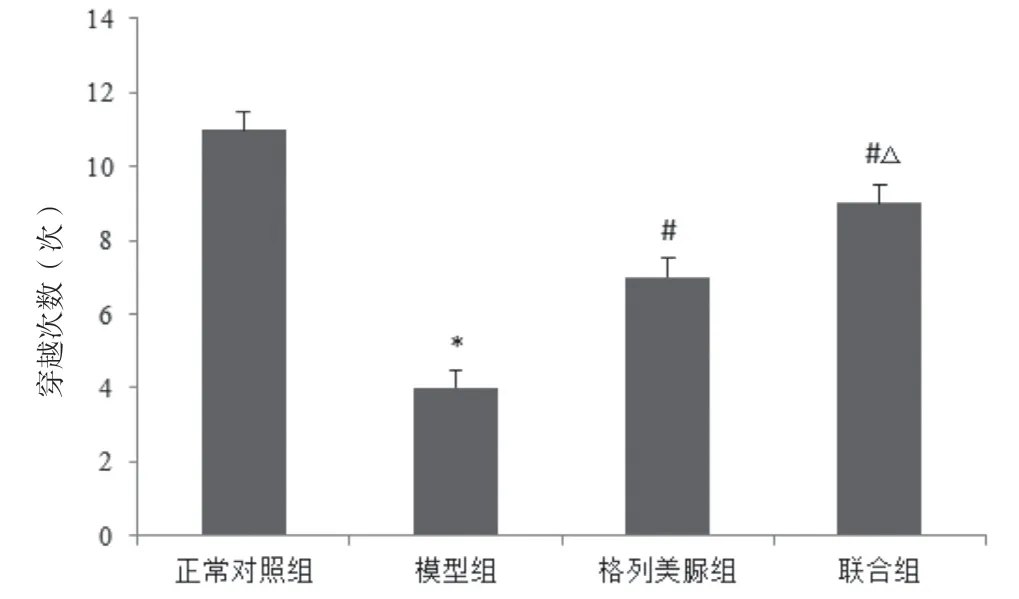
图2 各组小鼠穿越平台次数
2.3 各组小鼠胰岛β 细胞超微结构的变化比较
透射电镜下观察发现,正常对照组胰岛β 细胞含丰富的胰岛素分泌颗粒,核膜完整,核染色质分布均匀;模型组胰岛β 细胞分泌颗粒减少,线粒体嵴断裂,空泡现象增多;格列美脲组可见少量胰岛β 细胞粗面型内质网扩张及空泡现象;联合组胰岛β 细胞胞质内粗面型内质网及核糖体较为丰富,可见较多分泌颗粒,核染色质分布均匀。见图3。
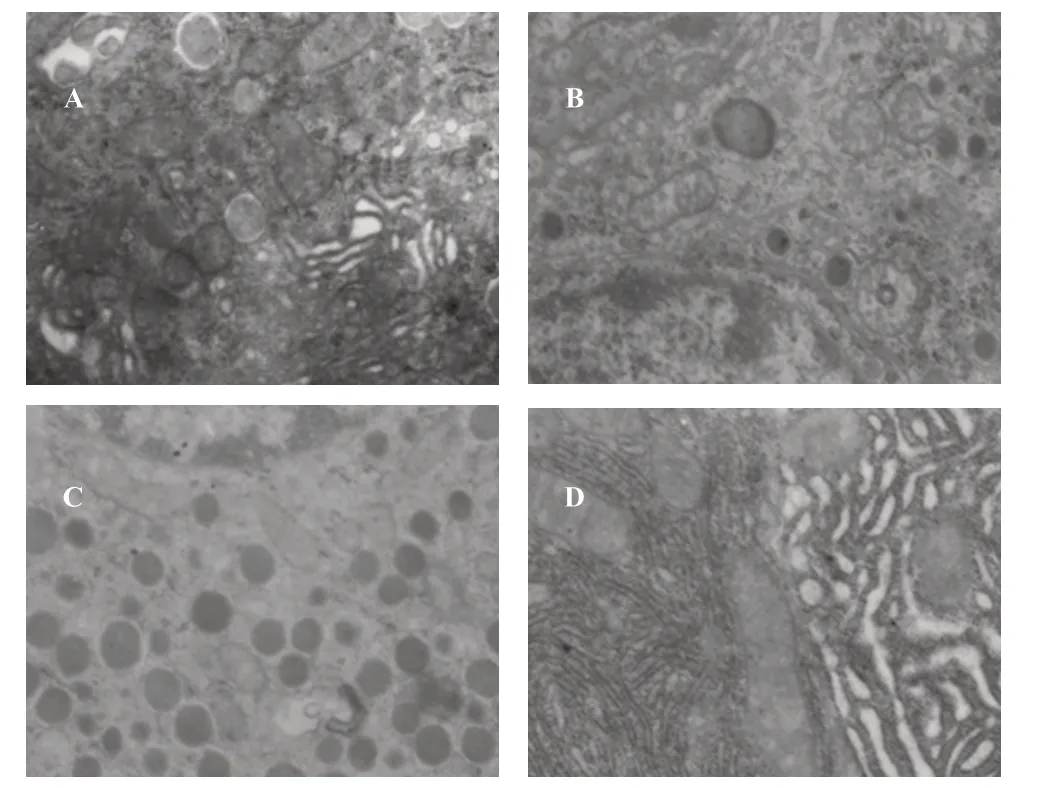
图3 透射电镜下观察胰岛β细胞超微结构(400倍镜)
2.4 各组小鼠海马神经元超微结构变化比较
正常对照组海马神经元核膜清晰,常染色质丰富,核质均匀,线粒体膜光滑,嵴板状或管泡状;模型组细胞膜不规则,染色质凝集,细胞质溶解,变性线粒体、膜不清,嵴致密;格列美脲组细胞膜断续不明显,核膜部分规整,有常染色质分布,有的嵴断裂,局部呈空泡状;联合组细胞膜连续,核膜完整,常染色质较多且均匀,线粒体大小不等,嵴断裂呈空泡状。见图4。
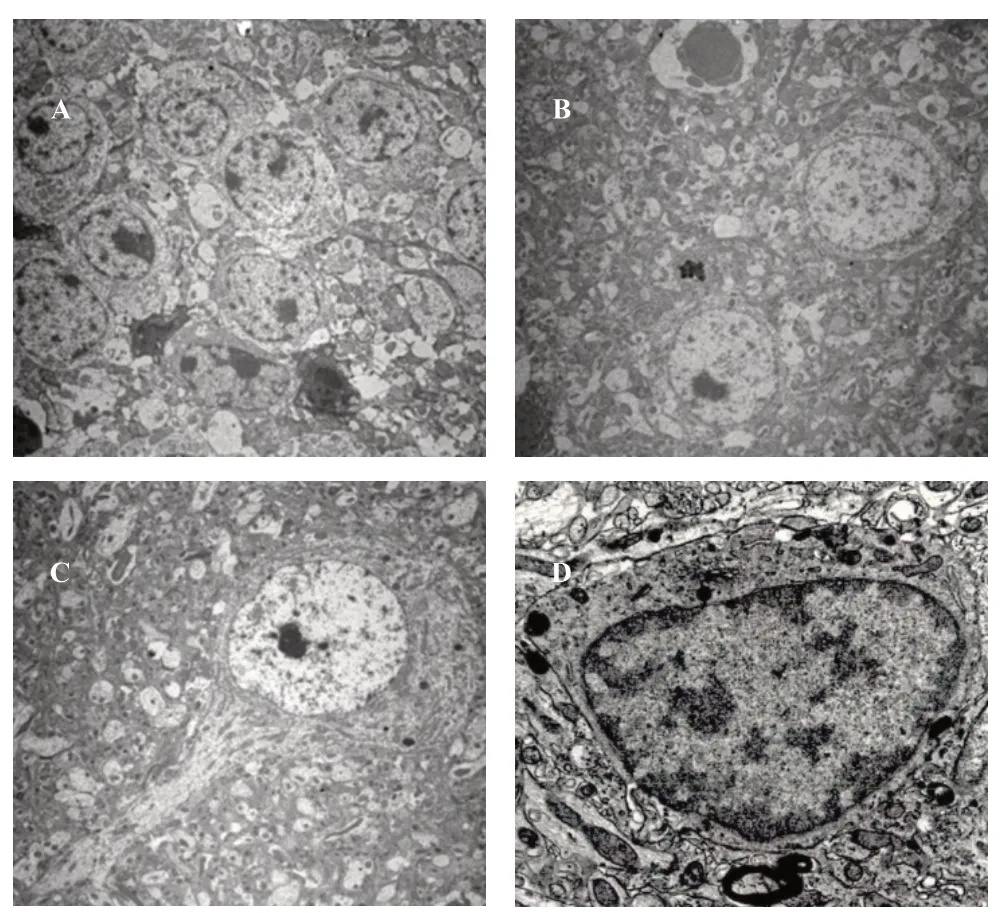
图4 透射电镜下观察海马神经元超微结构(400倍镜)
2.5 各组小鼠海马组织中GIP、GLP-1 的含量比较
模型组小鼠海马组织中GIP、GLP-1 含量明显低于正常对照组(P<0.05),格列美脲组、联合组小鼠海马组织中GIP、GLP-1 含量明显高于模型组(P<0.05),且联合组明显高于格列美脲组,差异有统计学意义(P<0.05)。见表2。
表2 各组小鼠海马组织中GIP、GLP-1的含量比较(pg/mg,)
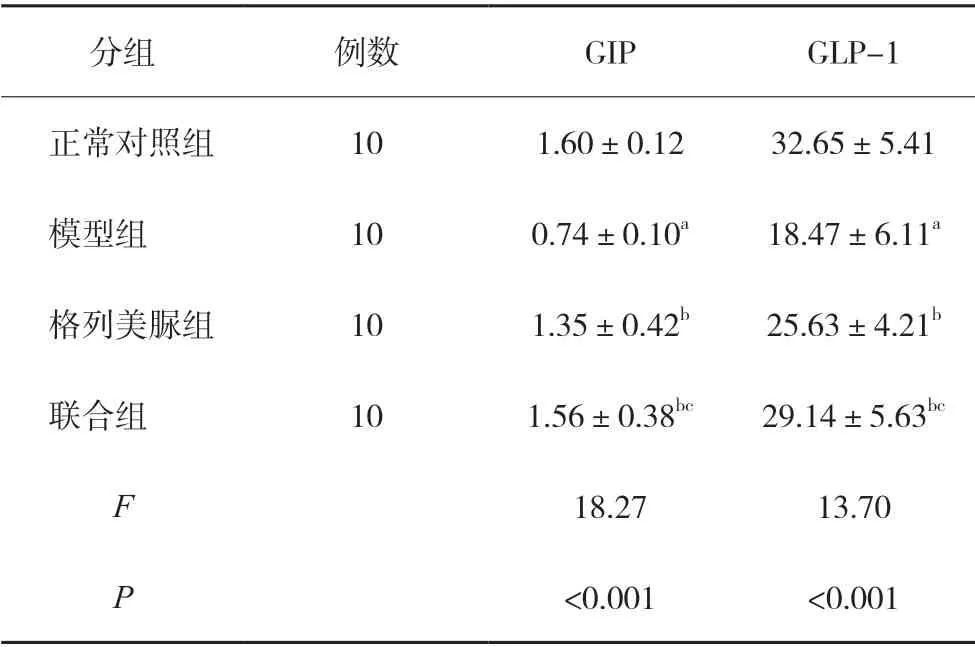
表2 各组小鼠海马组织中GIP、GLP-1的含量比较(pg/mg,)
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与格列美脲组比较,cP<0.05。
2.6 各组小鼠脑组织中MDA、SOD 含量比较
模型组小鼠脑组织中MDA 含量明显高于正常对照组、SOD 活性低于正常对照组(P<0.05),格列美脲组、联合组小鼠脑组织中MDA 含量明显低于模型组、SOD 活性高于模型组(P<0.05),联合组对MDA、SOD 改善明显优于格列美脲组(P<0.05)。见表3。
表3 各组小鼠脑组织中MDA、SOD含量比较()
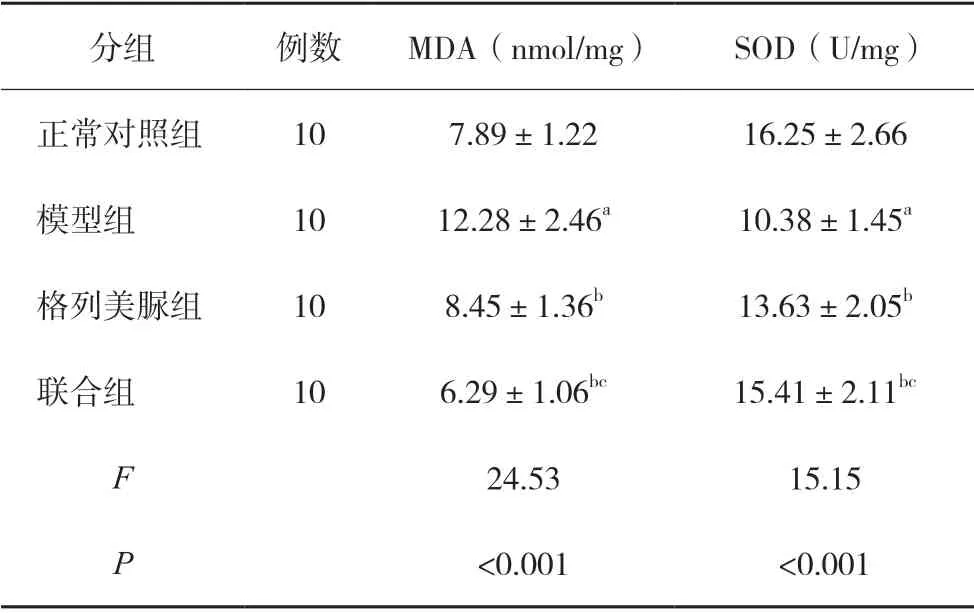
表3 各组小鼠脑组织中MDA、SOD含量比较()
注:与正常对照组比较,aP<0.05;与模型组比较,bP<0.05;与格列美脲组比较,cP<0.05。
3 讨论
糖尿病是引发认知功能障碍的独立危险因素,但具体发病机制尚不清楚,其中代谢异常、高血糖、胰岛素信号通路异常、内质网应激、神经元钙稳态失衡和突触可塑性。血脑屏障损伤等均参与其中,组成了复杂的发病机制。黄芪多糖是黄芪的重要成分,具有增强免疫、抗炎及降血糖等多种药理作用[6-7]。已有研究证实用于糖尿病及并发症中黄芪多糖具有改善胰岛素抵抗、减轻机体内氧化应激水平、调节机体免疫功能等多种作用[8]。临床上,黄芪多糖可通过改善糖代谢,降低转化生长因子β1来治疗糖尿病肾病;并可增强肿瘤放化疗患者的免疫力,起到辅助治疗的作用[9]。有学者通过研究发现,黄芪多糖可显著提高2 型糖尿大鼠胰岛素敏感性,降低胰岛素抵抗大鼠脂肪组织中抵抗素蛋白的表达,有望成为新的中药类胰岛素增敏剂和脂质代谢调节剂[10]。格列美脲为第三代长效口服磺脲类降糖药,治疗糖尿病具有安全性高、有效药物作用持续时间长等优点,对单用胰岛素血糖控制不佳者效果尤为明显。格列美脲药物治疗机制在于其可与胰岛β 细胞表面的磺酰尿受体结合,促进胰岛β细胞分泌胰岛素,进而增加外周组织对胰岛素的敏感,抑制肝脏葡萄糖的合成;并可通过血脑屏障进入大脑参与能量代谢[11-12]。有学者通过研究发现,采用STZ 建立糖尿病小鼠模型后并给予格列美脲进行干预,结果显示格列美脲可明显改善糖尿病小鼠空间学习和记忆能力,且机制是通过降血糖作用而达成的[13]。本研究采用黄芪多糖联合格列美脲对糖尿病小鼠进行干预,发现可明显降低小鼠空腹血糖水平,且效果优于单一使用格列美脲。此外本研究在Morris 水迷宫实验结果中发现,格列美脲组、联合组小鼠逃避潜伏期明显短于模型组,小鼠穿越平台次数明显高于模型组(P<0.05),提示黄芪多糖联合格列美脲明显改善STZ 所诱导的糖尿病小鼠的学习记忆能力。
海马结构和功能完整性与学习记忆的巩固密切相关,海马的损伤通常影响记忆的形成,与认知衰退相关的神经退行性病变存在密切联系[14]。本研究通过透射电镜发现模型组细胞膜不规则,染色质凝集,细胞质溶解,变性线粒体、膜不清,嵴致密;联合组细胞膜连续,核膜完整,常染色质较多且均匀,线粒体大小不等,嵴断裂呈空泡状。由此可见黄芪多糖联合格列美脲可改善STZ 诱导的糖尿病小鼠海马神经元结构,缓解海马区神经元结构损伤。GIP 是一种肠道内K 细胞分泌的肠促胰素,可促进胰岛β 细胞第一时相分泌胰岛素;GLP-1 是肠道L细胞分泌的肠促胰素,可抑制胰高糖素和促进葡萄糖在组织中的代谢。GIP、GLP-1 在突出可塑性的控制和记忆形成中发挥着重要作用[15-16]。本研究检测海马组织中GIP、GLP-1 含量发现,格列美脲组、联合组小鼠海马组织中GIP、GLP-1 含量明显高于模型组(P<0.05),且联合组明显高于格列美脲组(P<0.05),提示黄芪多糖联合格列美脲明显改善糖尿病小鼠海马组织GIP、GLP-1 含量,可能为改善小鼠空间学习记忆的机制之一。此外本研究还发现,格列美脲组、联合组小鼠脑组织中MDA 含量明显低于模型组、SOD 活性高于模型组(P<0.05),提示黄芪多糖联合格列美脲可通过降低糖尿病小鼠脑组织氧化应激程度改善海马神经元超微结构,进而改善糖尿病认知功能障碍。
综上所述,黄芪多糖联合格列美脲可通过提高海马组织GIP、GLP-1 含量及抗氧化能力,进而缓解糖尿病导致的认知功能障碍,为糖尿病认知功能障碍的防治提供新的靶点。
