TACE联合卡瑞利珠单抗及甲磺酸阿帕替尼治疗晚期肝细胞癌16例
2021-09-26葛乃建于晓河石志勇张小锋周小琴杨业发
黄 剑, 葛乃建, 徐 伟, 于晓河, 石志勇, 蔡 飞, 张小锋, 周小琴,杨业发
HCC起病隐匿、进展迅速且早期诊断困难,大部分患者就诊时即进展致中晚期,无法手术切除或超出肝移植适应证[1]。TACE为不可手术切除HCC患者最佳治疗方案[2-3],但单纯TACE治疗5年生存率仅为8%~43%,且肿瘤伴肝内多发子灶时治疗效果欠佳,且对肝外转移病灶无效[4]。因此国内外学者针对不同抗癌机制研发出了诸多抗肿瘤新药,主要包括针对血管内皮细胞生长的靶向药及免疫抑制剂PD(L)-1[5-6]。靶向药或PD-1单一用药肿瘤控制率低,且耐药率高、药物不良反应较大,因此迫切需要研究针对不同抗癌机制的系统性联合治疗以减少HCC的耐药率及提高联合治疗的疗效[2]。
有研究表明我国自主研发的卡瑞利珠单抗联合甲磺酸阿帕尼对消化系统恶性肿瘤有较高的治疗价值[7]。本课题遂采用传统的TACE联合卡瑞利珠单抗及甲磺酸阿帕替尼治疗晚期HCC,评估其安全性和疗效,为临床晚期肝细胞癌的综合性系统治疗提供临床循证依据。
1 材料与方法
1.1 病例选择
回顾性分析我科2019年1月至2020年12月接受TACE联合卡瑞利珠单抗和甲磺酸阿帕替尼治疗的晚期HCC患者的临床资料。研究对象纳入标准:①经组织病理学或影像学临床确诊HCC;②符合中国HCC分期方案CNLCⅢa/Ⅲb(2019版《肝细胞癌诊疗规范》)及BCLC C期;③Child-Pugh A/B;④体力状况评分(PS)0~2分;⑤肿瘤总体积占全肝比例小于70%。排除标准:①肝功能严重障碍(Child-Pugh C级),包括黄疸、肝性脑病、难治性腹水或肝肾综合征;②凝血功能严重减退,且无法纠正;③门静脉主干被癌栓完全栓塞,且侧支血管形成少;④合并活动性肝炎或严重感染且不能同时治疗;⑤美国东部肿瘤协作组(ECOG)评分大于2分、恶液质或多器官功能衰竭;⑥肿瘤总体积占全肝体积>70%;⑦肾功能障碍指肌酐>175 μmol/L或者肌酐清除率<30 mL/min;⑧化疗药物或其它药物引起的外周血白细胞和血小板显著减少,白细胞<3.0×109/L、血小板<50×109/L且不能纠正;⑨合并肺部、肾脏、心脑血管等其他严重疾病而无法接受TACE+靶向药+PD1联合治疗[3]。
1.2 方法
1.2.1 联合治疗方案
1.2.1.1 TACE治疗:①采用Seldinger方法经皮穿刺股动脉途径插管,将导管置于腹腔干、肝总动脉行DSA造影,造影图像釆集包括动脉期、实质期及静脉期,部分患者必要时加做肠系膜上动脉、右肾动脉及右膈动脉等造影寻找肿瘤侧支供血。②采用微导管超选肿瘤供血动脉,根据动脉造影结果需依次超选所有肿瘤供血动脉。③主要化疗药物包括盐酸表柔比星40~80 mg、羟基喜树碱10~20 mg及奥沙利铂100 mg,先经微导管灌注一部分,再将另一部分表柔吡星及羟基喜树碱与碘油混合成乳剂,同时交替注射颗粒性栓塞剂(聚乙烯醇颗粒及明胶海绵颗粒)进行联合性栓塞。栓塞完全后再次造影,明确肿瘤是否完全栓塞,如有局部欠缺则继续栓塞至造影示肿瘤完全栓塞。巨大肿瘤及左右叶多发肿瘤为防止肝肾功能衰竭,分2次进行TACE治疗。
1.2.1.2 阿帕替尼治疗:TACE治疗栓塞后综合征缓解后,1周即开始口服甲磺酸阿帕替尼(250 mg,每日1次)治疗。后续TACE治疗前3 d暂停甲磺酸阿帕替尼治疗。当患者不良反应较大时,阿帕替尼剂量减小或隔天口服用药。当无法耐受药物不良反应时则停止用药。
1.2.1.3 卡瑞利珠单抗治疗:TACE治疗栓塞后综合征缓解后2周内开始进行卡瑞利珠单抗(200 mg,静脉滴注),后每3周重复用药1次。
首次联合治疗后1个月进行第1次影像学评估(推荐增强MRI)、肝功能评估及血清AFP、异常凝血酶原(PIVKA)水平测定。如肝内仍有活性肿瘤病灶,则补做1次TACE治疗。后每3个月进行一次上述评估,如有新生肿瘤且无TACE JSH定义的TACE失败或抵抗,则可继续行TACE治疗。治疗期间因非疾病进展的原因停止联合治疗时,则结束联合治疗时进行一次评估。患者出现肿瘤进展且联合治疗不再获益、不可耐受的不良反应及其他任何原因无法联合治疗时则视为联合治疗终止。
1.2.2 结局评价指标
1.2.2.1 安全性评估:依据NCI-CTCAE v5.0(National Cancer Institute’s Common Terminology Criteria for Adverse Events)标准对联合治疗后的不良反应进行评估,不良事件(1、2级)及严重不良事件(3~5级)[8]。TACE治疗栓 塞后综合 征指TACE治疗后因肿瘤组织缺血坏死引起的恶心、呕吐、腹痛、发热、食欲下降等一系列临床症状。高胆红素症指总胆红素(TBIL)>51 μmol/L,高转氨酶血症指ALT>200 IU/mL、AST>200 IU/mL。
1.2.2.2 疗效评估:依据改良实体瘤评价标准(mRecist)及RECICL version 5标准评估肿瘤完全缓解(CR)、部分缓解(PR)、稳定(SD)、肿瘤进展(PD)、疾病控制率(DCR)、无进展生存期(PFS)及总生存期(OS)[9-10]。PD指无法继续联合治疗或联合治疗不再获益,包括肝内肿瘤病灶较基线增大超过50%、肝功能恶化至Child-Pugh C级、肿瘤侵犯门静脉主干或下腔静脉及肝外转移,还包括JSH定义的TACE失败/抵抗(JSH-LCSGJ criteria 2014 update)[4]。DCR的定义为CR、PR、SD之和。PFS指从接受联合治疗开始至肿瘤进展或任何原因引起死亡的时间。OS指患者从联合治疗开始至末次随访时间或任何原因致患者死亡的时间。
1.3 统计学方法
所有结果数据均采用SPSS 23.0(SPSS,Chicago,IL,USA)进行统计学分析。无进展生存时间及总生存时间以中位数表示,研究结果百分数均计算95%CI。
2 结果
2.1 一般患者临床资料
患者详细临床资料及肿瘤特征如表1所示。16例患者均为BCLC C期,其中CNLCⅢa10例,CNLCⅢb6例。JSH-LCSGJ共识肿瘤直径>4 cm及、瘤个数>7个及肿瘤散发于左右肝叶均提示TACE疗效均欠佳。肿瘤侵犯门静脉共10例,其中累及门静脉主干5例,仅累及右侧门静脉3例,仅累及左侧门静脉2例。肿瘤累及下腔静脉2例,仅累及肝静脉3例。9例患者合并肝外转移,其中合并肺转移5例,合并腹腔内淋巴结转移3例,合并腹腔内转移1例。截至最后一次随访16例患者行TACE手术共39例/次,1次TACE 3例(18.8%)、2次TACE 7例(43.7%)、3次TACE 3例(18.8%)、4次TACE 2例(12.5%)、5次TACE 1例(6.2%)。
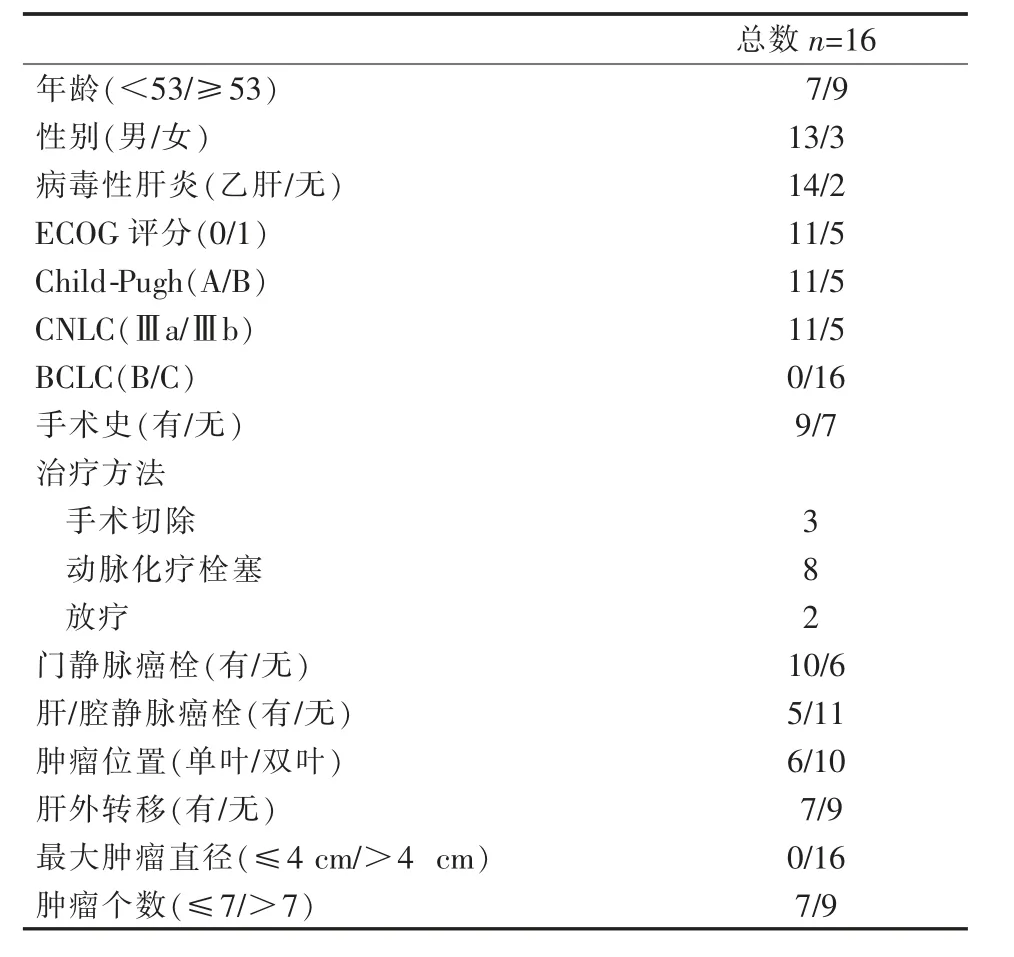
表1 患者一般临床资料及肿瘤特征 n
2.2 联合治疗相关不良事件
16例患者联合治疗后相关并发症具体如表2。16例(100%)患者首次TACE治疗后均出现TACE栓塞后综合征,13例(81.25%)出现术后ALT、AST升高,经对支持治疗好均好转。1例患者TACE术后出现肝脓肿,后行经皮肝脓肿穿刺引流后好转。联合治疗过程中14(87.5%,95%CI,69.3%~100%)例出现靶向药及PD-1相关不良事件,其中1例患者出现少见的免疫性垂体炎,乏力明显,经甲强龙逐步递减治疗后好转,各项指标均正常。6例(37.5%,95%CI,10.9%~64.1%)出现3级严重不良事件,包括2例(12.5%,95%CI,0~30.7%)手足综合征,3例(18.75%,95%CI,0~40.2%)严重腹泻和1例(6.25%,95%CI,0~19.6%)免疫性肺炎,经临床对症支持治疗后均好转。所有患者均未出现4、5级严重不良事件及导致患者死亡的严重不良反应。

表2 16例患者联合治疗过程中相关不良事件 n(%)
2.3 联合治疗肿瘤反应及预后
16例患者中位随访时间11个月(3~24个月)。2例(12.5%,95%CI,0~30.7%)达到CR(图1),10例(62.5%,95%CI,35.9%~89.1%)PR,2例(12.5%,95%CI,0~30.7%)SD,14例(87.5%,95%CI,69.3%~100%)患者联合治疗3个月后复查达到DCR(表3)。中位PFS长达9个月(95%CI,5.58~13.29),中位OS 12个月(95%CI,9.0~16.1个月)(表3)。截至末次随访3例(18.8%)患者死亡,1例联合治疗6个月后肿瘤进展,再次行TACE治疗后出现肝脓肿,遂停止联合治疗,后肿瘤全身多发转移致多脏器功能衰竭死亡。2例(12.5%,95%CI,0~30.7%)联合治疗无效,肿瘤迅速进展致肝功能衰竭死亡。

图1 TACE联合卡瑞利珠单抗及阿帕替尼治疗HCC伴肺转移前后对比

表3 患者联合治疗预后
3 讨论
TACE已成为不可切除中晚期HCC的最佳治疗方案,其在阻断肿瘤血供的同时还于瘤体内聚集高浓度的化疗药,最大限度地杀灭肿瘤细 胞[1,3]。HCC多次TACE治疗后随着原供血血管闭塞、侧支毛细血管生长及肿瘤细胞对化疗药物的耐受,肿瘤即进入TACE耐受或TACE失败期[4]。HCC伴肝内多发转移,特别是肿瘤位于肝左右叶时,TACE可能损伤无肿瘤肝组织致肝功能损伤,甚至因大面积肝组织缺血致肝功能衰竭死亡[4]。肿瘤个数4~6、7~10和>10个时,TACE无效率分别达到23%、32%和42%,因此当TACE疗效不佳、肿瘤多发或合并肝外转移时,则需及时调整治疗 方 案[2,11]。
TACE可导致栓塞组织细胞缺血缺氧,刺激残存病中的VEGF表达,从而促使肿瘤血管再生并导致肿瘤复发和转移[4-5]。有效抑制肿瘤区血管新生即可抑制肿瘤细胞的生长及减少肿瘤转移发生率,因此TACE联合靶向药理论上不仅可有效抑制肿瘤生长,还可有效防止HCC肝内或肝外转移[5,12]。目前临床上治疗HCC抗血管生成靶向药物主要有索拉非尼、仑伐替尼、阿帕替尼、瑞戈非尼、卡博替尼及克唑替尼等[5]。肝脏的长期慢性炎性反应可上调PD-1受体,促进免疫细胞自发凋亡而诱导HCC的发生与发展,因此免疫治疗被认为是HCC治疗的新方向[13]。目前用于HCC的PD-1抑制剂主要包括nivolumab、pembrolizumab、bevacizumab、卡瑞利珠单抗等[5,13]。虽然PD-1免疫治疗在HCC的治疗中己显示出良好疗效,但单用时有效率仍不足20%[5]。一项pembrolizumab联合lenvatinib治疗HCC的研究结果显示靶向药联合PD-1疗效要优于单一用药[14],TACE联合靶向药及PD-1将成为不可切除HCC的治疗新趋势。
虽然靶向药及PD-1的出现给不可切除HCC带来了新的希望,但两种药物的不良反应也受到临床关注,因此TACE联合靶向药及PD-1联合治疗的并发症也需进一步深入研究[13]。一项卡瑞利珠单抗联合甲磺酸阿帕尼治疗晚期肝细胞癌及胃癌的Ⅰ期临床研究中,出现27例次3级治疗相关不良事件,但仅1例患者因胆红素升高而停止治疗,所有患者均无治疗相关的不良事件,且无患者出现血管内皮增生症[7]。另外一项研究PD-(L)1联合osimertinib治疗肺癌的研究中,41例患者仅有6(95%CI 7%~29%)例出现3~4级不良事件,其中只有1例4级肝炎,且对症治疗后均好转出院[15]。说明靶向药联合PD-1治疗HCC还是相对较安全的。本研究中仅1例患者TACE后出现肝脓肿3级不良事件,穿刺引流后好转。联合治疗过程中仅6例(37.5%,95%CI 10.9%~64.1%)出现卡瑞利珠单抗联合甲磺酸阿帕尼治疗相关3级不良事件,所有患者均未出现4、5级不良事件。说明TACE联合卡瑞利珠单抗及甲磺酸阿帕尼治疗HCC严重不良事件发生率低,安全性可靠。
Park等[16]研 究TACE联 合 索 拉 菲 尼 治 疗 不 可切除HCC,6个月肿瘤无进展率高达52%,肿瘤中位无进展时间长达7.1个月,且患者无明显严重不良事件。陈成等[17]meta分析TACE联合阿帕替尼治疗HCC疾病客观缓解率及疾病控制率明显高于单纯TACE,且患者6个月、12个月生存期联合治疗明显优于单纯TACE组。Zhu等[14]研究pembrolizumab治疗靶向药失败的HCC,肿瘤客观缓解率18%,其中1例患者达到CR,DCR也高达44%。Xu等[7]开展的一项卡瑞利珠单抗联合甲磺酸阿帕尼治疗不可手术消化道肿瘤的研究,晚期肝癌的PR高达50%[9]。鉴于上述靶向药及PD-(L)1在HCC治疗中的价值,本研究即开展了TACE联合卡瑞利珠单抗及甲磺酸阿帕尼的探索性研究。14例(87.5%,95%CI 69.3%~100%)患者联合治疗3个月后达到DCR,说明对于晚期HCC患者联合治疗可有效提高患者的肿瘤控制率。值得一提的是2例HCC伴肺转移患者达到CR,肝内肿瘤及双肺转移瘤均完全消失,联合治疗为HCC伴全身多发转移患者提供了根治的希望。本研究中16例患者均为BCLC C期及CNLCⅢ期,治疗困难且预后不佳,但中位PFS高达9个月(95%CI 5.58~13.29个月)及中位OS高达12个月(95%CI 9.04~16.09),说明TACE联合靶向药及PD-1可有效延长患者生存期,使患者生存获益。但我们观察到患者中位OS较中位PFS仅延长3个月,我们的研究中2例未获得DCR患者即因肿瘤短期内进展致肝功能衰竭死亡,可能为HCC患者一旦TACE联合靶向药及PD-1治疗失败后,很难提供其他有效的治疗方案,肿瘤即迅速进展致患者死亡。
本研究也有一定的局限性,首先样本量较小,不排除数据结果的偏倚。其次随访时间较短,大部分患者OS未观察到终点事件,我们预期如进一步延长患者随访时间,中位OS可能会进一步延长。再次本研究为单样本观察,缺乏相应的对照组,实验结果说服力有待进一步提高。我们参与了腾皋军教授牵头的课题“TACE联合卡瑞利珠单抗和甲磺酸阿帕替尼对比TACE治疗中晚期肝癌的随机对照、开放、多中心临床研究”,将会为HCC联合治疗获取更为可靠的循证依据。
综上所述,TACE联合卡瑞利珠单抗及甲磺酸阿帕尼治疗晚期HCC严重不良事件发生率低,肿瘤控制率较高,可有效延长患者生存期,值得进一步研究及临床推广。
