C57BL/6J小鼠构建肥胖动物模型评价
2021-09-21张晶晶赵文欣李佳潞项恋张远帆杨丹马玲
张晶晶 赵文欣 李佳潞 项恋 张远帆 杨丹 马玲
【摘要】目的:以高脂饮食诱导C57BL/6J小鼠建立肥胖动物模型、观察模型稳定情况,为探讨单纯性肥胖症发生发展机制提供基础实验依据。方法:采用5周龄雄性C57BL/6J小鼠126只,随机分为普通膳食组(CON,n=18)和高脂模型组(HFD,n=108),造模10周后、HFD组筛选出体重高于CON组小鼠平均体重20%的小鼠视为肥胖造模成功,将2组小鼠继续喂养8周、观察成年肥胖小鼠模型稳定性。实验全程测量小鼠每周体重,每日食量、计算各组小鼠每周摄入能量变化;实验结束后,测量小鼠体长、计算Lees指数;称取腹股沟、附睾、肾周、肩胛部脂肪组织质量,计算体脂率;取血测定血液总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)、高密度脂蛋白(HDL)。结果:造模10周后肥胖小鼠成模率为77.57%,体重差异为26.5%;实验结束后HFD组与CON组体重差异为26.91%,HFD组体重、摄入能量、体脂量、体脂率、Lees指数、血TC、TG、HDL水平高于CON组(P<0.05)。结论:C57BL/6J小鼠行肥胖造模10周为适宜时长,造模成功后肥胖小鼠在8周内的体重差异较稳定,C57BL/6J小鼠可视为稳定的单纯性肥胖症造模物种。
【关键词】C57BL/6J小鼠;肥胖;动物模型
[中图分类号]R-332 [文献标识码]A [文章编号]2096-5249(2021)09-0007-02
肥胖症不仅与多种慢性非传染性疾病及癌症的发生发展密切相关,也为患病人群带来较大的经济负担与死亡风险[1-2]。面对该流行趋势,迫切需要研究人员对其致病机制进行深入研究,动物模型就成为了研究发病机制及治疗靶点的主要工具,为研究人员在整体水平系统研究肥胖症提供了可行性、从而弥补在细胞实验水平缺乏的整体影响效应。小型啮齿类动物,尤其是小鼠广泛用于研究代谢紊乱疾病动物模型,小鼠和大鼠的生理机能比非哺乳动物物种更接近人类[2]。近交系C57BL/6J小鼠因易发生严重肥胖、脂肪堆积、葡萄糖不耐受和中度胰岛素抵抗而被广泛用作肥胖模型;雄性小鼠更容易受到高脂饲料的影响,因此它们比雌性小鼠可更快、更大程度地形成肥胖[3-5]。本研究旨在通过高脂饮食诱导雄性C57BL/6J小鼠建立肥胖动物模型,筛选肥胖动物建模关键指标、并评价C57BL/6J小鼠肥胖成模稳定性,为单纯性肥胖症动物实验研究模型选择提供理论基础。
1 材料与方法
1.1实验对象 5周龄SPF级雄性C57BL/6J小鼠,由北京华阜康生物科技股份有限公司提供(生产许可证号:SCXK(京)2019-0008),于西南医科大学实验动物中心屏障环境饲养:饲养温度19℃~26℃,相对湿度40%~70%,12~12h明暗交替,自由进食、饮水,每3 d更换一次垫料。动物实验方案得到了西南医科大学动物伦理委员会的批准许可。
1.2建立肥胖小鼠模型 5周龄雄性SPF级C57BL/6J小鼠126只,适应性喂养5日后,按体重隨机分为正常对照组18只、高脂模型组108只,每笼6只。HFD组以高脂饲料喂养行肥胖造模(TP23300:脂肪60.0%,蛋白质19.4%,碳水化合物20.6%;热量5.0 kCal/g),CON组以普通饲料喂养(TP23302:脂肪10.0%,蛋白质19.0%,碳水化合物71.0%;热量3.6 kCal/g),每日称饲料剩余量、按需供给,每周称量体重。
1.3实验取材与保存 实验结束后,小鼠禁食不禁水12h,次日戊巴比妥钠麻醉(麻醉剂量取50 mg/Kg·BW[6-7])后心脏采血,解剖取脏器,称量腹股沟皮下脂肪、附睾脂肪、肾周脂肪、肩胛部棕色脂肪湿重并记录;所有样本血清离心取上清于-80℃保存。
1.4检测指标及方法 ①基础生理指标:体重:每周固定时间点电子天平称量一次(g);Lees指数:(体重g)1/3/体长cm×1000;体脂率:(腹股沟皮下脂肪+附睾脂肪+肾周脂肪+棕色脂肪)g/体重g ×100%;摄入能量:每日固定时间点电子天平称量小鼠食量(g)*饲料热量,计算每组每周摄入能量变化。②血清学指标:按试剂盒提供的方法用全自动生化分析仪(BS-240vet)(深圳迈瑞生物医疗电子股份有限公司)测定,TG、TC测定采用氧化酶法,HDL-C、LDL-C测定采用直接法。
1.5数据统计与分析 采用SPSS 25.0进行数据统计分析,数据以均数±标准差(x±s)描述。两组间差异性分析采用两独立样本t检验,P<0.05表示差异有统计学意义;数据作图采用GraphPad Prism 6.07软件进行数据作图。
2 结果
2.1高脂饲养小鼠体重变化 饲养全程记录小鼠体重变化,两组小鼠起始体重(第0周)无差异,饲养第2周起HFD组体重高于CON组(P<0.05)。造模10周后,107只小鼠中有83只小鼠体重超过对照组平均体重的20%,成模率为83/107*100%=77.57%,初始2周体重增加最快,第10周时体重差异达26.5%、18周时差异为26.91%,建模成功后(11-18周)肥胖模型较稳定。详见图1。
2.2高脂饲养后小鼠能量摄入变化 HFD组小鼠饲养期间摄入能量在第6、8、14、16、18周高于CON组(P<0.05),在第2、4、10、12周与CON组没有差异。详见图2。
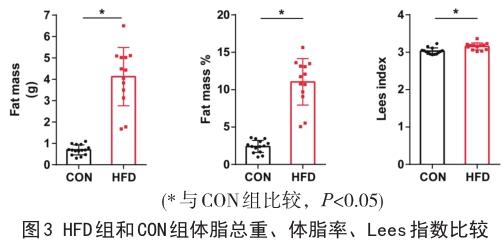
2.3高脂饲养后小鼠脂肪组织质量变化 高脂饲养18周后,HFD组体脂总重、体脂率、Lees指数高于CON组(P<0.05)。HFD组小鼠体脂总重约为CON组6倍,体脂率约为CON组5倍;HFD组小鼠Lees指数达313、该指数大于310被视为肥胖成模指标之一[8]。详见图3。
2.4高脂饲养后小鼠血脂变化
高脂饲养18周后,HFD组小鼠血液中TG、TC、HDL均高于CON组(P<0.05),LDL两组间没有差异。详见图4。
3 讨论
研究人员对以往肥胖动物造模进行系统评价发现,对于饮食诱导的肥胖动物模型关键在于高脂饲料中脂肪占比,啮齿类动物造模饲料最常用45%与60%脂肪占比饲料,而60%高脂饲料可使C57BL/6J小鼠更快且更易形成肥胖,选择8周龄前小鼠造模可使肥胖稳定期处于小鼠成年阶段,接近成年人体状态,而造模时长选择在12周左右可达到肥胖维持阶段[9-10]。本研究使用60%高脂饲料饲喂5周龄雄性C57BL/6J小鼠,在10周时筛选出肥胖鼠,有研究人员用3周龄C57小鼠系统探讨肥胖造模效果[11],造模时长相同的情况下,与之造模率比(88.75%),本研究造模率(77.57%)相对低,由于该研究小鼠起始周龄较小,对高脂饮食诱导肥胖更敏感,周龄越小、小鼠的体脂增加在前期更易通过增加脂肪细胞数量实现,成年后则是通过脂肪细胞体积变大实现。其余造模评价指标如血脂、体脂率等本研究在18周后差异依旧明显、肥胖模型较稳定,与成人单纯型肥胖症出现的高脂血症、以及体脂量增加相对应。总体而言小鼠周龄对成模率影响较大,且成模越早、后期小鼠处于成年稳定阶段进行干预可排除年龄影响因素、更容易反应干预效果。故本研究提示体重可视为肥胖小鼠造模成功的关键指标,体脂率、血脂四项可反映机体单纯性肥胖症的脂质代谢负担状况;选择C57BL/6J小鼠建立肥胖模型、在成年阶段肥胖模型依旧稳定、可作为人类单纯性肥胖症良好的研究模型。
参考文献
[1] Sung H, Siegel RL, Torre LA, et al. Global patterns in excess body weight and the associated cancer burden[J]. CA Cancer J Clin, 2019, 69(2): 88-112.
[2] Afshin A, Forouzanfar MH, Reitsma MB, et al. Health Effects of Overweight and Obesity in 195 Countries over 25 Years[J]. N Engl J Med, 2017, 377(1): 13-27.
[3] Kleinert M, Clemmensen C, Hofmann SM, et al. Animal models of obesity and diabetes mellitus[J]. Nat Rev Endocrinol, 2018, 14(3): 140-162.
[4] Preguica I, Alves A, Nunes S, et al. Diet-induced rodent models of obesity-related metabolic disorders-A guide to a translational perspective[J]. Obes Rev, 2020, 21(12): e13081.
[5] 孫奥, 马玉兰, 胡晓琴, 等. C57BL/6小鼠在肥胖建模过程中常见问题及处理对策[J]. 实验动物科学, 2020, 37(1): 61-65.
[6] 魏泓. 医学动物实验技术[M]. 北京: 人民卫生出版社, 2016, 143-144.
[7] Hanel A, Carlberg C. Vitamin D and evolution: Pharmacologic implications[J]. Biochemical Pharmacology, 2020, 17(3): 113595
[8] Hariri N, Thibault L. High-fat diet-induced obesity in animal models[J]. Nutr Res Rev, 2010, 23(2): 270-299.
[9] Fernandes MR, Lima NV, Rezende KS, et al. Animal models of obesity in rodents. An integrative review[J]. Acta Cir Bras, 2016, 31(12): 840-844.
[10] Rosini TC, Silva AS, Moraes C. Diet-induced obesity: rodent model for the study of obesity-related disorders[J]. Rev Assoc Med Bras(1992), 2012, 58(3): 383-387.
[11] 朱梦梦, 张泽家, 赵琳, 等. 单纯性肥胖小鼠动物模型的构建及评价[J]. 医学理论与实践, 2020, 33(3): 345-347.
基金项目:四川省2019年科技计划项目(编号:2019YJ0483);泸州市2018年重点研发科技计划(编号:2018-SYF-20)
作者简介:张晶晶(1994-),女,西南医科大学公共卫生学院,硕士在读,研究方向:营养与食品卫生学;
*通信作者:马玲:教授,西南医科大学公共卫生学院。
