多发性骨髓瘤免疫不全麻痹特征及临床意义分析
2021-09-16曹乐乐黄芮王晓雪秦慧
曹乐乐,黄芮,王晓雪,秦慧
(安徽医科大学第二附属医院血液科,安徽 合肥 230601)
0 引言
多发性骨髓瘤(multiple myeloma,MM)是一种起源于B淋巴细胞的恶性克隆性肿瘤,特点是骨髓中异常浆细胞不断扩增,产生过量无免疫活性的单克隆免疫球蛋白或其片段,导致终末器官的损害。我国2016年新诊断的骨髓瘤患者为16500例,其中死亡的患者为10300例,年龄标准化的发病率为1.03/10万、死亡率为0.67/10万[1]。MM患者初诊时的中位年龄约为66岁[2]。
MM中常见未受累免疫球蛋白的水平低于正常,这种对正常免疫球蛋白的抑制被称为免疫不全麻痹(immunoparesis)或多克隆低丙种球蛋白血症(Polyclonal hypogammaglobulinaemia)。免疫不全麻痹反映了骨髓中异常增殖的单克隆浆细胞对于患者体液免疫功能的损害。本研究主要探讨MM患者免疫不全麻痹的特征及其临床意义。
1 病例和方法
1.1 病例资料
以2010年11月1日至2019年9月30日在我院血液科及肿瘤科初诊的160名MM患者为研究对象,均符合MM的诊疗指南[3],排除标准:①研究所需资料不完整的MM患者;②疗效分析中未完成4疗程诱导治疗的MM患者。
收集MM患者初诊时的骨髓浆细胞比例,β2微球蛋 白 (β2-MG)、血 红 蛋 白 (HB)、血 清 肌 酐 (Cre)、乳 酸 脱 氢酶(LDH)、血清白蛋白(ALB)水平,以及诱导治疗方案及疗效、是否合并感染,诱导治疗前后IgG、IgA及IgM水平。诱导治疗方案分为:含免疫调节剂及不含免疫调节剂。
1.2 标准及方法
定性免疫不全麻痹的评估分为:无免疫不全麻痹、部分免疫不全麻痹(一种或两种免疫球蛋白低于正常下限)、泛免疫不全麻痹(三种免疫球蛋白均低于正常下限)。定量免疫不全麻痹的评估分为:无、轻度(低于正常下限0~25%)、中度(低于正常下限25%~50%)、重度(低于正常下限50%~75%)、极重度(低于正常下限75%以上)。诱导治疗后对患者免疫不全麻痹的程度再次分度,与治疗前比较,提升1度则为免疫不全麻痹改善1级,以此类推,改善级别依次为2级、3级、4级。我院IgG、IgA、IgM实验室参考值的正常下限分别是7.00g/l、0.70g/l、0.50g/l。
MM的疗效标准参照IMWG骨髓瘤传统疗效标准[4]分为:完全缓解(CR)、非常好的部分缓解(VGPR)、部分缓解(PR)及未达部分缓解。
1.3 统计学分析
应用SPSS 24.0进行统计学分析。两样本率的比较采用χ2检验;两等级资料间相关性分析采用Spearman相关分析;计量资料符合正态分布的采用均值±标准差表示、t检验分析,非正态分布的采用中位数(四分位数间距)表示、采用非参数检验分析。以P<0.05认为差异有统计学意义。
2 结果
2.1 病例特征
本研究共纳入160名MM患者,其中男性:97例(60.6%)、女 性:63例 (39.4%),中 位 发 病 年 龄:66(35-96)岁;IgG k型:46 例 (29.5%)、IgG λ 型:33 例 (21.2%)、IgA k 型:18例 (11.5%)、IgA λ 型:25 例 (16.0%)、IgM k 型:1 例 (0.6%)、IgD λ 型:4 例 (2.6%)、k 轻链型:17 例 (10.9%)、λ 轻链型:12例 (7.7%);Durie-Salmon(D-S)分期:I期:29 例 (18.1%)、II期:23 例 (14.4%)、III期:108 例 (67.5%);国际分期系统 (ISS)分期:I期:12 例 (7.7%)、II期:56 例 (35.9%)、III期:88 例 (56.4%),以上数据总结在表1中。

表1 MM患者特征
2.2 免疫不全麻痹的特征
160 名MM患者定性免疫不全麻痹(图1):无免疫不全麻痹:10例 (6.2%)、有免疫不全麻痹:150例 (93.8%),其中部分免疫不全麻痹:128例(80.0%)、泛免疫不全麻痹:22例(13.8%);泛免疫不全麻痹见于IgD型或轻链型MM;定量免疫不全麻痹 (图2):轻度:14 例 (8.8%)、中度:32 例 (20.0%)、重度:35 例 (21.9%)、极重度:69 例 (43.1%)。
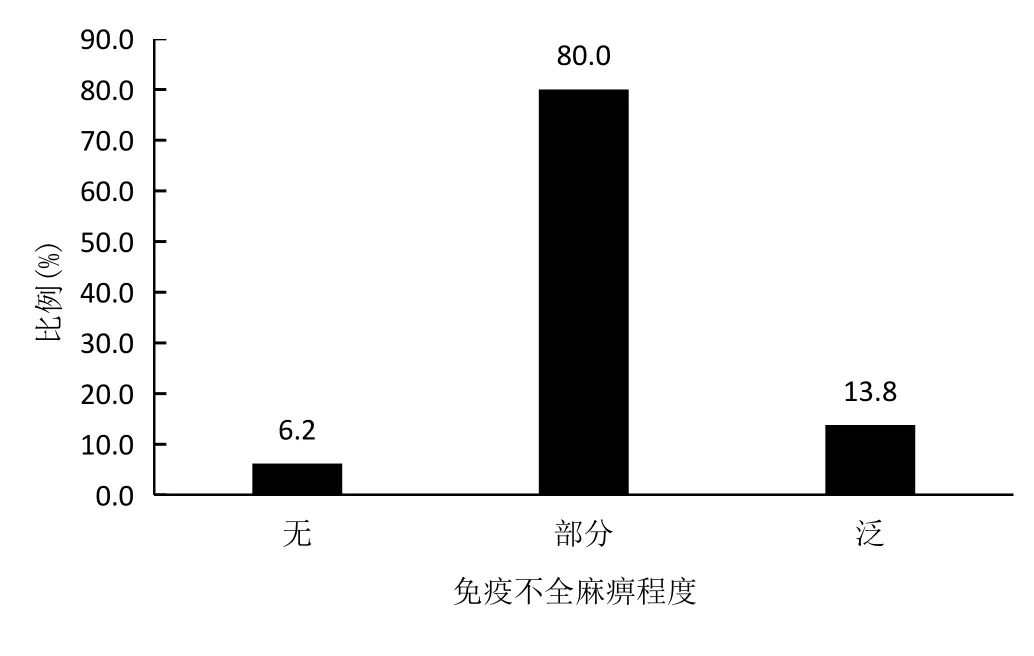
图1 160名MM患者定性免疫不全麻痹的程度
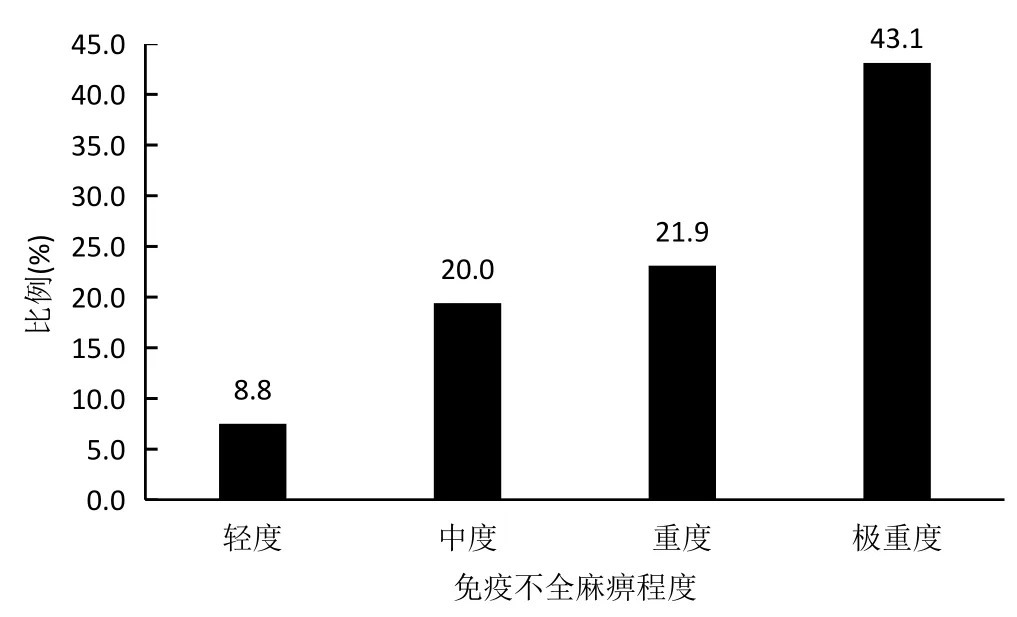
图2 160名MM患者定量免疫不全麻痹的程度
2.3 免疫不全麻痹的临床意义
2.3.1 有无免疫不全麻痹比较
如表2所示,有免疫不全麻痹的患者与无免疫不全麻痹的患者性别、年龄,以及初诊时β2-MG、Cre、LDH水平总体分布均相同差异均无统计学意义(均P>0.05);但有免疫不全麻痹的患者较无免疫不全麻痹的患者初诊时骨髓中浆细胞比例、受累单克隆IgA、IgG水平更高,HB、ALB水平更低(均P<0.05)。此外,单克隆IgA、IgG水平的高低与免疫不全麻痹的程度之间呈正相关(P=0.011<0.05,r=0.395;P=0.001<0.05,r=0.381)。由于IgM型及IgD型病例数过少,本研究未分析。

表2 160名MM患者免疫不全麻痹有无比较
2.3.2 免疫不全麻痹与分组
分析免疫不全麻痹程度与分期的相关性,发现患者D-S及ISS分期与免疫不全麻痹的程度(表3,表4)呈正相关,P值分别是0.000和0.008,r值分别是0.335和0.219。
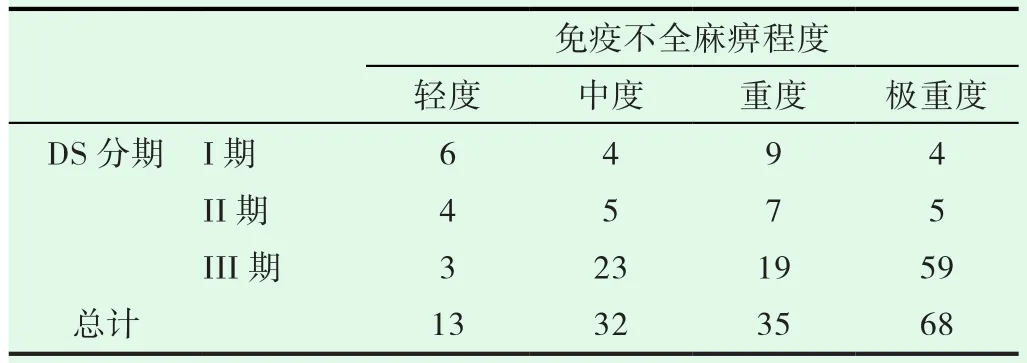
表3 患者D-S分期与免疫不全麻痹的程度(n)
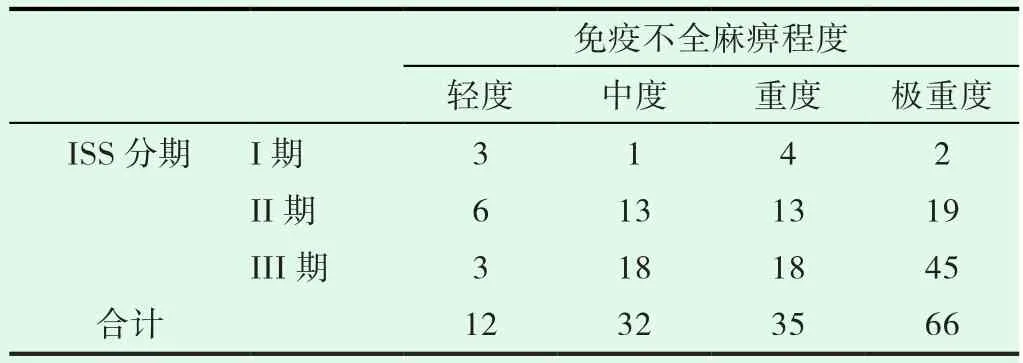
表4 患者ISS分期与免疫不全麻痹的程度(n)
2.3.3 免疫不全麻痹改善与诱导治疗
可评估免疫不全麻痹改善的病例为88例(图3),其中34例(38.6%)免疫不全麻痹未改善,54例(61.4%)得到不同程度的改善,其中改善1级:17例(19.3%)、改善2级:21例(23.9%)、改善 3级:8例 (9.1%)、改善 4级:8例 (9.1%)。
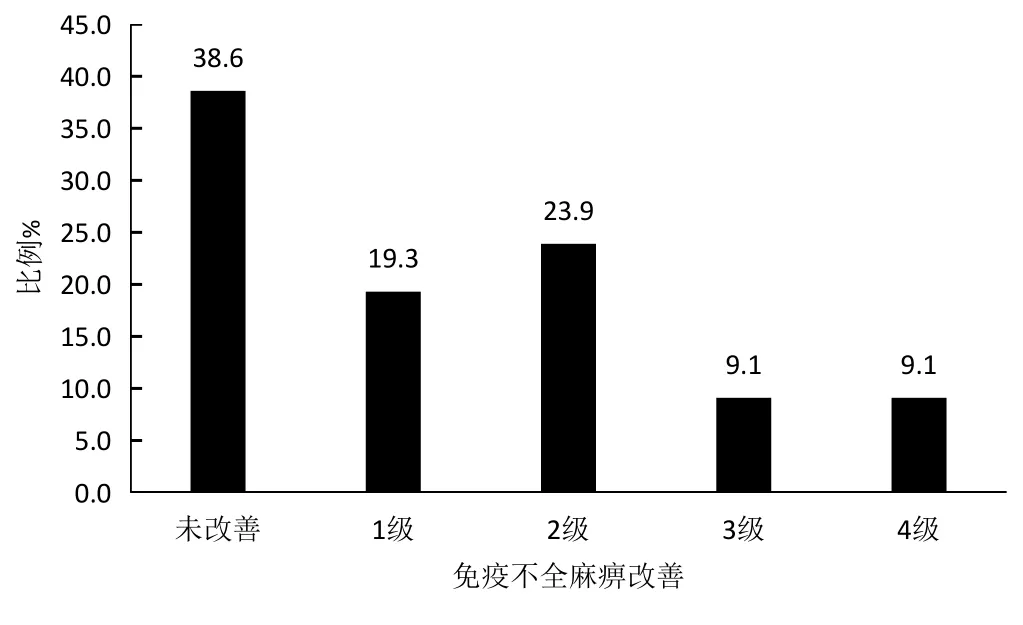
图3 88名MM患者免疫不全麻痹改善
68例(77.3%)患者接受含免疫调节剂的治疗,20例(22.7%)患者接受不含免疫调节剂的治疗(表5),诱导治疗方案是否含有免疫调节剂与患者免疫不全麻痹的改善相关(P=0.026<0.05)。
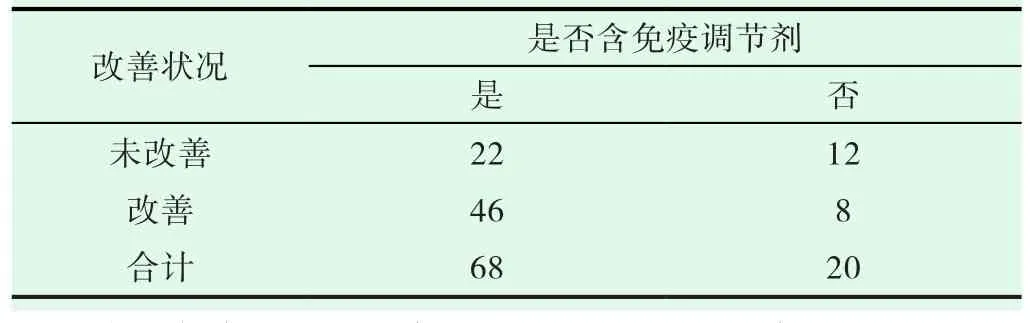
表5 免疫不全麻痹改善与治疗方案
关于疗效达 CR:20 例 (22.7%)、VGPR:26 例 (29.6%)、PR:20例(22.7%)、未达PR:22例(25.0%)。免疫不全麻痹改善的程度与诱导治疗疗效之间呈正相关(表6,P=0.000<0.05,r=0.468)。
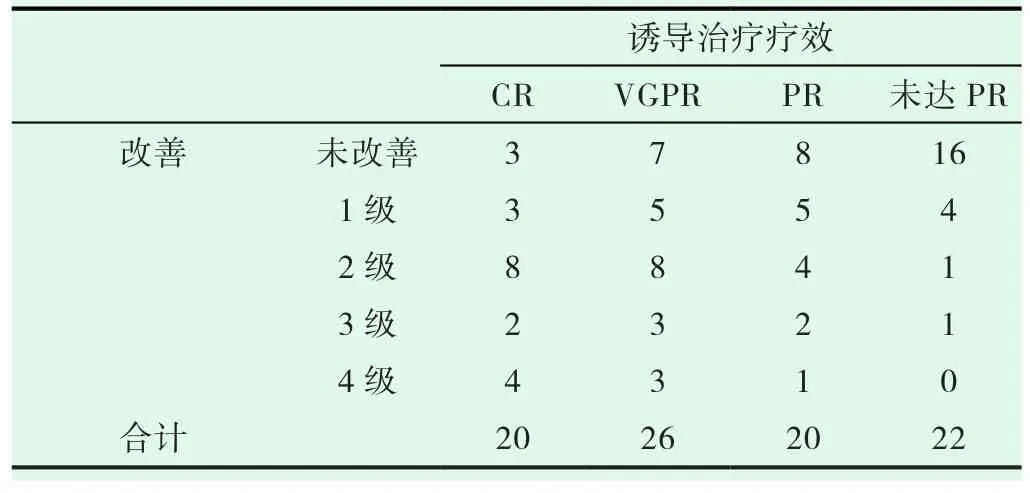
表6 免疫不全麻痹的改善与诱导疗效
2.3.4 免疫不全麻痹与感染
研究纳入的患者中合并感染:80例(50.0%),呼吸道感染多见(40.6%)。有无感染在有无免疫不全麻痹中的差异不具有统计学意义(表7,P=0.746>0.05)。此外,在不同免疫不全麻痹分组中,感染发生的差异也不具有统计学意义(表8,P=0.195>0.05)。

表7 免疫不全麻痹与感染
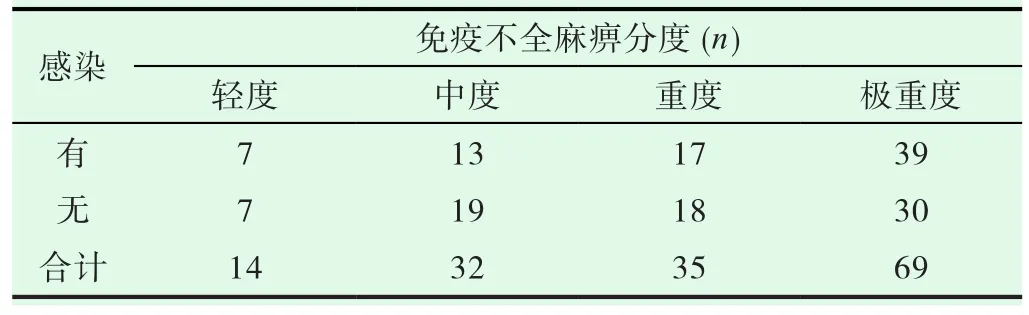
表8 感染与免疫不全麻痹的程度
3 讨论
MM是血液系统的一种恶性浆细胞克隆性病变,其通过多种机制造成免疫抑制,免疫不全麻痹是免疫抑制的特征之一。本研究结果显示:MM发病的中位年龄是66岁、男性明显多于女性、分型中以IgG型多见、D-S以及ISS分期中以III期多见;93.8%的患者在初诊时有免疫不全麻痹,部分免疫不全麻痹的患者最多占80%,泛免疫不全麻痹多见于IgD型及轻链型MM。先前研究[5,6]表明在新诊断的MM患者中免疫不全麻痹的比例约为90%,80.8%患者表现为部分免疫轻瘫,与本研究相似。与未合并免疫不全麻痹的患者相比,合并的患者初诊时骨髓中浆细胞比例及单克隆IgA、IgG的水平更高、血红蛋白及白蛋白的水平更低,且单克隆IgA、IgG的水平越高,免疫不全麻痹的程度越重。患者D-S或ISS分期与免疫不全麻痹程度呈正相关关系,而Victor H Jimenez-Zepeda等[7]研究也表明更高程度的免疫不全麻痹与更晚期的疾病相关。在MM中受累单克隆球蛋白的水平与免疫麻痹程度有显著但不密切的关系,IgD型、IgA型、M蛋白重链型和λ轻链型的MM患者的免疫不全麻痹的程度最重[8]。
本研究发现含免疫调节剂的方案更有利于免疫不全麻痹的改善,Jennifer L J Heaney等[8]研究表明包含沙利度胺或来那度胺和地塞米松的治疗方案使得MM患者的免疫不全麻痹得到恢复并且生存期延长一倍,此外有报道[9]表明来那度胺可以诱导Th1细胞极化和产生细胞毒性骨髓瘤特异性T淋巴细胞,抑制免疫抑制细胞的产生。本研究还表明MM患者的诱导治疗疗效越佳,免疫不全麻痹改善的程度越高。大量的研究表明感染倾向与MM患者免疫不全麻痹程度之间并没有很强的相关性,然而在一些无免疫不全麻痹的MM患者中特异性抗体产生也是下降的[10]。
当T细胞激活表达CD40配体并诱导B细胞CD40信号表达,加之T细胞依赖的细胞因子IL-4、IL-21、IL-6等刺激B细胞活化时,便产生具有高亲和力持久免疫功能的B细胞,这一过程容易导致包括骨髓瘤在内的恶性肿瘤的发生[11]。调节性T细胞(Tregs)是一种对于恶性疾病发挥免疫抑制作用重要的免疫细胞,它可以协助肿瘤细胞逃避免疫的杀灭作用[12]。骨髓微环境可以分泌血清转化生长因子β1(TGF-β1)、白细胞介素-10(IL-10)等生长因子。TGF-β1是一种多功能的细胞因子,TGF-β1早期可以抑制肿瘤生长,晚期通过抑制免疫反应和促进血管生成来加速肿瘤的侵袭和转移[13]。TGF-β1对于恶性骨髓瘤细胞生长的抑制与视网膜细胞瘤蛋白相关[14]。骨髓微环境中的肿瘤相关巨噬细胞表达高水平的IL-10,而IL-10是一种多功能的细胞因子,具有抑制T细胞增殖及人类白细胞抗原依赖的抗原提呈等功能,从而抑制骨髓瘤患者的体液免疫功能[15]。
关于MM免疫不全麻痹的机制目前的解释如下,当骨髓中异常的浆细胞比例高于一定水平时,Tregs会抑制多克隆B细胞的分化成熟及分泌免疫球蛋白,因而导致了未受累免疫球蛋白的抑制[16]。MM中CD4以及CD4亚群细胞百分率越高,多克隆IgM的水平越低[17]。另有研究[18]表明在MM中观察到的CD8+、 CD11b+ 和辅助性T细胞数量的上升会导致单克隆免疫球蛋白分泌水平的升高以及分泌多克隆免疫球蛋白的B细胞数量的减少。此外,骨髓瘤的浆细胞高表达TGF-β1,TGF-β1的水平与骨髓瘤的免疫不全麻痹相关,可能的机制如下:TGF-β1介导成视网膜细胞瘤蛋白表达的抑制,导致单克隆恶性浆细胞以及多克隆B细胞的分化成熟障碍,进一步导致了多克隆B细胞免疫球蛋白分泌的减少[19]。在ISS分期II期或III期的患者中激活的吲哚胺2,3-二加氧酶1(IDO1)色氨酸可以促进Tregs激活分化发育成熟以及稳定,与此同时IDO1对效应T细胞的功能也造成了抑制[20]。正常情况下骨髓中浆细胞数量动态稳定,骨髓中存在浆细胞分化生长的空间,但当骨髓瘤发生时,恶性增殖的B细胞抢占了骨髓壁龛,导致了循环中多克隆B细胞数目的减少,并且对于骨髓内各种正常的细胞的功能造成抑制,这些也可以部分解释免疫不全麻痹的产生。此外,患者在治疗结束后免疫不全麻痹得到了改善,甚至完全恢复正常,这表明骨髓瘤中B细胞分泌免疫球蛋白的抑制是一种可逆的现象。
4 结论
在MM中免疫不全麻痹的现象非常常见;与未合并免疫不全麻痹的MM患者相比,合并的患者肿瘤负荷更重;MM患者分期及受累单克隆IgA、IgG水平越高,免疫不全麻痹程度越重;MM患者诱导治疗疗效越佳,免疫不全麻痹改善的程度越高;含免疫调节剂的方案有助于MM患者免疫不全麻痹改善;MM患者感染倾向与免疫不全麻痹不相关。
