皮肤恶性肿瘤中P53、Survivin、Bcl-2、Bax、Caspase-3的表达情况及相关性研究
2021-09-14杨静,蔡梅
杨 静,蔡 梅
(昆明医科大学第二附属医院皮肤科,云南 昆明 650101)
皮肤恶性肿瘤是一类累及表皮、皮肤附属器或黑色素细胞等成分的疾病,主要包括基底细胞癌(basal cell carcinoma,BCC)、鳞状细胞癌(squamous cell carcinoma,SCC)、皮肤恶性黑素瘤(cutaneous malignant melanoma,CMM)等。随着环境及生活方式的改变国内外皮肤恶性肿瘤的发病人数均出现了逐年增加的趋势[1-3],成为备受世界关注的公共卫生问题。恶性肿瘤的发生、发展是一个多因素参与的复杂过程,相关研究表明其主要原因可能是恶性肿瘤细胞的无限增殖与细胞凋亡障碍,即细胞增殖与细胞凋亡失衡所致,而细胞凋亡调节系统的紊乱又是细胞增殖凋亡失衡的主要原因[4],皮肤恶性肿瘤作为最常见的肿瘤之一,其发生发展也与细胞凋亡有关,从该方面研究皮肤恶性肿瘤具有重要意义。本研究通过检测皮肤恶性肿瘤组织组织液中的肿瘤凋亡蛋白(P53、Survivin、Bcl-2、Bax、Caspase-3)的表达量及彼此的相关性,以期为后续深入研究细胞凋亡机制在皮肤恶性肿瘤的作用提供依据,为皮肤恶性肿瘤的诊治提供新思路。
1 资料与方法
1.1 一般材料 病例为2018年12月至2020年12月期间在昆明医科大学第二附属医院皮肤科行皮肤外科手术并进行了病损组织病理学活检且取得患者知情同意的41例患者。41例病例中病理学活检诊断为皮肤恶性肿瘤的共25例(BCC10例、SCC10例、CMM10例),男性13例(52.00%),女性12例(48.00%);年龄(25~93)岁,平均年龄(62.15±14.50)岁;诊断为皮肤良性肿瘤的8例(瘢痕疙瘩),男性4例(50.00%),女性4例(50.00%),平均 年龄(59.07±10.30)岁;诊断为非皮肤肿瘤的8例(表皮囊肿),男性4例(50.00%),女性4例(50.00%),平均年龄(60.23±6.41)岁。把组织病理学检查诊断为皮肤恶性肿瘤的设为实验组,诊断为皮肤良性肿瘤的设为良性对照组,诊断为非皮肤肿瘤的设为正常对照组。三组患者年龄、性别比较,差异无统计学意义(P>0.05),见表1。
表1 不同组间人口学资料比较(±s)
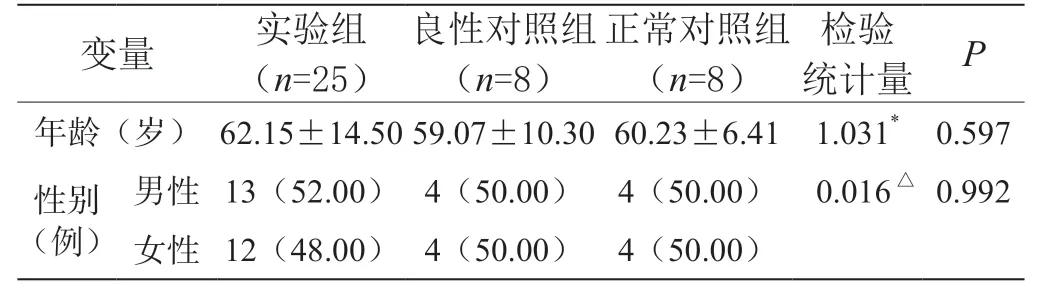
表1 不同组间人口学资料比较(±s)
注:*为Kruskal-Wallis H检验,△为卡方检验。
变量 实验组(n=25)良性对照组(n=8)正常对照组(n=8)检验统计量 P年龄(岁)62.15±14.5059.07±10.3060.23±6.41 1.031* 0.597性别(例)男性 13(52.00) 4(50.00) 4(50.00) 0.016△0.992女性 12(48.00) 4(50.00) 4(50.00)
1.2 实验方法 病例行手术切除病损组织后将组织平均分为2份,一份立即倒入4%福尔马林溶液固定进行常规组织病理学检查;另一份即时装入-70℃超低温冰箱保存,待病例全部收集完后每一份标本取50mg充分研磨制备成组织匀浆行ELISA检测肿瘤凋亡蛋白P53、Survivin、Bcl-2、Bax、Caspase-3的表达量。P53、Survivin、Bcl-2、Bax、Caspase-3 ELISA检 测试剂盒购自美国基因公司,酶标仪为BIO-RAD model 550(美国)。
1.3 统计学方法 采用SPSS 23.0软件进行统计学分析,P53、Survivin、Bcl-2、Bax、Caspase-3的测定数据以(±s)表示,根据分组采用方差分析比较组间差异,两两比较使用SNK法。实验组内P53、Survivin、Bcl-2、Bax、Caspase-3表达相关性使用Pearson相关性分析。检验水准均为α=0.05。
2 结果
2.1 不同组间P53、Survivin、Bcl-2、Bax、Caspase-3表达差异 实验组患者组织匀浆中P53、Survivin、Bcl-2含量明显高于良性对照组及正常对照组,Bax及Caspase-3含量低于良性对照组及正常对照组,差异存在统计学意义(P<0.05)。良性对照组与正常对照组间P53、Survivin、Bcl-2、Bax、Caspase-3的含量差异无统计学意义(P>0.05),见表2。
表2 不同组间P53、Survivin、Bcl-2、Bax、Caspase-3蛋白表达差异(±s,pg/ml)

表2 不同组间P53、Survivin、Bcl-2、Bax、Caspase-3蛋白表达差异(±s,pg/ml)
注:*为与实验组比较P<0.05,#为P<0.05。
组别 例数 P53 Survivin Bcl-2 Bax Caspase-3实验组 25 4 924.25±327.20 2 405.76±410.09 409.05±59.30 17.04±1.59 158.85±17.02良性对照组 8 4 536.95±306.92* 1 941.84±204.57* 289.96±35.86* 21.88±2.03* 175.74±10.64*正常对照组 8 4 247.28±458.22* 1 892.57±228.70* 327.40±55.75* 20.78±2.92* 176.66±16.36*F— 6.598 15.017 12.563 12.488 3.437 P—<0.001# <0.001# <0.001# <0.001# 0.018#
2.2 实验组不同肿瘤P53、Survivin、Bcl-2、Bax、Caspase-3表达差异 实验组的25例病例中,按照疾病诊断分为BCC组(10例),SCC组(10例)及CMM组(5例),CMM组的Survivin、Bcl-2含量高于BCC组及SCC组,差异存在统计学意义(P<0.05),而BCC组及SCC组的Survivin、Bcl-2含量差异无统计学意义。此外,三组间的P53、Bax、Caspase-3含量差异无统计学意义,见表3。
表3 实验组不同肿瘤P53、Survivin、Bcl-2、Bax、Caspase-3表达差异(±s,pg/ml)

表3 实验组不同肿瘤P53、Survivin、Bcl-2、Bax、Caspase-3表达差异(±s,pg/ml)
注:*为与BCC组比较P<0.05,△为与SCC组比较P<0.05,#为P<0.05。
组别 例数 P53 Survivin Bcl-2 Bax Caspase-3 BCC 10 4 823.53±244.52 2 154.75±318.57 383.97±52.27 17.55±1.82 153.20±18.67 SCC 10 4 958.14±413.54 2 389.65±341.53 404.75±62.43 17.10±1.42 162.58±14.33 CMM 5 5 056.91±269.87 2 939.98±58.06*△ 467.79±15.79*△ 15.86±0.93 162.71±18.96 F—0.933 11.462 4.303 2.062 0.912 P—0.408 <0.001# 0.026# 0.151 0.416
2.3 实验组P53、Survivin、Bcl-2、Bax、Caspase-3表达相关性 实验组的P53、Survivin、Bcl-2、Bax、Caspase-3进行Pearson相关性分析发现均无相关性,P>0.05。
3 讨论
细胞凋亡是一种由凋亡相关蛋白调控的程序化死亡,根据细胞凋亡的调控机制将细胞凋亡的相关蛋白分为促凋亡蛋白和抗凋亡蛋白,当细胞抗凋亡程序被激活和(或)促凋亡程序受抑制,该细胞将不能凋亡而长期存活,相关研究表明细胞凋亡与肿瘤发生关系密切[5]。本研究纳入的P53、Survivin、Bcl-2、Bax、Caspase-3均为重要的细胞凋亡调控蛋白。
P53蛋白是重要的凋亡调蛋白,分为野生型和突变型,野生型P53蛋白是目前最为明确的肿瘤抑制蛋白,但同时在超过50%的恶性肿瘤中均发现P53基因发生突变,并导致该基因产生的P53蛋白失去了对细胞生长、凋亡和DNA修复的调控作用,因而突变型P53蛋白也被视作抗凋亡蛋白,在肿瘤组织中呈现出高表达,且表达量越高肿瘤恶性增殖能力越强[6-7],本研究发现与对照组相比P53蛋白在皮肤恶性肿瘤组呈现出高表达,与前述观点一致;但在皮肤恶性肿瘤中,恶性程度较高的CMM与恶性程度相对较低的SCC及BCC中P53蛋白表达无明显差异,与前述结果存在差异,造成这种差异的原因可能是因为本研究纳入样本相对较少,后续还需要更大样本及更深入的研究,探讨相关原因。Survivin蛋白也称为生存蛋白,是抗凋亡蛋白家族的新成员,于二十世纪末被发现,与肿瘤的发生发展密切相关,高表达于绝大多数肿瘤组织[8],本研究也支持上述观点,该蛋白在皮肤恶性肿瘤组呈现出高表达,且肿瘤恶性程度越高表达越活跃。Bcl-2蛋白,也称B细胞淋巴细胞瘤/白血病-2蛋白,可以明显抑制细胞凋亡,在肿瘤细胞凋亡研究中备受重视,本研究发现该蛋白在皮肤恶性肿瘤组织中呈现出高表达,可能与其主要功能是延长细胞寿命、抑制细胞凋亡[9],同时其表达能促使肿瘤细胞的增殖相关[10],同时本研究还发现皮肤肿瘤恶性程度越高其表达越活跃。
Bax蛋白与Bcl-2蛋白具有高度的同源性,但发挥了截然相反的功能[11],本研究发结果支持了上述观点,作为一种促凋亡蛋白,Bax蛋白在皮肤恶性肿瘤中表达量更低。Caspase-3蛋白为Caspase家族在细胞凋亡通路中一个最主要的凋亡蛋白,是介导细胞凋亡的重要效应因子,当Caspase-3蛋白激活时,其下游便呈现出一系列级联反应,使细胞凋亡不能避免,相关研究指出,Caspase-3可介导多数细胞凋亡因子引起的细胞凋亡[12],本研究也得出相同结论,作为一种促凋亡蛋白,Caspase-3蛋白在皮肤恶性肿瘤中也出现了表达量更低的情况,细胞凋亡失衡可能是皮肤恶性肿瘤发病的重要机制,后续还需开展更深入的研究。
综上所述,皮肤恶性肿瘤组织中抗凋亡蛋白P53、Survivin、Bcl-2表达量上调,促凋亡蛋白Bax、Caspase-3表达量下调,抗凋亡蛋白Survivin、Bcl-2表达量在恶性程度更高的CMM中表达上调更明显,这种细胞凋亡调节系统的紊乱可能使肿瘤细胞逃避正常的细胞凋亡机制,实现异常分化增殖从而导致皮肤恶性肿瘤的形成和发展,可能是皮肤恶性肿瘤重要的发病机制之一,为后续利用细胞凋亡机制对皮肤恶性肿瘤进行诊断、治疗等研究提供了新的线索和思路。但同时我们也要认识到皮肤恶性肿瘤的发生、发展是一个多因素、多步骤及多阶段共同参与的复杂过程,后续还应进行更深入的研究,阐明相关机制。
