液相色谱-串联质谱法测定三文鱼中生物胺的不确定度分析
2021-09-11郑越男曹进孙珊珊郭亚辉罗娇依钱和
郑越男 曹进 孙珊珊 郭亚辉 罗娇依 钱和

摘要 [目的]评定液相色谱-串联质谱法测定三文鱼中生物胺的不确定度。[方法]样品经过5%三氯乙酸提取、正己烷除脂、丹磺酰氯丙酮溶液衍生化后,液相色谱-串联质谱分析三文鱼中9种生物胺的含量,对方法相对标准不确定度、标准不确定度、扩展不确定度进行评估。[结果]色胺、β-苯乙胺、腐胺、尸胺、酪胺、组胺、精胺、亚精胺、去甲基肾上腺素的平均值分别为4.30、5.59、5.72、6.21、4.85、5.48、7.18、6.79、4.77 mg/kg,扩展不确定度分别为0.46、0.56、0.48、0.54、0.42、0.50、0.64、0.55、0.41 mg/kg(k=2)。[结论]标准储备液的配制、稀释以及标准曲线的线性拟合对不确定度的贡献值最大,建议选用精度好的量器,规范试验操作与前处理步骤。
关键词 三文鱼;生物胺;液相色谱-串联质谱;不确定度
中图分类号 TS254.7 文献标识码 A 文章编号 0517-6611(2021)17-0189-06
doi:10.3969/j.issn.0517-6611.2021.17.050
Abstract [Objective]To evaluate the uncertainty of determination of biogenic amines in salmon by liquid chromatography tandem mass spectrometry.[Method]The samples were extracted with 5% trichloroacetic acid, defatted with n-hexane and derivatized with dansyl chloroacetone solution. The contents of 9 biogenic amines in salmon were analyzed by LC-MS/MS.The relative standard uncertainty, standard uncertainty and expanded uncertainty of the method were evaluated.[Result]The average values of tryptamine, β - phenylethylamine, putrescine, cadaverine, tyramine, histamine, spermine, spermidine and norepinephrine were 4.30, 5.59, 5.72, 6.21, 4.85, 5.48, 7.18, 6.79 and 4.77 mg/kg respectively, and the expanded uncertainty was 0.46, 0.56, 0.48, 0.54, 0.42, 0.50, 0.64, 0.55and 0.41 mg/kg respectively (k=2).[Conclusion]The preparation and dilution of standard stock solution and the linear fitting of standard curve have the greatest contribution to the uncertainty. It is suggested to select a measuring instrument with good accuracy and standardize the experimental operation and pretreatment steps.
Key words Salmon;Biogenic amine;Liquid chromatography tandem mass spectrometry;Uncertainty
三文鱼是鲑科鱼,主要分布在大西洋、太平洋和欧洲北极的海岸[1]。三文鱼味道鲜美、营养丰富,不饱和脂肪酸(DHA、EPA、DPA)、蛋白质及维生素等含量丰富[2],有助于儿童智力发育、预防心血管疾病、降低癌症发病率等[3]。我国冰鲜三文鱼进口量逐年增加,三文鱼消费市场庞大[4]。但是在贮存运输过程中,三文鱼肌肉组织在微生物的作用下,极易发生蛋白质的分解、腐败变质,产生生物胺等有毒代谢物[5]。生物胺是极性或半极性化合物的氮化有机碱,根据其结构差异,可以分为3类:脂肪族生物胺(如腐胺、尸胺、亚精胺、精胺、胍基丁胺等[6-7])、芳香族生物胺(如酪胺、苯乙胺、苯甲胺等[8])、杂环胺(如组胺、色胺、5-羟色胺等[9])。
目前多种方法用于测定食品中的生物胺,如液相色谱-串联质谱[10]、高效液相色谱[11]、薄层色谱[12]、毛细管电泳[13]、气相色谱、气相色谱-串联质谱[14]、生物传感器[15]和ELISA[16]等。其中液相色譜-串联质谱法可对食品基质中的生物胺快速准确地定量分析。Nalazek-Rudnicka等[17]基于LC-MS/MS分析啤酒样品中测定生物胺的差异,方法的检出限和定量限分别是0.54~4.30、1.60~13.00 ng/mL,该方法灵敏度高、特异性好。Ochi[18]通过反相液相色谱-串联质谱法测定咸鲭鱼中的腐胺、色胺、酪胺、组胺、β-苯乙胺、精胺、亚精胺、尸胺,8种分析物的平均回收率均在87%~118%,对生物胺快速准确进行定量分析。Gosetti等[19]建立了一种LC-MS/MS法同时测定尿液中16种生物胺,方法的检出限和定量限分别是0.3~6.6、1.0~21.9 μg/L,平均回收率在72.9%~100.0%。
测量不确定度是说明测量结果质量的参数,用来表征合理、赋予被测量数值分散性[20],用于评价测量结果的可信性、有效性、科学性,代表实验室测量水平[21]。但是目前评定液相色谱-串联质谱法测定三文鱼中生物胺的不确定度的报道较少。余晓薇等[22]通过高效液相色谱法对鱼和虾中的组胺含量进行测定,建立组胺不确定度分析方法。胡礼渊等[23]对GB/T 20768—2006《鱼和虾有毒生物胺的测定原理》进行不确定度评价,建立水产品中组胺含量不确定度评定方法。
笔者根据《测量不确定度标示指南》和JJF 1059.1—2012《测量不确定度评定与表示》,对液相色谱-串联质谱法测定三文鱼中生物胺的不确定度进行分析,以期为三文鱼中生物胺准确测定提供依据,也为实验室质量控制提供参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂。组胺(His)、精胺(Spe)、亚精胺(Spd)、尸胺(Cad)、腐胺(Put)、酪胺(Tyr)、色胺(Trp)均购自Bepure公司;β-苯乙胺(Phe)、去甲基肾上腺素(Ne)标准品购自上海吉尔生化有限公司;丹磺酰氯(LC-MS级)购自Sigma-Aldrich公司;乙腈(LC-MS级)、甲醇(HPLC级)、正己烷(HPLC级)均购自Thermo fisher公司;高氯酸(分析纯)、三氯乙酸(分析纯)、氢氧化钠(分析纯)、碳酸氢钠(分析纯)、氨水(分析纯)、盐酸(分析纯)均購自国药集团化学试剂有限公司。
1.1.2 主要仪器。UPLC-Xevo TQ-S超高效液相色谱串联三重四级杆质谱仪,购自美国Waters公司;ACQUITY UPLC HSST3(2.1 mm×100 mm,1.8 μm)色谱柱,购自美国Waters公司;ZWF-110X30恒温水浴摇床,购自上海智城分析仪器制造有限公司;CF16RX Ⅱ离心机,购自日本HITACHI公司。
1.2 方法
1.2.1 标准溶液的配制。
1.2.1.1 标准储备液的配制。称取色胺、β-苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺标准品适量,用0.1 mol/L HCl配制成质量浓度各为1 mg/mL的标准储备液,置于-20 ℃冰箱储存备用,保存期为4个月。
1.2.1.2 混合标准系列溶液的配制。临用前配制。取“1.2.1.1”储备液1 mL,用0.1 mol/L HCl稀释至100 mL,得到10 μg/mL的中间液,取标准品储备液0、10、50、100、500、1 000、2 000 μL用0.1 mol/L HCl定容至10 mL,得到浓度为0、0.01、0.05、0.10、0.50、1.00、2.00 μg/mL 的混合标准溶液。
1.2.2 样品制备。
1.2.2.1 样品提取。准确称取5.0 g代表性均质化样品置于50 mL离心管中,加入15 mL 5%三氯乙酸溶液,涡旋1 min,超声10 min,10 ℃下8 000 r/min离心5 min,上清液转移至50 mL离心管中。残渣中加入10 mL 5%三氯乙酸溶液,涡旋1 min,超声10 min,10 ℃下8 000 r/min离心5 min,合并上清液于上述离心管,待净化。
1.2.2.2 样品净化。向上述试样提取液中加入20 mL正己烷,涡旋振荡5 min,10 ℃下8 000 r/min离心5 min,弃去上层有机相,下层试样溶液加入20 mL正己烷再除脂一次,下层试样溶液转移至25 mL容量瓶用5%三氯乙酸溶液定容至刻度,待衍生。
1.2.2.3 样品衍生。分别移取上述提取液和生物胺标准系列溶液各0.1 mL,置于2 mL离心管中,依次加入100 μL 饱和碳酸氢钠溶液、20 μL 1 mol/L氢氧化钠溶液和0.1 mL丹酰氯溶液(10 mg溶于1 mL丙酮溶液),盖塞封口,60 ℃避光反应25 min。反应完毕后,加入10 μL氨水,60 ℃避光反应15 min终止反应,氮气吹干后用乙腈定容至1 mL,过0.2 μm 聚丙烯滤膜(GHP)滤膜后,待液质联用仪测定。
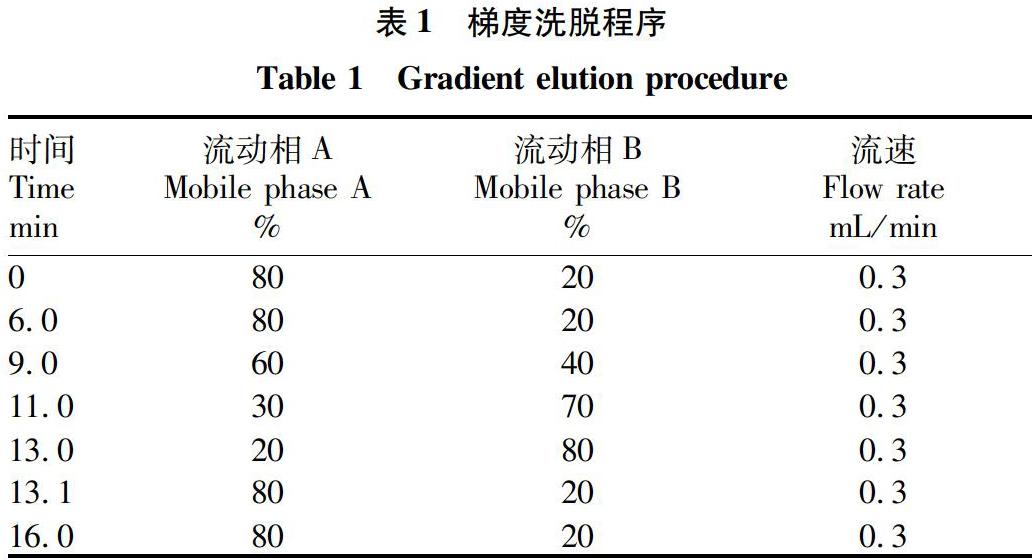
1.2.3 色谱条件。色谱柱为Waters ACQUITY UPLC BEH Shield RP18柱(2.1 mm×150 mm,1.7 μm);流动相A相为含0.1%甲酸的50%乙腈水溶液,B相为乙腈;柱温30 ℃;流速0.3 mL/min,进样量5 μL;流动相梯度见表1。
1.2.4 质谱条件。扫描方式为电喷雾正离子(ESI+)扫描;检测方式为多反应监测(MRM);毛细管电压3.0 kV;离子源温度120 ℃;脱溶剂气流量1 000 L/h,脱溶剂气温度500 ℃,锥形气体流速150 L/h。质谱检测参数见表2。
2 结果与分析
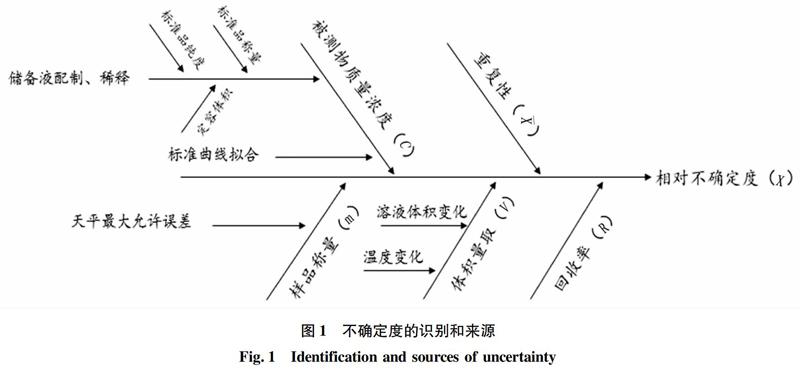
2.1 不确定度的识别和来源
依据测定步骤,对三文鱼中生物胺测定结果的不确定度的来源分析见图1。
2.2 不确定度的分析
2.2.1 被测定物质量浓度u(C)。标准储备液的配制、稀释以及标准曲线的线性拟合是影响被测定物质量浓度(C)带来的不确定度的主要过程。
2.2.1.1 标准储备液配制过程引入的不确定度u(C1)。
(1)根据标准物质证书所提供的标品纯度p和纯度误差,按均匀分布考虑,由纯度引入的不确定度和相对不确定度分别为u(p)=纯度误差/3、urel(p)=u(p)p,见表3。
(2)标准物质称量引入的不确定度由天平的最大允许误差带来,按均匀分布考虑u(m1)=0.013=0.005 77 mg、urel(m1)=u(m1)m1,见表4。
(3)标准储备液定容体积引入的不确定度u(Vv)主要来源于容量允差和温度的影响。配制标准储备溶液用到1次10 mL A级容量瓶。20 ℃ 时10 mL A级容量瓶容量允差为±0.02 mL,按三角形分布考虑,其标准不确定度为:u(V1)=n×容量允差/6=1×0.02/6=0.008 16 mL;urel(V1)=u(V1)V标=8.16×10-4。试验温度为(20±5)℃,20 ℃时水体积膨胀系数为0.207×10-4 ℃-1,浓盐酸(33%)体积膨胀系数为0.455×10-4℃-1,0.1 mol/L盐酸溶液中浓盐酸与水的体积比8.6∶991.14,则0.1 mol/L盐酸溶液平均体积膨胀系数为0.212×10-4 ℃-1,按温度波动为均匀分布,k=3,10 mL A级容量瓶由温度引起的体积不确定度为:u(VT1)=α×ΔT×V标×n3=0.006 12 mL;urel(VT1)=u(VT1)V标=6.12×10-4。
标准储备液定容体积引入的不确定度为:
2.2.1.2 标准储备溶液稀释过程引入的不确定度u(C2)。该过程为取1 mL储备液稀释至100 mL得到10 μg/mL中间液,按均匀分布处理,玻璃器具和温度波动引起的不确定度见表6,则
2.2.1.3 标准曲线拟合引入的不确定度u(C3)。配制标准系列曲线溶液,浓度(以色胺为例,其余8种生物胺与色胺的处理步骤相同)分别为0.962、4.810、9.620、24.050、48.100、96.200 ng/mL,重复测定2次,以浓度为横坐标、峰面积为纵坐标绘制标准曲线。向空白样品中加入一定含量的色胺得到阳性样品浓度为C0,按样品测定步骤处理后重复测定3次,其结果见表7。标准曲线拟合引入的不确定度的计算公式为:
综合标准储备液配制、稀释、标准系列溶液配制、标准曲线拟合引入的不確定度,被测定物质质量浓度引入不确定度为:
2.2.2 测量重复性产生的不确定度u()。测定生物胺的加标回收率,平行测定6次,计算平均含量、标准偏差 S(),并计算回收率引入的不确定度和相对不确定度:u()=S()/6、urel()=u()/,具体见表9。
2.2.3 回收率产生的不确定度u(R)。根据测定回收率,计算平均回收率、标准偏差 S(R),并计算回收率引入的不确定度和相对不确定度:u(R)=S(R)/6、urel(R)=u(R)/R,具体见表10。用显著性检测来确定平均回收率是否与1.0有显著性差异。检测统计数据T=|1-|uR,设置信水平为95%,查表得t95(6)=2.45,9种生物胺的T值均大于t95(6),说明差异性显著,u(R)可以用于结果校正。
2.2.4 体积量取产生的不确定度u(V)。
2.2.4.1 溶剂体积量取引入的不确定度u(V溶剂)。样品经衍生后,氮气吹干,1 mL乙腈定量引入u(V溶剂),按均匀分布,1 mL移液器容量带来的不确定度为u(Vv1)=0.01/3=0.005 77 mL、urel(Vv1)=u(Vv1)V乙腈=0.005 771=0.005 77。温度波动引起的乙腈的体积变化带来的不确定度按均匀分布计算得u(VT2)=α(乙腈)×5×13 =1.37×10-3×5×13=0.003 95 mL、urel(VT2)=u(VT2)V乙腈=0.003 95。溶剂体积量取引入的不确定度u(V溶剂)=u(Vv1)2+u(VT2)2=0.006 995 mL,溶剂体积量取引入的相对不确定度urel(V溶剂)=urel(Vv1)2+urel(VT2)2=0.006 995。
2.2.4.2 仪器进样体积引入的不确定度u(V仪器)。u(V仪器)=进样针容积相对标准偏差/3=0.01/3=0.005 77 μL、urel(V仪器)=u(V仪器)进样体积=0.005 775=0.001 15;
体积量取产生的不确定度:u(V)=u(V溶剂)2+u(V仪器)2=0.009 07、
urel(V)=urel(V溶剂)2+urel(V仪器)2=0.007 04。
2.2.5 样品称量引起的不确定度u(m)。称5.0 g样品,天平最大允许误差为±0.1 mg,假设均匀分布,u(m)=0.1/3=0.057 7 mg、urel(m)=u(m)/m=0.057 7×10-3/5.0=1.154×10-5。
2.3 相对标准不确定度的合成
液相色谱-串联质谱测定三文鱼中生物胺的合成相对标准不确定度urel(X)及合成标准不确定度u(X)为
2.4 扩展不确定度
根据 JJF 1059.1—2012,U=u(X)×k,k为包含因子,取p=95%的置信概率,包含因子k=2,基于UPLC-MS/MS的柱前衍生法测定三文鱼中生物胺含量的结果见表12。
3 结论
该试验评价了三文鱼中生物胺的液相色谱-串联质谱法的不确定度,色胺、β-苯乙胺、腐胺、尸胺、酪胺、组胺、精胺、亚精胺、去甲基肾上腺素的含量分别为4.30±0.46、5.59±0.56、5.72±0.48、6.21±0.54、4.85±0.42、5.48±0.50、7.18±0.64、6.79±0.55、4.77±0.41 mg/kg。结果表明,试验操作步骤中会多方引入不确定度,分析发现标准储备液的配制、稀释以及标准曲线的线性拟合对不确定度的贡献值最大,回收率次之。在试验过程中,操作人员熟练水平的提升、仪器的及时维护、平行样本测定次数的增加等方法可减小测量结果的不确定度。
参考文献
[1] GUILLAUD E,CORNETTE R,BAREZ P.Is vertebral form a valid species-specific indicator for salmonids? The discrimination rate of trout and Atlantic salmon from archaeological to modern times[J].Journal of archaeological science,2016,65:84-92.
[2] SPRAGUE M,FAWCETT S,BETANCOR M B,et al.Variation in the nutritional composition of farmed Atlantic salmon(Salmo salar L.)fillets with emphasis on EPA and DHA contents[J/OL].Journal of food composition and analysis,2020,94[2020-11-05].https://doi.org/10.1016/j.jfca.2020.103618.
[3] TURCHINI G M,EMERY J A,TRUSHENSKI J,et al.Distinguishing the nutritional requirements and physiological fate of dietary EPA and DHA in Atlantic salmon[J].Journal of nutrition & intermediary metabolism,2014,1:9-10.
[4] 马聪聪.基于蛋白组学的三文鱼物种鉴别及新鲜度变化机理研究[D].石家庄:河北科技大学,2020.
[5] BARDCZ S.Polyamines in food and their consequences for food quality and human health[J].Trends in food science & technology,1995,6(10):341-346.
[6] PAPAGEORGIOU M,LAMBROPOULOU D,MORRISON C,et al.Literature update of analytical methods for biogenic amines determination in food and beverages[J].TrAC trends in analytical chemistry,2018,98:128-142.
[7] 赵丽,姚秋虹.食品安全检测新方法[M].厦门:厦门大学出版社,2019.
[8] 何璇,马堃,哈斯,等.食品中生物胺形成与抑制的研究进展[J/OL].食品与发酵工业,2021-03-24[2021-03-25].https://doi.org/10.13995/j.cnki.11-1802/ts.026163.
[9] RUIZ-CAPILLAS C,JIMNEZ-COLMENERO F.Biogenic amines in meat and meat products[J].Critical reviews in food science and nutrition,2004,44(7/8):489-499.
[10] SAGRATINI G,FERNNDEZ-FRANZN M,DE BERARDINIS F,et al.Simultaneous determination of eight underivatised biogenic amines in fish by solid phase extraction and liquid chromatography-tandem mass spectrometry[J].Food chemistry,2012,132(1):537-543.
[11] 高慧,汪洋,邢燕,等.分散固相萃取-柱前衍生-高效液相色谱法测定人体尿样中6种生物胺[J].现代预防医学,2020,47(20):3797-3801,3830.
[12] 李燕君.薄层色谱法检测黄酒生物胺的研究[J].广州化学,2017,42(4):18-25.
[13] AN D,CHEN Z Q,ZHENG J C,et al.Determination of biogenic amines in oysters by capillary electrophoresis coupled with electrochemiluminescence[J].Food chemistry,2015,168:1-6.
[14] WOJNOWSKI W,NAMIES'NIK J,POTKA-WASYLKA J.Dispersive liquid-liquid microextraction combined with gas chromatography-mass spectrometry for in situ determination of biogenic amines in meat:Estimation of meats freshness[J].Microchemical journal,2019,145:130-138.
[15] AHANGARI H,KURBANOGLU S,EHSANI A,et al.Latest trends for biogenic amines detection in foods:Enzymatic biosensors and nanozymes applications[J].Trends in food science & technology,2021,112:75-87.
[16] LI Y F,LIN Z Z,HONG C Y,et al.Histamine detection in fish samples based on indirect competitive ELISA method using iron-cobalt co-doped carbon dots labeled histamine antibody[J].Food chemistry,2021,345:128812.
[17] NALAZEK-RUDNICKA K,KUBICA P,WASIK A.Discrepancies in determination of biogenic amines in beer samples by reversed phase and hydrophilic interaction liquid chromatography coupled with tandem mass spectrometry[J].Microchemical journal,2020,159:105574.
[18] OCHI N.Simultaneous determination of eight underivatized biogenic amines in salted mackerel fillet by ion-pair solid-phase extraction and volatile ion-pair reversed-phase liquid chromatography-tandem mass spectrometry[J].Journal of chromatography A,2019,1601:115-120.
[19] GOSETTI F,MAZZUCCO E,GENNARO M C,et al.Simultaneous determination of sixteen underivatized biogenic amines in human urine by HPLC-MS/MS[J].Analytical and bioanalytical chemistry,2013,405(2/3):907-916.
[20] 左兆迎,臧海燕,劉娓娓.检测实验室不确定度评定的关键点及控制措施[J].质量与认证,2021(4):46-48.
[21] 郝栋栋,张艳,赵娜.如何满足实验室认可对不确定度评定的相关要求[J].质量与认证,2021(4):49-51.
[22] 余晓薇,陈俊玉,王碧生,等.鱼和虾中组胺残留量HPLC法测定的不确定度评定[J].福建畜牧兽医,2015,37(1):3-6.
[23] 胡礼渊,孙高英,廖和菁.液相色谱测定水产品中组胺含量不确定度评估[J].食品研究与开发,2015,36(1):106-109.
