脑梗死患者PEAR1、PTGS1基因交互作用与阿司匹林抵抗的相关性分析
2021-09-11王玲玲
王玲玲,杨 华,高 妍
(北华大学附属医院,吉林 吉林 132011)
有研究[1]显示:动脉粥样硬化是缺血性脑梗死(cerebral infaction,CI)最常见的病因.在动脉粥样硬化血栓形成的过程中,血小板在发病机制中起核心作用,可引起血流剪切力重构,促使血小板活化与聚集.因此,抗血小板药物治疗在缺血性脑卒中患者的急性期治疗及Ⅱ级预防中具有重要作用.在《中国急性缺血性脑卒中诊治指南2018》中推荐,缺血性脑卒中患者应在明确诊断后尽早给予口服阿司匹林150~300 mg/d治疗(Ⅰ级推荐,A级证据)[2].目前,已有大约100个随机临床试验证实了阿司匹林在预防缺血性卒中方面的有效性和安全性[3].然而,由于个体差异,患者应用阿司匹林后,仍有缺血性脑卒中事件发生,即阿司匹林抵抗(Aspirin resistance,AR).因此,为提高阿司匹林的治疗效果,探讨阿司匹林抵抗的机制尤为重要.本研究以缺血性脑卒中患者尿液11-DH-TXB2含量(2 500 pg/mg)为阿司匹林抵抗的界定标准,探讨PEAR1和PTGST基因型与缺血性脑卒中患者阿司匹林抵抗的关系,为缺血性脑卒中患者应用合理的Ⅰ级和Ⅱ级防治提供参考.
1 资料与方法
1.1 临床资料
选择2019年8月—2020年9月在北华大学附属医院神经内科住院的100例患者为研究对象,所有患者均符合《中国急性缺血性卒中诊治指南2018》的诊断标准,并经过头部CT及MRI明确有新发病灶且满足规律服用阿司匹林(100 mg/d)单抗治疗.尿液11-DH-TXB2含量小于2 500 pg/mg为活性正常,即阿司匹林敏感(Aspirin sensitivity,AS)组(85例,其中,男57例,女28例;年龄30~89岁,平均(63.31±11.26)岁);尿液11-DH-TXB2含量大于2 500 pg/mg为活性异常,即阿司匹林抵抗(AR)组(15例,其中,男13例,女2例;年龄43~84岁,平均(63.28±10.18)岁).本研究纳入的患者均经北华大学附属医院伦理委员会批准,并签署知情同意书.
1.2 研究方法
记录所有入组患者一般情况和既往病史,包括性别、年龄、体质量指数(BMI)、吸烟史、饮酒史、高血压病史、糖尿病史.
尿液11-DH-TXB2测定及判断标准:所有入组患者入院次日清晨留取中段尿液,通过酶联免疫吸附试验(ELISA)测定11-DH-TXB2.
基因型多态性检测:应用荧光检测仪及测序反应通用试剂盒(博奥生物科技有限公司)进行基因型分析.检测样本要求2~3 mL静脉全血(空腹及进食均可),使用一次性真空抽血管采集,于4 ℃低温保存,保存时间不宜超过24 h.
数据赋值:将所有入组患者的物理指标及尿液11-脱氢血栓烷B2(11-DH-TXB2)结果进行赋值,计数变量包括性别(男:1、女:2)、高血压病史、糖尿病史、吸烟史、饮酒史(均为否:0、是:1),尿液11-脱氢血栓烷B2(11-DH-TXB2)(质量分数小于2 500 pg/mg:0、大于2 500 pg/mg:1).
1.3 统计学分析
应用SPSS 20.0对数据进行处理与统计学分析,计数资料用百分率(%)或构成比表示,组间差异采用χ2检验或Fisher确切概率法;将单因素分析P<0.05的变量纳入多因素logistic回归分析,两因素交互作用的研究采用相加模型,以P<0.05为差异具有统计学意义.
2 结 果
2.1 一般资料及基因型与阿司匹林抵抗的单因素分析
两组基线临床资料比较,结果显示:PEAR1基因型、性别、BMI、高血压、糖尿病、吸烟、饮酒史两组间比较差异无统计学意义(P>0.05).阿司匹林抵抗组PTGS1基因GG比例高于敏感组,两组间比较差异具有统计学意义(P<0.05).见表1.
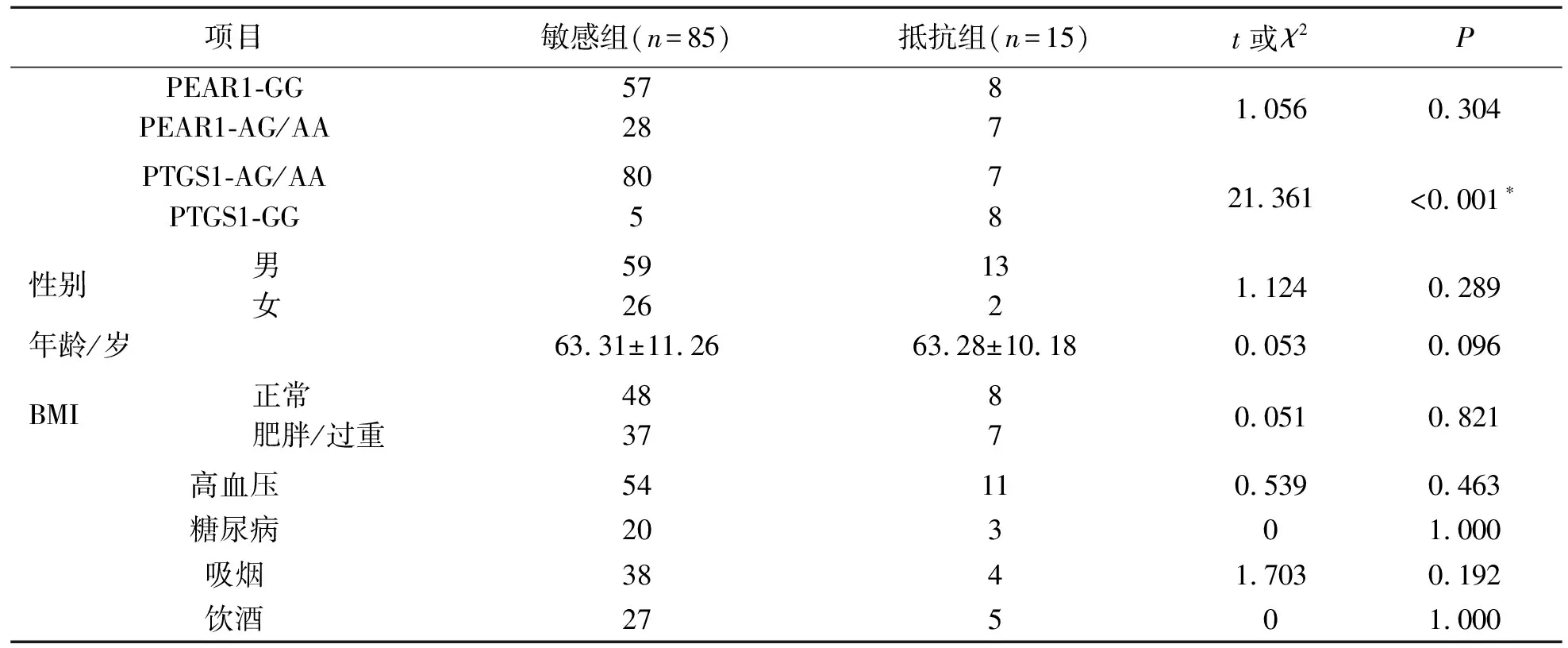
表1 一般资料Tab.1 General data
2.2 PEAR1、PTGS1基因型与阿司匹林抵抗的Logistic回归分析
PEAR1、PTGS1基因型与阿司匹林抵抗的Logistic回归分析结果显示:PTGS1与AR呈正相关,GG基因型患者发生AR的概率是AG/AA基因型的16.495倍(95%CI 4.076~66.754),因此,基因PTGS1 GG型是AR的危险因素.PEAR1基因与AR无相关性(P>0.05).见表2.

表2 PEAR1、PTGS1基因型与阿司匹林抵抗的Logistic回归分析Tab.2 Logistic analysis between genotype of PEAR1,PTGS1 and Aspirin resistance
2.3 PEAR1、PTGS1两基因型交互作用与阿司匹林抵抗的关系
以干扰因素阴性(-/-)为对照度分析其交互作用,取OR值为1,结果显示:PTGS1基因多态性为GG型且PEAR1基因多态性为AG/AA时,OR值增加,两基因对阿司匹林抵抗的发生存在交互作用,RERI=9.343,API=17.628%.见表3.

表3 基因型PEAR1与PTGS1的交互作用Tab.3 Interaction between PEAR1 and PTGS1
3 讨 论
目前,缺血性脑卒中呈日益渐增的趋势,且越发年轻化,因此,缺血性脑卒中的Ⅰ级和Ⅱ级预防显得尤为需要.阿司匹林是一种较为常见的抑制血小板聚集药物,目前,被普遍用于脑梗死的防治中,可有效改善脑梗死的发生和再发率,降低死亡率[4-5].据报道[6],有部分患者服用阿司匹林的患者对阿司匹林敏感性降低,导致血小板聚集不能被有效抑制,再次发生临床血栓事件.根据临床观察及研究发现,部分患者虽然规律口服常规剂量阿司匹林,仍然不能达到预期的疗效,即产生阿司匹林抵抗.近年来,关于阿司匹林抵抗的机制备受关注,但尚不清楚其具体的发生机制,这可能与患者使用药物的依从性、年龄、性别、BMI、药物剂量、同时服用其他药物等因素有关.有研究[7]显示:基因多态性在AR过程中具有关键性作用.
目前,探讨阿司匹林抵抗的研究方法不一,尚未得到一致的诊断标准.尿液中11-DH-TXB2含量检测是目前临床针对阿司匹林代谢较为便捷的检测方法.血栓素(TX)A2是阿司匹林发挥药效的作用主体,但TXA2是一种不稳定的化合物,其血浆半衰期短于30 s,很难测量[8].TXA2迅速失活为TXB2,进一步脱氢为11-DH-TXB2,11-DH-TXB2是一种尿液中稳定的代谢物.大量研究[9-11]显示:11-DH-TXB2含量检测可反应体内TXA2总含量,并以尿液11-DH-TXB2含量2 500 pg/mg为界值划分是否存在阿司匹林抵抗.
本研究纳入100例脑梗死患者,其中,阿司匹林敏感组85例,阿司匹林抵抗组15例,比较分析两组的一般资料,结果显示:PEAR1基因型、性别、BMI和高血压、糖尿病、吸烟、饮酒史两组间比较差异无统计学意义(P>0.05).阿司匹林抵抗组PTGS1基因GG比例高于敏感组,两组间比较差异具有统计学意义(P<0.05),说明缺血性脑卒中患者PTGS1基因型GG与AR有关联.有研究[12-15]认为,PEAR1的一个基因变异位点(rs12041331)等位基因A的患者血小板聚集率相对减低;还有研究[16-17]也证实,GG基因型是阿司匹林抵抗的独立危险因素.而患者的性别、BMI、高血压史、糖尿病史、吸烟史及饮酒史对AR并不存在影响.将两组间PEAR1、PTGS1基因型与阿司匹林抵抗进行Logistic回归分析,结果显示:PTGS1是AR的影响因素,并且GG基因型患者发生AR的概率是AG/AA基因型的24.489倍(95%CI 4.910~122.150),说明通过多因素分析排除了多种混杂危险因素对统计结果的影响,PTGS1基因型GG在AR中具有独立的影响作用,在病因中占比较大(OR=24.489).
VOORA等[18]的研究通过对规律服用阿司匹林6个月后的患者进行随访,结果显示多个基因与体外阿司匹林抵抗相关.本研究并未发现PEAR1基因型与阿司匹林抵抗之间的关系(P>0.05),AR是多种危险因素交互作用下的结果,各因素间既各自独立,但又相互协同或拮抗影响.为进一步探讨基因多态性与AR之间的关系,本研究分析了PEAR1与PTGS1基因型之间的交互作用,结果发现PTGS1基因型为GG且PEAR1基因型为AG/AA时,RERI为9.343,API为17.628%,说明两基因多态性之间存在交互作用,提示当这两个因素共存时,17.628%的阿司匹林抵抗是由于两基因型交互协同作用所致,进一步说明PTGS1基因型为GG且PEAR1基因型为AG/AA共存时,阿司匹林抵抗的发生大于其他基因类型单独因素存在时所致的效应之和.
