尿苷二磷酸葡萄糖焦磷酸化酶(UGPase)基因调控不同地源灵芝孢子粉次生代谢产物的差异
2021-09-11李明成李亚晗刘佳琳兰春阳孙晓红赵万涛王立霞
李明成,李亚晗,刘佳琳,兰春阳,孙晓红,赵万涛,王立霞
(1.北华大学医学技术学院,吉林 吉林 132013;2.吉林省中药 DNA 指纹检测技术科技创新中心,吉林 吉林 132013;3.北华大学附属医院,吉林 吉林 132011)
灵芝(Ganodermalucidum)是我国传统健康食药用菌,《中国药典》记载,灵芝有赤芝和紫芝,其具有极高的药用价值和营养价值.市场上常见的有灵芝子实体和灵芝孢子粉.灵芝包含多种生物活性物质,其中灵芝多糖(Ganodermalucidumpolysacc- haride,GLP)是灵芝的次生代谢产物,存在于灵芝的菌丝体和子实体中,具有降血脂、降血糖、抗肿瘤等功效[1-3].我国灵芝是以栽培为主,灵芝的菌种及地理环境对灵芝的营养成分和GLP等活性物质影响很大[4-6].尿苷二磷酸葡萄糖焦磷酸化酶(UDP-glucose pyrophosphorylase,UGPase)已在植物的很多组织细胞中发现,大多数储存在胞液里,它是植物活化糖的主要存在形式,能够催化反应Glc-1-P+UTP转化为UDPG+PPi,为纤维素、蔗糖以及果胶质等的合成提供葡萄糖基[7].UGPase被认为是调节灵芝多糖合成的关键限速酶,可能与灵芝多糖合成密切相关[8-9].
目前,市售的灵芝加工品多为切制加工过的灵芝片、灵芝孢子粉或灵芝孢子粉胶囊,还有少数口服液等保健品.由于灵芝被切成片或打成粉后很难鉴别真伪,用树舌或其他菌类冒充灵芝加工品的情况时有发生.不同地源灵芝的生长环境和加工过程不同,也导致了灵芝产品质量千差万别[10].
本研究从生物分子学的角度出发,利用合成生物学的思路和方法,探究GLP的合成关键酶UGPase基因对GLP合成调控相关的关键元件特征,最终实现GLP活性天然产物代谢途径的高效异源表达,从而解决不同地域种植差异、活性天然产物来源不足、不易实现化学合成等问题[5].
1 材料与方法
1.1 实验材料
灵芝孢子粉(批号:121701-201401,规格:0.5 g)及D-无水葡萄糖(批号:110833-201908,规格:0.5 g)为中国食品药品检定研究院提供标准品.筛选不同地源干燥灵芝孢子粉共7批18份,分别购自云南、吉林、××堂(市售胶囊),每份质量100~250 g,由吉林市药检所金英兰主任药剂师鉴定真伪.
1.2 方 法
1.2.1 标准对照品与供试品溶液的制备
精密称量无水葡萄糖对照品0.5 g,置于500 mL容量瓶中,加水溶解,定容至刻度线,最终配制成质量浓度1 mg/mL的无水葡萄糖,为对照品贮存溶液.精密称量实验样本灵芝孢子粉2 g,放入三角烧瓶中,加水50 mL,静置30 min后沸水浴2 h,趁热真空抽滤,用双蒸水洗涤滤渣和滤器3次.将得到的洗涤液转移至圆底烧瓶中,于旋转蒸发器旋蒸20 min左右,将滤液浓缩到20 mL.取20 mL的浓缩液于离心管中,加入30 mL的无水乙醇,静置过夜.然后10 000 r/min离心10 min,弃掉上清液,于室温晾干,沉淀用热的双蒸水溶解,洗涤离心3次,冷却后,定容在500 mL容量瓶中,即可得供试品溶液.每份样品重复3次.
1.2.2 葡萄糖标准曲线绘制
精密量取标准对照品溶液0.1、0.2、0.3、0.4、0.5、0.6 mL,分别放入带塞子试管中,加双蒸水至1.0 mL,再加入5%苯酚溶液1.0 mL摇匀,然后沿试管壁缓慢注入5 mL浓硫酸溶液,摇动6 min,注意打开盖子释放出气体,室温放置5 min后,于沸水浴中加热10 min,取出并冷却至室温.使用1 cm的比色杯在490 nm处测得吸光度值,并将苯酚与硫酸作为溶剂用作空白对照.以无水葡萄糖的质量浓度(mg/mL)为横坐标、以吸光度(A)为纵坐标绘制标准曲线.
1.2.3 供试品灵芝孢子粉多糖含量的测定

1.2.4 灵芝UGPase基因的克隆
从NCBI数据库获取灵芝UGPase基因(Seq- uence:KM260167.10)及内参基因16SrRNA mRNA(AF493073.1)的序列基因,采用DNAStar等相关软件进行生物信息学分析及序列比较,选择同源性较高的区域,使用Primer Premier 5.0软件设计引物(见表1),引物由生工生物工程(上海)股份有限公司合成.
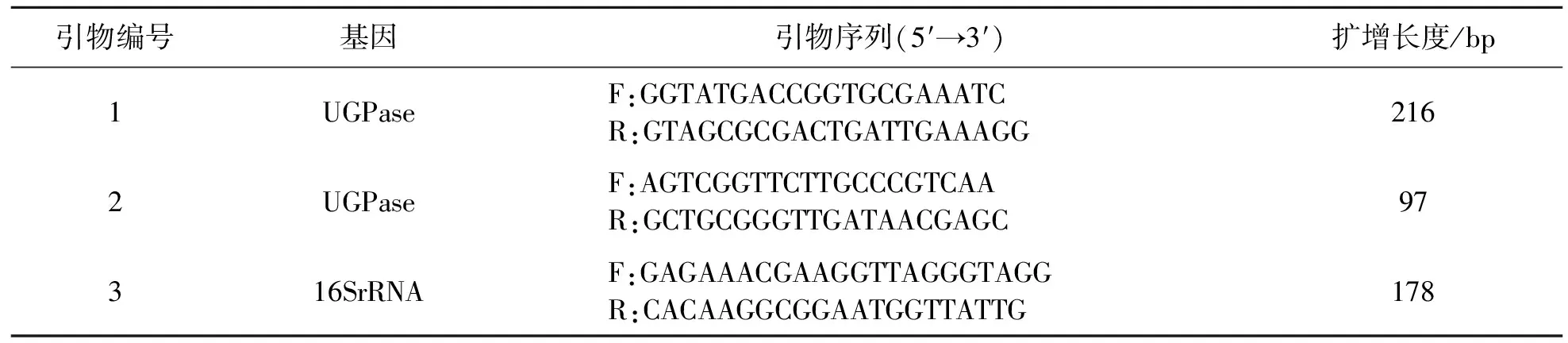
表1 基因及引物序列Tab.1 Gene and primers’ sequences
孢子粉细胞总RNA及进行cDNA合成:分别采用TaKaRa MinBEST Plant RNA Extraction Kit 和PrimeScriptTMRT reagent Kit with g DNA Eraser(TaK- aRa,Japan)试剂盒,按照说明书方法提取灵芝孢子粉细胞总RNA及进行cDNA合成,每个样品进行3次重复.应用1.0%琼脂糖电泳检测RNA完整性,应用Q6000核酸蛋白分析仪测定260、280 nm波长下总RNA浓度和纯度.制备的cDNA储存在-20 ℃的冰箱中.
PCR反应条件:95 ℃预变性3 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,40个循环;72 ℃延伸5 min.2%琼脂糖凝胶电泳,在紫外灯下进行琼脂糖凝胶中的目的条带切取,选用pGM-T连接试剂盒,T-A连接、转化及蓝白斑筛选与鉴定、重组质粒提取参考文献[11]进行.将鉴定正确的克隆质粒送至上海生工生物工程股份有限公司测序,结果应用BioEdit 软件比对,并登录NCBI网站进行Blast分析.
1.2.5 荧光定量PCR检测UGPase-mRNA及绘制荧光定量标准曲线
将初始浓度为1 ng/μL的灵芝标准品cDNA设为模板,梯度稀释至10-5ng/μL,每个稀释度各取0.4 μL,荧光定量PCR反应系统和反应条件参考文献[12]进行.使用Ct值作为纵坐标,使用模板的对数浓度作为横坐标绘制定量标准曲线.线性关系用来衡量重复样品数据和不同拷贝数的初始cDNA模板扩增效率是否相同,R2值表示实验数据满足衰减的线性程度.每个样品设置3个平行组,采用Excel软件统计内参基因与目的基因Ct值,2-ΔΔCt法计算目的基因的相对mRNA水平.
1.2.6 统计学分析

2 结 果
2.1 葡萄糖标准曲线的绘制
通过紫外分光光度计法以葡萄糖质量浓度为横坐标,吸光度为纵坐标绘制标准曲线见图1,得到回归方程为Y=0.11X+0.11,R2=0.983 7.
2.2 灵芝孢子粉样品GLP含量测定
精密吸取灵芝孢子粉供试品溶液1 mL,测其吸光度,根据标准曲线计算得到待测溶液中多糖的含量.经计算,云南孢子粉多糖含量为(2.887 0±0.005 9)%,吉林孢子粉多糖含量为(3.361 0±0.004 6)%,××堂孢子粉多糖含量为(2.399 0±0.005 3)%,其差异具有统计学意义(P<0.05).
2.3 UGPase基因克隆与鉴定
利用TIANSeq HiFi Amplification Mix高保真聚合酶克隆pUGPase-216 bp片段,目的基因均出现与目的条带大小相符的清晰明亮条带,说明UGPase基因克隆成功(见图2).克隆的质粒被送至生工生物工程(上海)股份有限公司进行测序,将测序结果与生物信息学软件BLAST工具和BioEdit进行比较,结果表明:每个克隆片段的核苷酸序列与GeneBank中的注册序列(Sequence:KM260167.1)相同,均为100% (见图3),证明克隆的DNA片段是目标基因的标准片段.克隆的片段存储在-20 ℃下,用于后续实验的对照.
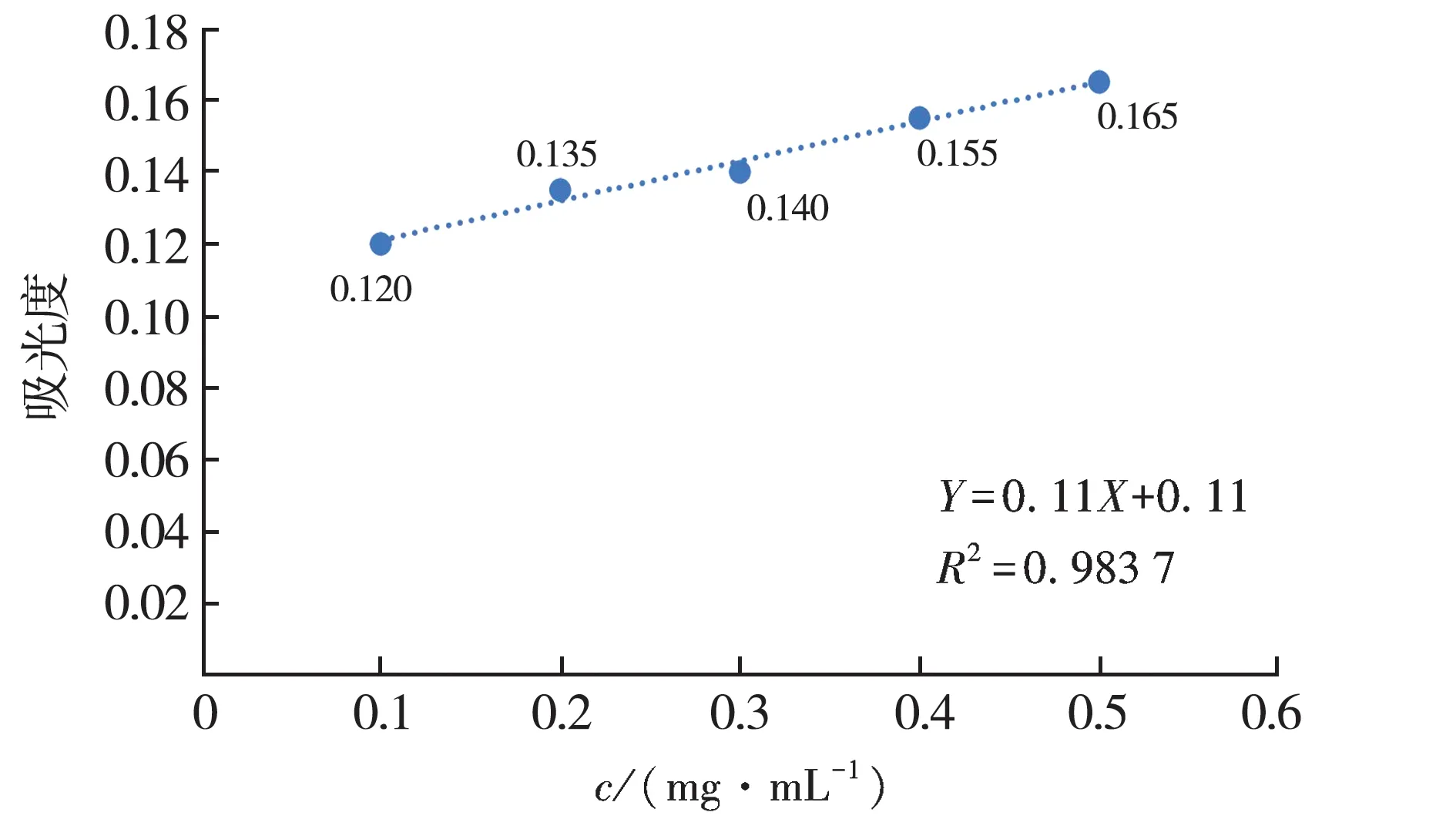
图1 葡萄糖标准曲线Fig.1Standard cure for glucose
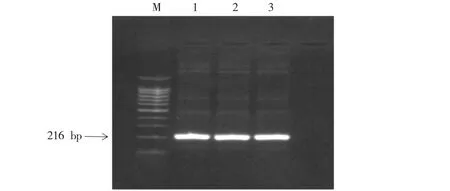
M.100 bp Ladder marKer;1~2.不同来源灵芝孢子粉pUGPase-216 bp;3.标准品pUGPase-216 bp.图2 PCR扩增灵芝孢子粉UGPase基因质粒琼脂糖凝胶电泳图谱 Fig.2Agrose gell electrophoresis of UGPase gene inserted into the plasmid amplified by PCR
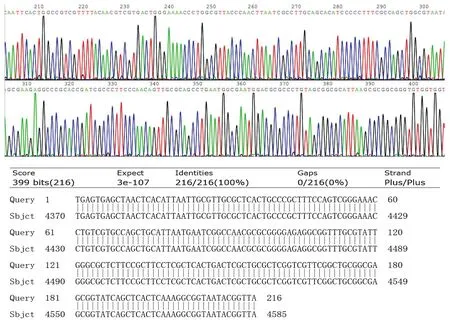
图3 质粒pUGPase-216 bp测序blast结果Fig.3Sequences and blast results of pUGPase-216 bp
2.4 UGPase基因与内参基因的扩增曲线及熔解曲线
根据标准曲线斜率计算目的基因UGPase和内参基因16SrRNA的扩增效率,分别为100.207%、100.109%,均接近100%,符合相对定量2-ΔΔCt法的计算要求.计算结果显示:样品反应指数明显扩增,梯度样品分布均匀,表明样品重复性好、扩增效率高、检测结果准确.荧光定量PCR的标准曲线见图4.每个样品设置3个重复,以灵芝孢子粉cDNA作为模板进行荧光定量PCR反应,得到目的基因UGPase和内参基因16SrRNA的熔解曲线和扩增曲线.虽然不同地源灵芝孢子粉有差异,但条带重复性及扩增效率较好,说明Ct值可信度高,可用于定量检测和统计学分析(见图5).熔解曲线出现单峰,无非特异性扩增和引物二聚体,表示扩增产物单一,引物特异性高,结果可靠(见图6).

图4 荧光定量PCR标准曲线Fig.4Fluorescence quantitative PCR standard cure

A.孢子粉UGPase基因扩增曲线;C.孢子粉内参基因扩增曲线.图5 目的基因UGPase与内参基因16SrRNA荧光定量PCR扩增曲线Fig.5Fluorescence quantitative PCR amplification curve for UGPase and 16SrRNA

A.孢子粉UGPase基因熔解曲线;C.孢子粉内参基因熔解曲线.图6 目的基因UGPase与内参基因16SrRNA荧光定量PCR熔解曲线Fig.6Fluorescence quantitative PCR melting curve for UGPase and 16SrRNA
2.5 荧光定量PCR检测UGPase-mRNA相对定量结果
选取堂孢子粉为对照,其他地源孢子粉作为实验组,计算其他地源孢子粉UGPase基因的相对表达量.本实验选用 2-ΔΔCt法以××堂孢子粉为对照组,计算目的基因的相对表达公式:2-ΔΔCt=2-[(Ct(测试组目的基因)-Ct(测试组内参基因))-(Ct(对照组目的基因)-Ct(对照组内参基因))].不同地源灵芝孢子粉UGPase基因相对定量结果显示,吉林产相对表达量含量为最高(见表2、图7).

表2 不同地源灵芝孢子粉UGPase-mRNA相对表达含量Tab.2 Relative expression contents of UGPase-mRNA among G.lucidum spore powder from different land sources

***.P<0.005.图7 不同地源灵芝孢子粉UGPase目的基因相对表达Fig.7Relative expression of UGPase-mRNA among G.lucidum spore powder from different land sources
3 讨 论
GLP被认为是灵芝主要生物活性成分,《中国药典》中记录GLP含量是评价灵芝品质优劣的关键因素.由于各地的气候和地理环境不同,灵芝加工品制作工艺不同,灵芝生物活性物质分离纯化技术不成熟等原因[13],导致灵芝品种之间存在差异,GLP的含量也千差万别.因此,针对其有效活性物质的合成途径、关键酶的功能鉴定、代谢机制及高表达的研究成为近几年的热门课题[14-16].
紫外-可见分光光度法和高效液相色谱法是目前使用较多的检测GLP含量的方法.本实验采用紫外-可见分光光度法定量检测GLP含量,相比高效液相色谱法具有快速、简单、性价比高等优点[17].苯酚-硫酸与糖类可生成黄橙色化合物,在490 nm处可以检测到吸光度,根据这个原理检测GLP,最后根据葡萄糖标准曲线计算出不同地源GLP含量[18].
本研究采集来自我国灵芝主产区样本,包括吉林长白山、云南文山.实验结果显示:不同来源的GLP含量差异较大,其中以吉林灵芝孢子粉GLP平均含量最高(3.361%).长白山地区夏季昼夜温差大,冬季严寒漫长,独特的森林资源,充足的地下水和肥沃的有机黑色土壤都为孕育高品质的灵芝提供了优良的自然环境,该地区灵芝孢子粉多糖含量相对较高[5,19].
灵芝孢子是灵芝成熟期从灵芝菌褶中弹射出来的极其微小的卵形生殖细胞,即灵芝的种子.灵芝孢子粉具有灵芝的全部遗传物质和保健作用,其药用价值日益受到重视,研究[20-22]发现:灵芝孢子具有增强机体免疫力、抑制肿瘤、保护肝损伤、辐射防护等作用.目前,市面上灵芝孢子粉价格远远高于子实体,市场上的灵芝孢子粉主要为普通灵芝孢子粉和灵芝孢子粉(破壁).而灵芝孢子粉(破壁)的市场价值明显高于灵芝子实体和未破壁灵芝孢子粉,现已成为市场上的主流产品[23].《国家卫生计生委办公厅关于破壁灵芝孢子粉有关问题的复函》(国卫办食品函〔2014〕390号)已明确,破壁灵芝孢子粉不宜作为普通食品原料,食品生产经营企业不得使用破壁灵芝孢子粉作为原料生产加工普通食品,不得经营含破壁灵芝孢子粉的普通食品.《2020年中国灵芝行业市场研究报告》显示:目前,国内生产企业数量及灵芝产品种类繁多.根据国家市场监督管理总局网站披露信息,截至2018年12月底,有药品批文或保健食品批文的灵芝及灵芝孢子粉产品分别有187个和1 157个,仅灵芝孢子粉每年产值近上百亿元.由于利益驱动,市场上灵芝孢子粉产品质量参差不一.我国2012年公布的《灵芝孢子粉采收集加工技术规范》(国家标准GB/T 29344-2012)要求以显微镜形态观察计算灵芝孢子数量为质量标准.随着孢子粉采收及深加工技术的不断升级,以及人们对孢子粉品质的要求越来越高,以GLP为质量标准会很快纳入孢子粉新的国家标准.
GLP的合成是涉及多个基因表达调控的过程,其中与UGPase的催化密不可分[24-26].由于本实验只涉及了UGPase基因转录水平上的表达,不同灵芝菌株间UGPase基因mRNA表达量存在显著差异,差异原因及具体作用机制有待进一步深入探究.
