核酸适配体生物传感器在食品中氟喹诺酮类兽药残留检测中的应用
2021-09-09宋亚宁胡超琼陈祥贵黄玉坤
宋亚宁,胡超琼,王 冲,陈祥贵,2,黄玉坤,2*
(1 西华大学食品与生物工程学院 成都 610039 2 宜宾西华大学研究院 食品非热加工重点实验室 食品非热加工工程技术研究中心 四川宜宾 644004)
氟喹诺酮类药物 (Fluoroquinolones,FQs)属于第3 代喹诺酮类药物,是一类由人工合成的广谱杀菌药,对革兰氏阴性菌和革兰氏阳性菌都有广泛的抗菌活性[1]。喹诺酮类药物母核结构如图1所示,其中R1通常为碱性氮杂环,其可以提高抗菌活性,改善药代动力学特征。R2和R3基团可以控制药物体内的抗菌活性,扩大抗菌范围。相较于第1 和第2 代喹诺酮类药物,第3 代的喹诺酮类药物对细胞膜的通透性更强,与细菌的结合能力更高,抗菌谱与抗菌活性也优于前两代。FQs 目前常被用于畜禽养殖、水产养殖中动物疾病的预防和治疗,然而,FQs 过量或不规范使用会造成抗生素兽药残留[2],通常以环丙沙星(Ciprofloxacin,CIP)、恩诺沙星(Enrofloxacin,ENR)、氧氟沙星(Ofloxacin,OFL)、诺氟沙星(Norfloxacin,NOR)、达氟沙星(Danofloxacin,DAN)等为主。此类兽药残留可能会导致生物蓄积性毒性[3],包括耐药细菌的产生,或耐药菌株通过食物链和环境污染从动物转移到人类,进而引起头晕、耳鸣、头昏、失眠、恶心、呕吐、胸闷、心悸、心慌、血压升高等不良反应[4]。中国、美国、欧盟和日本等国家都制定了FQs相关的最高残留限量 (Maximum residue limits,MRLs),我国及美国均规定,牛、羊的脂肪与肌肉、奶、肾、肝中的 MRLs 分别为100,100,200 μg/kg和300 μg/kg,猪、兔与家禽等其它动物的脂肪与肌肉、肝、肾中的MRLs 分别为100,200 μg/kg 和300 μg/kg[5-6]。在2015年我国农业部制定的2292号公告中[7],明确规定在食品动物中停止使用洛美沙星、培氟沙星、氧氟沙星、诺氟沙星4 种兽药。除此之外,国外也明令禁止包括FQs 的几种兽药的使用[7]。建立灵敏、有效的痕量FQs 检测方法是确保消费者健康的重要保障。
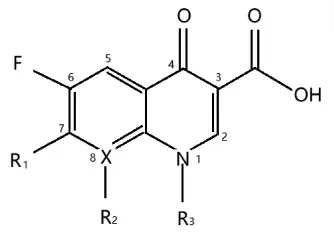
图1 喹诺酮类药物母核结构Fig.1 The mother nucleus structure of quinolones
目前,国内外建立了多种检测FQs 的方法,主要有微生物法、超高效液相色谱法、液相色谱-质谱联用法、免疫分析法等[8],这些方法往往因特异性弱、前处理复杂、仪器昂贵、耗时长等原因而不能大量应用于现场快速检测的实际操作中[2,9]。目前,在快速检测技术中利用抗体检测FQs 是较为常见的方法。随着适配体研究的不断深入,基于核酸适配体的FQs 检测方法具有显著优势,主要表现为体外易于合成,目标范围广,亲和力强,特异性较高以及受环境温度影响较小等方面。该技术在FQs 快速检测领域的应用具有较大的发展潜力[10]。基于此,本文主要概述国内外基于核酸适配体传感器检测FQs 分析方法的研究进展,阐述了比色法、电化学法、荧光法等各类生物传感器检测方法的原理、技术应用及优缺点,讨论现有检测方法存在的问题和未来检测技术的发展方向。
1 核酸适配体
核酸适配体(Aptamer,Apt)是一种通过体外配体指数富集系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)从人工构建的寡核苷酸文库中筛选出来的一段对靶标物质有高亲和力,并能够特异性识别的单链寡核苷酸序列[11]。Apt 可以特定的二维或三维构象结合靶标物质,包括茎环、发夹、G-四链体等结构,以此实现目标物质的检测[12]。Apt 的独特优势在于①Apt 对靶标物质的特异性强,亲和力高,Apt 与目标分子间的解离常数一般为10-9~10-12mol/L[13]。②Apt 目标范围广,核酸适配体不仅可与酶、抗体等分子结合,而且也可与金属离子、生物毒素、药物等小分子结合[14]。③Apt 体外可大量并迅速地化学合成,且易被官能团修饰。④Apt 分子质量小,一般由25~100 个碱基组成的单链寡核苷酸片段,同时与靶标物质结合时形成的空间位阻小[4]。⑤Apt 的稳定性与可复性好,可反复变性复性[14]。由此,借助核酸适配体所具有的优势使得其在分析化学、医学领域以及环境监测和食品安全控制方面有广泛的应用[15]。
2 基于核酸适配体生物传感器的FQs 检测方法
近年来基于核酸适配体技术的FQs 检测方法得到快速的发展,主要包括荧光法、比色法、电化学法等。由表1知,大多数研究者选用检测OFL的主要Apt 序列为Reinemann 等[16]筛选的序列,表明所筛选的序列与OFL 的亲和力较强,适用于检测食品中OFL 的残留量。同时,表1也表明检测FQs 目前研究最广泛的是荧光法,并利用此法测定水样中ENR 的含量,检测限可低至0.04 ng/mL。另外,除表1筛选出的能特异性结合FQs 中的特定抗生素的核酸适配体序列外,Mehlhorn 等[9]和Han 等[17]筛选出与DAN 具有高亲和力的RNA适配体序列,即5'-UCAGGCUCCUGUGAAGCAACCGAAUGGACUGAA-3',目前还没有建立相应的检测方法。由此可看出,目前适用于FQs 检测的Apt 序列报道较少,并且基于核酸适配体生物传感器检测FQs 的方法仅局限于比色法、荧光法和电化学法3 大类。另外,基于Apt 识别的FQs 分析方法建立过程中,较多研究者还利用不同的纳米材料修饰Apt,增加其与FQs 结合的稳定性,如上转换纳米颗粒 (Upconversion nanoparticles,UCNPs)[18]、氧化石墨烯(Graphene Oxide,GO)[19]、金纳米粒子(Gold nanoparticles AuNPs)[20-21]、碳纳米管-V2O2壳聚糖纳米复合材料 (Carbon nanotube-V2O2-chitosan nanocomposites,CNT-V2O2-CS)[22]等,以此进一步提高检测的灵敏度和精确度。随着核酸适配体技术的发展,核酸适配体生物传感器的检测方向将定位于高通量和现场实时快速检测。
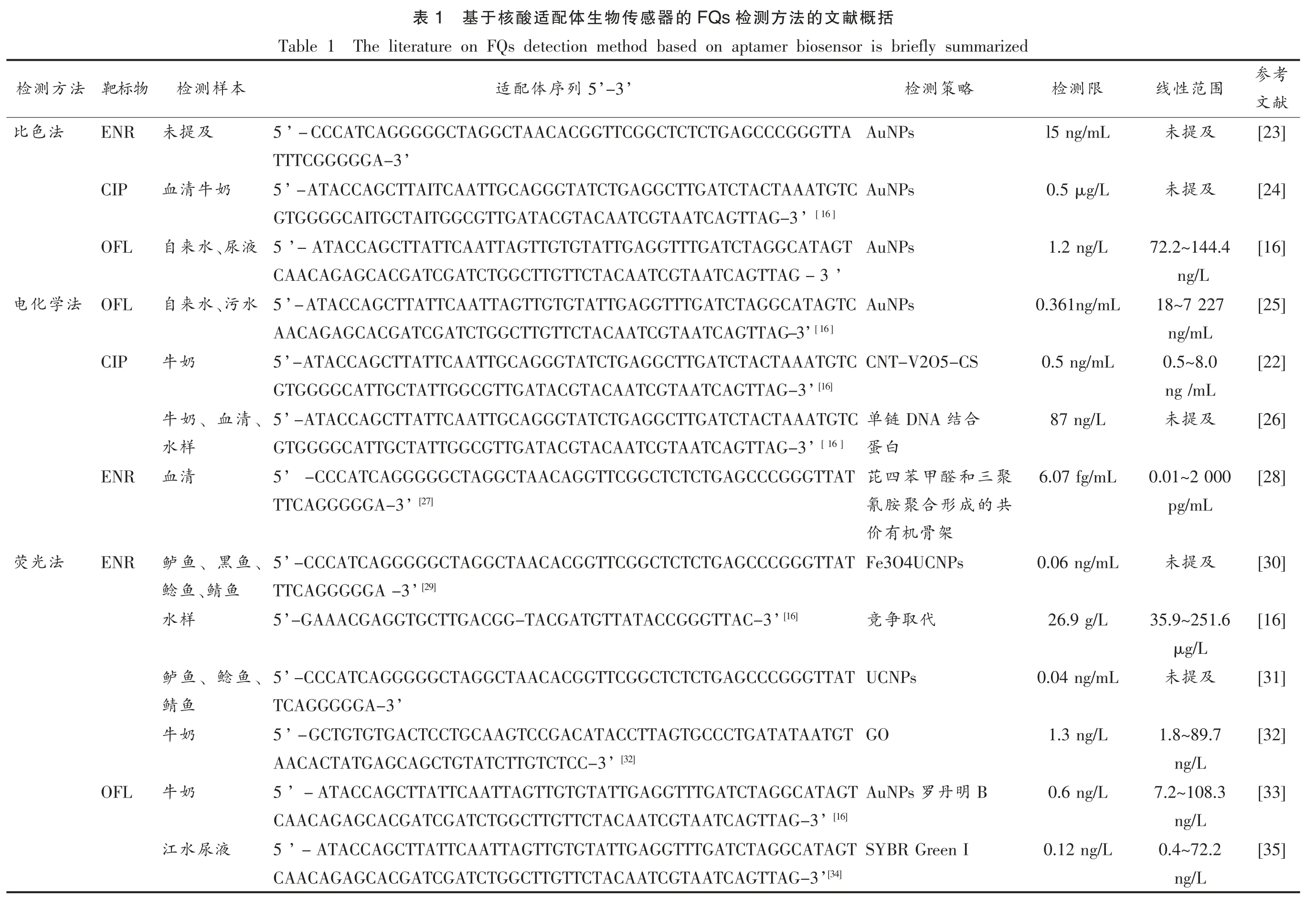
考参献文[23][24][16][25][22][26][28][30][16][31][32][33][35]围范性线及提未及提未72.2~144.4 ng/L 18~7 227 ng/mL 0.5~8.0 ng /mL及提未0.01~2 000 pg/mL及提未35.9~251.6 μg/L及提未1.8~89.7 ng/L 7.2~108.3 ng/L 0.4~72.2 ng/L括概献文的法方测检FQs的器感传物生体配适酸核于基1表The literature on FQs detection method based on aptamer biosensor is briefly summarized Table 1 限测检略策测检’’-3 5列序体配适本样测检l5 ng/mL AuNPs’-CCCATCAGGGGGCTAGGCTAACACGGTTCGGCTCTCTGAGCCCGGGTTA 5及提未’TTTCGGGGGA-3 0.5 μg/L AuNPs’-ATACCAGCTTAITCAATTGCAGGGTATCTGAGGCTTGATCTACTAAATGTC 5奶牛清血[16]’GTGGGGCAITGCTAITGGCGTTGATACGTACAATCGTAATCAGTTAG-3 1.2 ng/L AuNPs’-ATACCAGCTTATTCAATTAGTTGTGTATTGAGGTTTGATCTAGGCATAGT液 5、尿水来自’CAACAGAGCACGATCGATCTGGCTTGTTCTACAATCGTAATCAGTTAG-3 0.361ng/mL AuNPs 水 5’-ATACCAGCTTATTCAATTAGTTGTGTATTGAGGTTTGATCTAGGCATAGTC、污水来自[16]AACAGAGCACGATCGATCTGGCTTGTTCTACAATCGTAATCAGTTAG-3’0.5 ng/mL CNT-V2O5-CS’-ATACCAGCTTATTCAATTGCAGGGTATCTGAGGCTTGATCTACTAAATGTC 5奶牛[16]’GTGGGGCATTGCTATTGGCGTTGATACGTACAATCGTAATCAGTTAG-3 87 ng/L合结DNA链单’-ATACCAGCTTATTCAATTGCAGGGTATCTGAGGCTTGATCTACTAAATGTC 5、清、血奶牛白蛋[ 16 ]’GTGGGGCATTGCTATTGGCGTTGATACGTACAATCGTAATCAGTTAG-3样水6.07 fg/mL聚三和醛甲苯四芘’-CCCATCAGGGGGCTAGGCTAACAGGTTCGGCTCTCTGAGCCCGGGTTAT 5清血共的成形合聚胺氰[27]’TTCAGGGGGA-3架骨机有价0.06 ng/mL Fe3O4UCNPs 5’-CCCATCAGGGGGCTAGGCTAACACGGTTCGGCTCTCTGAGCCCGGGTTAT、鱼、黑鱼鲈[29]’TTCAGGGGGA-3鱼、鲭鱼鲶26.9 g/L代取争竞[16]’’-GAAACGAGGTGCTTGACGG-TACGATGTTATACCGGGTTAC-3 5样水0.04 ng/mL UCNPs’-CCCATCAGGGGGCTAGGCTAACACGGTTCGGCTCTCTGAGCCCGGGTTAT 5、鱼、鲶鱼鲈’TCAGGGGGA-3鱼鲭1.3 ng/L GO’-GCTGTGTGACTCCTGCAAGTCCGACATACCTTAGTGCCCTGATATAATGT 5奶牛[32]’AACACTATGAGCAGCTGTATCTTGTCTCC-3 0.6 ng/L B 明丹AuNPs 罗5’-ATACCAGCTTATTCAATTAGTTGTGTATTGAGGTTTGATCTAGGCATAGT奶牛[16]’CAACAGAGCACGATCGATCTGGCTTGTTCTACAATCGTAATCAGTTAG-3 0.12 ng/L SYBR Green I’-ATACCAGCTTATTCAATTAGTTGTGTATTGAGGTTTGATCTAGGCATAGT 5液尿水江[34]’CAACAGAGCACGATCGATCTGGCTTGTTCTACAATCGTAATCAGTTAG-3靶标物ENR CIP OFL OFL CIP ENR ENR OFL法方测检法色比法学化电法光荧
2.1 荧光法
荧光法检测是基于某些荧光物质在一定的激发波长下能够发射荧光的原理,由检测到的荧光强弱变化来进行定性、定量分析物质含量的一种方法[36]。荧光法具有高灵敏度、低背景值和良好选择性的优势,在生命医学、化学分析、环境监测和食品安全控制等各检测领域方面具有广泛应用[37]。根据目前发表的文献,构建基于核酸适配体生物传感器结合荧光法的检测方法应用广泛。
Liu 等[30]采用UCNs 作为信号源和Apt 作为特定识别元件构建了检测ENR 的荧光生物传感器。其原理如图2所示。首先,将SiO2修饰的氨基化Fe3O4以及氨基化的UCNPs 利用链霉亲和素反应分别修饰Apt 和其互补链(Complementary DNA,cDNA),将修饰完成后的Apt 和cDNA 结合形成具有背景荧光信号的双链结构,作为此传感器的杂交探针 (用UCNPs-cDNA/Apt-Fe3O4表示杂交探针)。当ENR 存在时,ENR 优先与Apt-Fe3O4特异性结合,使UCNPs-cDNA 和Apt-Fe3O4之间的部分双链体结构解离,然后释放杂交探针中的一些UCNPs-cDNA,从而使得荧光强度降低。最后进行磁分离,检测杂交探针表面上未释放的UCNPs的荧光强度,达到快速检测ENR 的目的。此试验的日内和日间回收率为85.1%~98.5%,相对标准偏差2.4%~5.0%和3.0%~4.3%范围,LOD 为0.06 ng/mL,定量限为0.20 ng/mL。此传感器的优势在于使用近红外光触发UCNPs 时,避免了来自样品基质的荧光干扰,实现了高灵敏度检测。同时,引入磁性纳米颗粒简化了分离过程,使检测过程相对快捷。

图2 用UCNPs 信号源构建核酸适配体生物传感器检测ENR 的原理图[30]Fig.2 Using UCNPs signal source to construct aptamer-based biosensors detection[30]
此外,Liu 等[31]通过集成Apt 和分子印迹聚合物(Molecular imprinted polymers,MIPs)两种抗生素识别元件,开发了一种荧光“双识别”传感器,用于检测ENR。此方法原理如图3所示。首先利用二氧化硅修饰UCNPs 并进一步氨基化,再通过生物素-亲和素反应使ENR 的Apt 固定在UCNPs表面。当ENR 存在时,Apt 与ENR 特异性结合,此时完成分子生物亲和识别。另外,引入分子印迹技术中常用的甲基丙烯酸单体,使其与未能结合Apt的ENR 相互作用,进行分子印迹识别。在聚合过程中,需先在UCNPs 表面固定ENR 适配体,后将ENR 与其Apt 特异性结合形成ENR-Apt 复合物,将复合物固定在聚合物基质上。最后洗涤除去ENR 模板,获得“双重识别”印迹腔,其在空间构象和功能上与ENR 互补,当ENR 存在时可与其重新结合。该试验的回收率在87.05%~96.24%之间,相对标准偏差值在1.19%~4.83%范围,LOD 为0.04 ng/mL,定量限为0.12 ng/mL。此研究的创新之处在于将化学修饰的Apt 引入分子印迹聚合物中,构建具有双重识别效应的核酸适配体生物传感器,且开发的传感系统可用于分析不同的鱼样品,回收率良好,可定量检测ENR。

图3 荧光“双识别”传感器检测ENR 的原理图[31]Fig.3 Principle diagram of detection of ENR by fluorescence‘double recognition’ sensor[31]
Zhang 等[38]基于ENR 荧光、Apt 和GO,设计了非荧光标记法测定原料乳中ENR 的残留量。此方法的原理是ENR 自身具有荧光,未加入ENR 的Apt 时,ENR 可以π-π 堆积作用吸附在GO 上,使其荧光淬灭,荧光强度降低。当加入ENR 的Apt时,Apt 可与ENR 结合改变其三维结构,使ENR远离氧化石墨烯表面,荧光恢复,荧光强度增加。此结果表明,ENR 的LOD 为1.3 ng/L,回收率94.1%~108.5%。此方法的优势在于ENR 自身具有荧光,不需标记,减少背景荧光信号,且Apt 与GO相结合,为构建一种快速、灵敏和经济的ENR 检测生物传感器提供了前景。
Yan 等[33]利用非标记OFL 的Apt、AuNPs 和罗丹明B(Rhodamine B,RB)构建检测OFL 的荧光生物传感器,其原理如图4所示。当OFL 不存在时,AuNPs 被OFL 适配体包覆,在高浓度NaCl 溶液中仍保持分散状态,此时,AuNPs 的分散发射能有效降低RB 的荧光强度。OFL 存在时,OFL 与适配体结合形成稳定化合物,使AuNPs 脱离Apt,从而形成聚集状态,此时,聚合的AuNPs 无法猝灭RB 的荧光强度。由此,通过区分荧光强度的大小,就可以定量牛奶和水样品中OFL 的浓度。此试验中检测水样品线性范围为7.2~108.3 ng/L,LOD 为0.6 ng/L;检测牛奶样品线性范围为7.2~108.3 ng/L,LOD 为1.7 ng/L。此方法具有工艺简单、仪器价格低廉、测量时间短等优点。
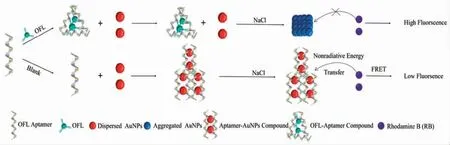
图4 利用AUNPs 和RB 构建核酸生物传感器检测OFL[33]Fig.4 Aptamer-based biosensors construction using AUNPs and RB to detect OFL[33]
此外,Yi 等[35]利用染料SYBR Green I 与Apt构建荧光传感器测定OFL,其原理如图5所示。当OFL 不存在时,SYBR Green I 可嵌入OFL 适配体的G-四链体结构,使SYBR Green I 的荧光强度增强。当OFL 存在时,OFL 与其Apt 特异性结合,破坏序列G-四链体结构,使SYBR Green I释放到溶液中,SYBR Green I 荧光强度减弱。此试验的LOD 为0.12 ng/L,线性范围0.4~72.2 ng/L,在自来水、河水和尿液中的回收率为91.3~119.0%,相对标准偏差小于11.6%。此方法的优势是对类似物、Hormon、杀虫剂等多种干扰有较好的选择性,是一种灵敏度高,选择性好,操作步骤少简单,检测时间短,试剂成本低的测量方法。此方法存在缺陷,在检测实际样品中较低浓度的OFL 时,方法的稳定性和精确度未达到测定要求,因此需提高低浓度OFL 的检测效果,以达到在环境中可以稳定实时精确检测的效果。

图5 利用SYBR Green I 构建核酸生物传感器检测OFL[35]Fig.5 Using SYBR Green I to construct an aptamer-based biosensor to detect OFL[35]
目前,荧光生物传感器较其它传感器研究得较多,目前大多研究ENR 和OFL 的检测,而对FQs 的其它类别研究较少。虽然荧光生物传感器具有高灵敏度、低背景值和良好选择性的优势,但是目标物质低浓度检测和实际样品的检测中仍然存在重现性、精确度和灵敏度都较低的缺陷。需进一步优化荧光生物传感器,使其在食品安全的实时检测中得到高效的运用。
2.2 比色法
纳米金、纳米银等纳米材料的表观颜色在纳米微粒的表面性质发生改变后产生相应的变化,以此为基础通过颜色对比建立起来的方法称为纳米比色法[39]。其中,纳米金比色传感器的原理是基于靶标物质未与Apt 结合时AuNPs 呈分散状态,溶液呈红色,靶标物质与Apt 结合后导致Apt 构象发生变化,使得Apt 不再吸附在AuNPs 表面,在高盐溶液中呈聚集状态,溶液由红色变为蓝色,以此来实现靶标物质含量的检测[40]。另外,AuNPs 对单双链DNA 的吸附状态不同,单链DNA 对AuNPs 具有保护作用,即分散状态的AuNPs 在单链DNA 存在时溶液仍呈红色,而双链DNA 不具有此性质。根据这些性质建立了多种检测FQs 的方法。该方法的响应速度快、操作简便、成本低廉、灵敏度和精密度高,是目前具有实现现场可视化快速检测发展潜力的方法。目前基于核酸适配体技术和比色法结合检测氟喹诺酮类药物残留的方法较少,该类型生物传感器应尽快研究开发。
2017年,Lavee 等[24]基于Apt、改性的具有花状结构的AuNPs 及其表面可催化还原4-硝基苯酚溶液从黄色变为无色,首次开发了一种基于Apt比色法测定CIP 的方法。其原理如图6所示。AuNPs 修饰两条单链DNA,并通过两条单链DNA的部分序列互补连接CIP 的Apt,形成花状的包覆层。未加入CIP 时,AuNPs 上的花状包覆层可以防止其还原4-硝基苯酚,使溶液保持黄色。当加入CIP 时,Apt 与CIP 特异性结合后游离到溶液中,AuNPs 发挥其催化活性,使溶液从黄色变为无色,由此通过颜色的转变来检测目标物质CIP。该方法的LOD 为0.5 μg/L,被成功应用于加标水、血清和牛奶中CIP 含量的检测。该方法优势是可以直接通过肉眼观察到颜色变化而无需采用仪器检测,更有利于实现野外样品的原位和实时检测。
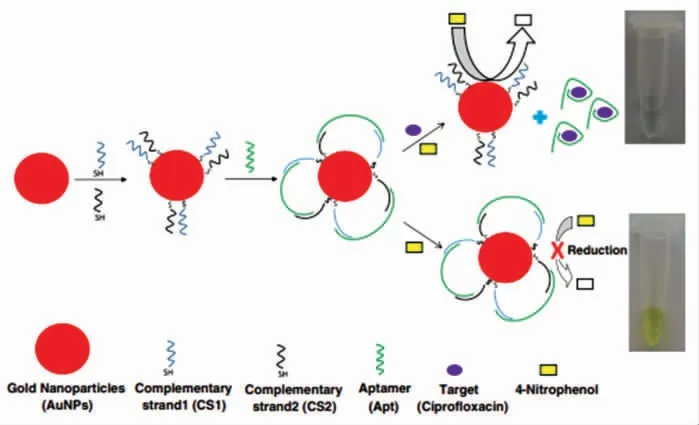
图6 比色传感器用于检测CIP 原理图[24]Fig.6 Schematic diagram of colorimetric sensor for CIP detection[24]
2018年Zhou 等[41]提出了一种基于Apt 和AuNPs 结合的比色法测定水溶液中OFL 的方法。该法原理如图7所示,在没有靶标物质OFL 时,AuNPs 被Apt 包裹,在高NaCl 浓度下保持分散状态而呈红色,于波长520 nm 处有吸收峰。当靶标物质OFL 存在时,OFL 与Apt 特异性结合,使得AuNPs 不与Apt 结合而暴露于盐溶液中,溶液由红色逐渐变为蓝色,在波长650 nm 处有新的吸收峰,由此可根据吸光度的变化来达到检测OFL 的目的。该试验的线性范围为72.2~144.4 ng/L,LOD为1.2 ng/L,具有较高的特异性,操作简便,价格低廉,可通过颜色和吸光度灵敏的变化测定。在水环境中检测环境和生物样品中残留的OFL,该法具有应用潜力,但仍存在局限性,即在土壤环境和固相环境中的应用还有待优化。另外,与实际的复杂组分样品测定相比仍存在一定的差距,有必要开发改进系统,以便对OFL 进行更稳定、更具体和更敏感的检测。
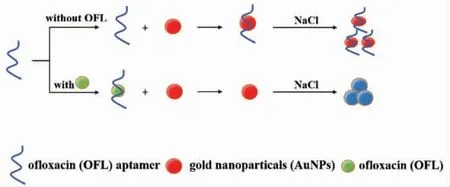
图7 基于AuNPs 建立比色传感器检测OFL[41]Fig.7 Set up colorimetric sensors to detect OFL based on AuNPs[41]
比色生物传感器一般偏向运用AuNPs 比色探针检测FQs,具有较好的响应速度、灵敏度和精密度,是目前最具发展为现场快速检测适用的传感器分析方法潜力。然而,在实际检测复杂组分样品时并未达到实验室检测水平,需进一步优化检测系统,使其能够检测多样环境中的FQs 残留。
2.3 电化学法
电化学法检测目标物具有特异性高、分析速度快及成本合理等优点[42]。该方法的原理是将靶标物质的Apt 修饰到电极表面,当加入靶标物质时,Apt 与其发生特异性结合,使核酸适配体空间构象发生改变,以此通过电流、电压、电阻强弱的变化进行信号的表达。核酸适配体电化学传感器的优势主要源于酶、金属纳米粒子和氧化还原化合物等具有电子转移活性物质可共价标记适配体,无需标记目标物质就可测定。目前该方法的缺陷是如何确保适配体能充分稳定以及完全覆盖电极表面,并保持与未覆盖电极时识别靶标物质的亲和力不降。
Pilehvar 等[25]首次建立了一种基于在AuNPs上固定Apt 的高效、稳定和灵敏测定OFL 的非标记电化学传感器,其原理如图8所示。在OFL 缺失时,单链DNA 适配体修饰的电极产生极低的背景伏安信号,而OFL 存在时,单链DNA 适配体与其结合导致适配体构象发生改变,使OFL 分子靠近电极表面,与传感器表面之间实现高效的电子转移过程。试验结果表明LOD 为1×10-9mol/L。利用固定适配体使该法得到显著优化,能有效代替常见固定目标分子的检测方法,检测限低,操作程序简单,稳定性和选择性高,并能应用于实际环境。

图8 非标记电化学法检测OFL 原理图[25]Fig.8 Schematic diagram of the unmarked electrochemical method for the detection of OFL[25]
Abnous 等[26]基于金电极和单链DNA 结合蛋白 (Single-stranded DNA-binding protein,SSB)的特性构建了检测CIP 的电化学传感器。SSB 的特性包括对单链DNA 的高选择性,大尺寸及其在pH 7.4 时带负电荷。该传感器原理是CIP 不存在时,SSB 可作为单链DNA 与Apt 结合,此时SSB的表面尺寸很大,电极产生空间位阻,并排斥带负电荷的氧化还原探针,使得氧化还原探针对金电极表面的接触较少,产生微弱的电化学信号。CIP存在时,Apt 与其特异性识别形成共轭物,导致Apt 构象发生改变,不能与SSB 结合,此时,位阻和排斥静电力非常低,氧化还原探针进入电极表面并增强电化学信号。试验表明CIP 的LOD 低至87 ng/L。另外,该法已成功用于血清、牛奶和水样品中环丙沙星的测定。
除此之外,Wang 等[28]基于芘四苯甲醛与三聚氰胺聚合形成的共价有机骨架固定适配体,建立了非标记电化学传感器法检测ENR,达到高效、灵敏、稳定检测ENR 的目的,结果表明电化学适配体重复性好,稳定性好,适用于人血清样品。然而,由于共价多孔骨架很难实现有规律的纳米化,因此形成工作电极涂层不均匀,导实际应用中传感性能下降,需进一步改进。
电化学生物传感器中最为广泛研究的是非标记型,因其具有便携性、操作简单、成本低、分析速度快的优点而得到快速发展。然而,电化学生物传感器的组装过程相对较为复杂,且前期的适配体与电极的组装通常耗费大量时间,需开发趋向于集成装置的便携式电化学生物传感器系统,进一步提高检测的高效性和实用性。
2.4 其它方法
除以上几种常见方法外,赵秋伶等[12]基于核酸适配体的酶联分析法研制了ENR 的酶联适配体分析检测试剂盒。如图9所示。该方法的原理是A1 标记生物素并与酶板固定的链霉亲和素相连接,适配体B1 标记了异硫菁酸荧光素(Fluoresceine isothiocyanate,FITC),两者互补杂交被固定到含有链和亲霉素的酶板上,此时加入底物ENR,使得底物与适配体A1 特异性结合,迫使与A1 部分杂交的标记了荧光素的B1 适配体脱离其酶板1。然后,取出B1 加入固定C1 的酶板2。B1、C1 互补杂交形成双链,CI 捕获B1。FITC 能捕获带辣根过氧化物酶(Horseradish Peroxidase,HRP)标签的FITC 抗体。HRP 能催化四甲基联苯胺底物显蓝色,加入酸后蓝色产物转变为黄色。该方法的优势在于试剂盒稳定性良好,抵抗反复冻融至少60 次。在-20 ℃环境中可保存3年以上,在4 ℃环境中可保存6 个月以上。此外,还有快速、方便高效和准确度高等优点。

图9 竞争取代酶联免疫检测ENR 原理[12]Fig.9 Schematic diagram of competitive enzyme-linked immunosorbent assay for ENR[12]
3 结论与展望
核酸适配体易被官能团修饰作为标记或固定,与金属纳米粒子、磁性纳米材料、上转换纳米材料、荧光染料以及量子点等通过π-π 堆积作用或共价结合等方式用于靶标物质的检测[36]。虽然目前核酸适配体相对于抗体具有诸多优势,但是基于核酸适配体检测FQs 的技术还处于探索阶段,存在许多缺陷。主要包括:①核酸适配体的筛选易产生非特异性的片段且筛选过程繁杂、操作复杂;②筛选成功的核酸适配体不能同时大量检测同类型靶标物质,实用性较差;③FQs 核酸适配体序列比较有限,生物识别机理不明确,序列改造缺少科学依据;④相较于抗体所构建的检测体系来说,商业性较差。目前,许多研究者主要集中于研究以下内容:①提高检测效率,引入生化检测信号放大、多靶标共同识别功能的同时,尽量简化操作步骤;②有效优化适配体序列,以提升其稳定性、识别性,易保存,在检测应用时性能稳定;③集成适配体探针的便携式装置设计,以及探针的再生和重复使用性能的改善;④优化检测的重复性、灵敏度和选择性。总之,随着核酸适配体研究的深入,与现代分析技术的融合、创新,基于核酸适配体的检测技术将向简便化、高精度、高灵敏度、高稳定性、高通量、极速实时检测的方向发展。特别是针对基层监测的实际需求,便携式、高通量和廉价检测系统的开发是未来核酸适配体发展的主流趋势。
