基于酪蛋白多极性pH变换的EGCG纳米粒制备及其稳定性研究
2021-09-09左小博孔俊豪杨秀芳彭新玲苏小琴刁春华
左小博,孔俊豪,杨秀芳*,房 升,彭新玲,谭 蓉,苏小琴,刁春华
(1 中华全国供销合作总社杭州茶叶研究院 杭州 310016 2 浙江省茶资源跨界应用技术重点实验室 杭州 310016 3 浙江工商大学食品与生物工程学院 杭州 310018)
茶多酚(Tea polyphenol,TP)因其优异的抗氧化抑菌性能及绿色天然属性,并兼具健康功效等特点而被广泛研究[1-3]。然而,TP 稳定性差,体系相容性不佳等问题限制了其应用[4]。在光照及氧气等因素影响下,TP 易被氧化成邻醌类及联苯酚醌类物质[5]。Song 等[6]研究发现25 ℃下TP 的柠檬酸缓冲液在24 h 后降解率达83%。增强TP 体系稳定性,充分发挥其活性功效是拓展茶多酚应用领域的关键[7]。儿茶素类化合物作为TP 功效得以体现的关键组分,占TP 总量的65%~80%,而表没食子儿茶素没食子酸酯【 (-)-Epi-gallocatechin-3-gallate,EGCG】 又是儿茶素类化合物中的典型代表,占儿茶素总量的50%~80%,是一类最为重要的酯型儿茶素[8]。EGCG 与产品基质的不相容性,使其活性功效大幅降低。研究发现[9],EGCG 可与产品基质中的脂质结合,导致其难以作用于目标微生物。以EGCG 为研究对象,着力突破TP 稳定性差,体系相容性不佳的应用瓶颈,具有研究的可操作性及产业的可应用性[10]。
目前,微胶囊化作为改善EGCG 稳定性和相容性的传统方法已有较多研究,而获得的产品理化性状无法精确控制且在应用稳定性均存不足[11]。借助化学修饰可制备脂溶性良好的茶多酚,然而,因分子改性的安全性、有机溶剂残留等问题而限制了化学改性EGCG 的应用。近年来,微纳米包载技术作为提高EGCG 稳定性的技术手段得到广泛关注。Goncalves 等[12]用麦芽糊精和阿拉伯胶制备装载EGCG 的纳米粒,提高了产品抗氧化活性。Zagury 等[13]制备的EGCG 微纳米体不仅有利于多酚的保护和释放,而且增强了EGCG 在不同pH 值下的稳定性,提高了其生物能效。Shpigelman等[14]通过热诱导法制备乳球蛋白-EGCG 纳米粒,显著抑制了EGCG 降解,持续延长EGCG 抗氧化活性发挥时间。如何进一步提高EGCG 负载率,更好地发挥功效是其高值化应用的关键[15]。
分子自组装是分子间通过氢键、疏水相互作用、范德华力等作用力自发形成有序空间结构聚集体的过程,具有工艺绿色,不使用化学交联剂,操作简便的特点[16]。近年来,分子自组装已成为天然活性成分包封载运及纳米体系构建和应用领域的重要研究课题[17]。分子自组装不仅赋予活性大分子特殊的结构功能(例如良好的稳定性),而且构筑新型纳米结构体体系相容性高,在活性成分的靶向递送和控释缓释应用方面前景广阔[18]。
蛋白质作为生物大分子,因优良的生物相容性、低抗原性等优点在载运多酚方面应用潜力巨大[19]。研究证实,在特定反应条件下植物多酚的多元化酚羟基基团与蛋白三维空间结构相互作用可形成稳态化微纳米聚集体[20]。然而,两者直接形成的微纳米体系粒径分布通常相对离散、装载率较低且易絮凝分层。pH 变换被认为是改善蛋白结构和功能的安全方法,能进一步提高活性成分负载率[21]。Jiang 等[22]研究表明,pH 变换可诱导蛋白质解折叠,使大豆分离蛋白疏水基团内卷,功能特性增强。pH 碱性处理则能使蛋白结构开展,增加其结构稳定性和界面稳定性[23]。酪蛋白(Casein,CS)等富脯氨酸蛋白(Proline-rich-proteins,PRPs)分子具有解聚和自组装特性,能增强酚羟基和苯环结构疏水性,装载后的活性小分子不会完全包封于蛋白分子通道内部空腔[24]。本课题组之前的试验也发现,pH 变换处理能显著改善CS 在亲水体系中的溶解性,有利于活性成分装载率的提高。
基于此,本研究首先通过pH 变换结合超声同步热诱导对CS 改性处理,采用物理诱导的CS为载体封装EGCG,结合涡旋孵育建立自组装模型构建EGCG 纳米粒体系,以提高其体系稳定性,进而促进茶叶酚类的高值化利用和相关产品开发,也为植物多酚产业更好地发展提供理论和数据参考。
1 材料与方法
1.1 材料与仪器
EGCG(纯度98%),中华全国供销合作总社杭州茶叶研究院提供;壳聚糖(Chitosan,CTS),上海阿拉丁生化科技股份有限公司;酪蛋白(CS),甘肃华羚乳品股份有限公司;水系滤膜(0.45 μm),天津市津腾实验设备有限公司;透析袋 (MWCO=12 000~14 000),赛默飞世尔科技公司;其它化学试剂均为国产分析纯级。
Zetasizer Nano ZS90 纳米粒度分布仪,英国马尔文仪器有限公司;UV-2102PC 型分光光度计,尤尼柯(上海)仪器有限公司;XH-C 旋涡混合器,金坛市医疗仪器厂;BT100-2J 精密恒流泵,保定兰格恒流泵有限公司;78HW-1 数显恒温磁力搅拌器,杭州仪表电机有限公司;SHH-SDT 综合药品稳定性试验箱,重庆市永生实验仪器厂;SU8010 型场发射扫描电镜(SEM),日本HITACHI公司;ALPHA 1-2 LD plus 冷冻干燥机,德国Christ 公司;DSC 8000 差示扫描量热仪,美国珀金埃尔默仪器有限公司。
1.2 试验方法
1.2.1 CS-EGCG-CTS 纳米粒制备及工艺优化[25]
1)溶液配制 以蒸馏水作溶剂制备1 mg/mL的EGCG 溶液,溶解后于4 ℃储存待用。取CTS 溶于体积分数1%乙酸水溶液,超声空化处理20 min至澄清透明,室温磁力搅拌1 h 制得1 mg/mL 溶液,4 ℃储存待用。
以0.01 mol/L pH=7.4 的磷酸缓冲盐溶液(Phosphate buffer saline,PBS)作溶剂配制1 mg/mL CS 溶液,用1 mol/L NaOH 调节至pH=12,800 r/min 磁力搅拌1 h,增强其分子内作用力,使其形成稳定的结构和乳化特性,再用1 mol/L HCl 调节pH 值至7,800 r/min 磁力搅拌1 h,增加蛋白韧性,改善蛋白的界面稳定性和亲水性,并于超声条件下(200 Hz,20 min)分散调节pH 值至8.0,4 ℃储存待用[26]。
2)涡旋孵育 用微量恒流泵以10 mL/min 流速将EGCG 溶液滴加处于600 r/min 涡旋状态下的CS 溶液中,将混合溶液于30 ℃、600 r/min 条件下涡旋孵育5 h。所得混合液与另一相(CTS)溶液分别过0.45 μm 滤膜。使用微量恒流泵按一定体积比将CTS 溶液滴加于500 r/min 涡旋状态的CS-TP 溶液体系,室温下以800 r/min 搅拌12 h得CS-EGCG-CTS 纳米体系。
3)考察单个因素的变化 CS 溶液体积比(1∶0,9∶1,7∶1,5∶1,3∶1)、CTS 质量浓度(0,1,3,5,7,9 mg/mL)、EGCG 质量浓度 (1,3,5,7,9 mg/mL)、CS 质量浓度(0,1,3,5,7,9 mg/mL)。结合单因素实验结果,以粒径、Zeta 电位、多分散系数(PDI)等为稳定性考察指标,对比分析得较优的CSEGCG-CTS 纳米体系制备参数,并采用同等方法制备不含CTS 的CS-EGCG 二元纳米粒体系。
1.2.2 不同因素对CS-EGCG-CTS 纳米粒体系稳定性影响[27]
1.2.2.1 pH 值对体系稳定性影响 按较优条件制备的CS-EGCG-CTS 纳米体系等分相同等份,用1 mol/L HCl 将体系pH 分别调节至pH=3,4,5,6,7,8,并保持500 r/min 磁力搅拌15 min,稀释后测定粒径及Zeta 电位。
1.2.2.2 离子浓度对体系稳定性影响 将按较优条件制备的CS-EGCG-CTS 纳米体系,分别用0,20,50,100,200,300 mmol/L NaCl 溶液稀释,测定粒径及Zeta 电位。
1.2.3 CS-EGCG-CTS 体系贮存稳定性 分别将对照EGCG 溶液(质量浓度3 mg/mL)、CS-EGCG、CS-EGCG-CTS 纳米体系置于25 ℃避光密闭条件下贮存,在预定时间点测定样品粒径及电位等性质。
1.2.4 CS-EGCG-CTS 纳米粒冷冻干燥 分别将CS-EGCG-CTS 和CTS-EGCG 纳米溶液体系离心(6 000×g、15 min),过0.45 μm 的微孔滤膜。添加适量保护剂吐温80 后,于0.01 MPa,-50 ℃条件冷冻干燥48 h 至水分含量低于7%,即得不同EGCG纳米粒。
1.2.5 扫描电镜(SEM)微观形貌观察 通过SEM对2 种EGCG 纳米粒及EGCG 空白的微观形貌表征。将样品用导电胶带固定于样品台上,经喷金处理后,装入扫描电镜观察室,在低电压下观察拍照。
1.2.6 包封率、装载率及多酚保留率的测定[28]纳米粒体系用水复溶10 倍,12 000 r/min 离心30 min,根据GB/T 8313-2018 《茶叶中茶多酚和儿茶素类含量的检测方法》 所述方法计算游离EGCG 含量[29],根据下式计算包封率(ER)和装载率(LR)。

1.2.7 粒径、PDI 和Zeta 电位测定 取适量EGCG纳米体系悬浮液,通过纳米粒度分布仪在25 ℃下测定其粒径、PDI 和Zeta 电位,每个样品重复3 次测定。
1.2.8 差示扫描量热(DSC)测定热力学性质 取10 mg EGCG 纳米粒样品于DSC 测量池中,以空DSC 测量池作参比,扫描温度从30 ℃到230 ℃,升温速率10 ℃/min,达到230 ℃后恒温5 min,降温至30 ℃。利用配套分析软件Pyris Software 从热流曲线分析得到热力学参数。
1.2.9 CS-EGCG-CTS 纳米粒体外释放动力学[17]取CS-EGCG-CTS 纳米粒样品600 mg 分散于5 mL 去离子水中,置于透析袋 (MWCO=12 000~14 000),将透析袋置于盛有溶出介质的500 mL烧杯中,在水浴恒温磁力搅拌器中进行释放实验,转速500 r/min,温度为(25±0.5)℃。在特定时间点取 样(0.5,1,2.5,5,11,15,26,35,48,62,74,90 h)按GB/T 8313-2018 《茶叶中茶多酚和儿茶素类含量的检测方法》方法处理后在波长765 nm 处测定溶出介质吸光度(A),并补充相应量的溶出介质[29]。为保证实验的可比性,以TP(多酚含量40%)作测定空白对照,以吸光度(A)对时间绘制释放特性曲线。
1.2.10 统计分析 每组试验平行测定3 次,结果以平均值±标准偏差(±s)表示,P<0.05 表示具有显著性差异。通过Microsoft Office Execl 2007 进行数据统计,采用OriginPro 9.0.0 软件制图。
2 结果与分析
2.1 不同因素对CS-EGCG-CTS 纳米粒体系稳定性的影响
2.1.1 CS 溶液体积比对EGCG 纳米体系稳定性的影响 稳定性表征对于纳米体系性能研究至关重要,而粒径和电位作为影响纳米体系稳定性的重要因素研究广泛。有研究表明,粒径小且分布集中的体系具有较佳稳定性,在贮存过程不易分层,其主要原因可能在于较大粒径微粒的体系因其自身电荷作用及重力沉降而易相互聚集,影响体系稳定性[30]。研究体系粒径、Zeta 电位及PDI 是评判乳液体系稳定性的有效方法,据此可分析蛋白质与多酚等不同成分配比对纳米体系稳定性的影响,制备具有较佳性能的EGCG 纳米粒体系,并具有操作简便,快速灵敏的特点。
CS 溶液体积比对纳米体系粒径和电位影响见表1。体系粒径随着CS 溶液的添加而显著降低(P<0.05),之后趋于稳定,其原因可能在于CS 作为含有高比例脯氨酸残基的蛋白质(Proline-richproteins,PRPs)能够与EGCG 相互结合形成三元复合体,对EGCG 具有装载包封作用,使得粒径先降低后保持基本稳定。Zeta 电位作为表征微纳米混合体系稳定性的重要指标,较高的Zeta 电位使不同微粒间空间排斥力增加,不易相互聚集,从而更有利于增强体系稳定性[31]。体系Zeta 电位随CS溶液体积比变化的变化幅度较小,表明体系稳定性较好。当CTS-EGCG 与CS 比例按5∶1 比例混合后,体系粒径及Zeta 电位均达最小,此时多分散系数(PDI)也达最小(0.368)。

表1 CS 溶液体积比对纳米体系粒径和电位影响Table 1 Effect of volume ratio of CS on the particle size and Zeta potential of nanoemulsion
2.1.2 CS 溶液体积比对EGCG 纳米粒体系包封率及装载率的影响 CS 溶液体积比对EGCG 纳米体系包封率及装载率影响见表2。体系中EGCG包封率及装载率均随CS 溶液体积比的增加而增大。添加CS 后,纳米粒装载率及包封率分别提高3.09 μg/mg 和1.2%。而当CTS-EGCG∶CS 为3∶1时,包封率和装载率均达最大,分别为93.80%和312.53 μg/mg。其原因可能是CS 作为含有高比例脯氨酸残基的蛋白质与多酚具有强亲和力和更高结合率,以及具有开放柔性结构的蛋白质适于多酚成分的包封和保护[32]。

表2 CS 溶液体积比对EGCG 纳米体系包封率及装载率影响Table 2 Effect of volume ratio of CS on the encapsulation rate and loading rate of EGCG nanoparticles
2.1.3 CTS 质量浓度对EGCG 纳米粒体系稳定性的影响 CTS 质量浓度对纳米体系粒径和电位的影响见图1。随着CTS 质量浓度增加,粒径显著性(P<0.05)增加,从84.55 nm 增加至685.07 nm,同时体系Zeta 电位也逐步增大,从36.50 mV 增加至64.60 mV,表明体系稳定性逐渐增强。当CTS 质量浓度大于1 mg/mL 后体系Zeta 电位变化趋于平稳。试验发现,随着CTS 质量浓度增加体系颜色逐渐加深,透光性降低,PDI 呈先增后降趋势。

图1 CTS 质量浓度对纳米体系粒径和电位的影响Fig.1 Effect of CTS mass concentration on the particle size and Zeta potential of nanoemulsion
2.1.4 EGCG 质量浓度对EGCG 纳米粒体系稳定性的影响 EGCG 质量浓度对纳米体系粒径和电位影响见图2。随着EGCG 质量浓度增加,体系粒径呈先降低后升高趋势(P<0.05),从239.30 nm 变化至301.33 nm。有研究指出[33],较低浓度的多酚类物质能与蛋白相互作用形成可溶性复合体,而高浓度的多酚能够导致蛋白聚集沉淀。当EGCG质量浓度为3 mg/mL 时,体系具有最小粒径(156.07 nm)和Zeta 电位(14.93 mV),之后逐步增大。其原因可能在于多酚和蛋白质的静电结合改变了蛋白质分子表面所带电荷的密度,导致蛋白分子之间的吸附聚集[30]。随着EGCG 质量浓度增大包封的纳米粒接近饱和,继续增加EGCG 质量浓度,多余的EGCG 易吸附于纳米粒表面,同时颗粒之间易相互聚集,一定程度增大了微粒平均粒径。
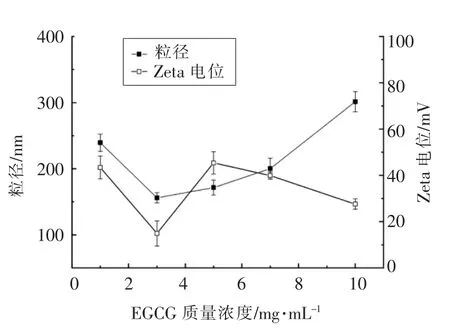
图2 EGCG 质量浓度对纳米体系粒径和电位的影响Fig.2 Effect of EGCG mass concentration on the particle size and Zeta potential of nanoemulsion
黄炜超等[32]研究发现,随着EGCG 质量浓度增大,与酪蛋白酸钠结合的EGCG 分子越多,而EGCG 作为多齿状配基能继续与复合物发生结合形成二聚体或多聚体,使得体系粒径进一步增大,这与本试验的结果一致。
2.1.5 CS 质量浓度对EGCG 纳米粒体系稳定性的影响 CS 质量浓度对纳米体系粒径和电位影响见图3。由图可知,当添加CS 后,体系粒径从792.5 nm 降低到173.4 nm。试验发现,随着CS 质量浓度的增加体系粒径逐步增加,体系颜色也逐渐加深,透光性降低,PDI 逐渐降低,表明体系粒径分布趋于均一。体系Zeta 电位随CS 质量浓度变化较小,表明体系稳定性较强。随着CS 浓度增加,EGCG 与蛋白分子吸附碰撞使得体系粒径逐渐增大。
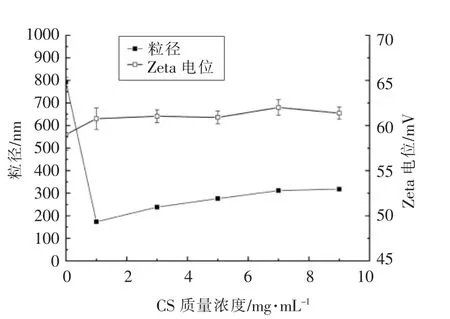
图3 CS 质量浓度对纳米体系粒径和电位的影响Fig.3 Effect of CS mass concentration on the particle size and Zeta potential of nanoemulsion
通过分析各因素对试验的影响,在CTS 质量浓度3 mg/mL,CS 质量浓度1 mg/mL、EGCG 质量浓度3 mg/mL,CTS-EGCG 与CS 按照5∶1 体积比混合条件下制备的EGCG 纳米粒,基本性能已较为稳定,作为较优方案制备的产品平均粒径(173±5)nm,Zeta 电位(60±1.2)mV,样品体系具有较佳稳定性且装载率较高。
2.2 不同因素对EGCG 纳米粒体系稳定性的影响
离子浓度及pH 对EGCG 纳米体系粒径和电位影响见图4。随着离子浓度增大,纳米粒体系粒径先减小后增大,在离子浓度50 mmol/L 时,体系粒径达最小163.23 nm,PDI 为0.22。随着离子浓度增大,体系Zeta 电位逐渐降低,在300 mmol/L时电位达最小(22.63 mV)。不同离子能够在蛋白表层形成静电作用吸附层,而离子浓度对蛋白质的影响具体取决于蛋白表层电荷和性质[34]。侯绍云等[35]研究发现,随着NaCl 浓度增加,纳米粒子粒径逐渐增大,分散呈不均匀状态,粒子表面电荷逐渐减小,这与本文研究结果基本一致。
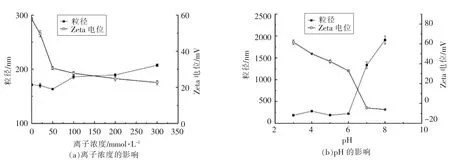
图4 离子浓度及pH 值对EGCG 纳米体系粒径和电位的影响Fig.4 Effect of ion concentration and pH value on the particle size and Zeta potential of EGCG nanoemulsion
随着pH 值增加,纳米粒体系粒径逐步增大,当pH>6 时粒径大幅增加,当pH=8 时体系具有最大粒径1 908.33 nm。酸性条件下,质子化作用使得分子间斥力减弱,使得粒子间吸引力大于斥力,粒径较小。有研究称[33],酸性条件下酪蛋白呈闭合构象,其疏水结构分布于内部,随着pH 值逐步增加,蛋白分子结构内的疏水基团逐渐暴露,从而与活性小分子如多酚等结合使粒径增大。Zeta 电位随pH 增加而降低,在pH 大于6 之后大幅降低,两者呈相反变化趋势。试验发现,随着pH 值增加体系颜色逐渐加深,在pH=8 时体系出现明显沉淀,表明酸性条件下体系稳定性较好,而在碱性条件下稳定性较差。离子表面电荷是维持体系稳定的重要因素,有研究发现,偏碱性条件下多酚类成分羟基易发生质子化,使纳米粒负电荷增多,结合作用增强,在粒子间静电排斥力及自身重力作用下,纳米粒粒径增大[33,36]。
2.3 EGCG 纳米粒体系贮存稳定性分析
由于分子微粒的布朗运动及重力等作用,纳米粒体系在贮存过程中粒径、Zeta 电位及PDI 等指标会产生变化,通常有微粒聚集、絮凝甚至分层等常见失稳现象的发生。贮存过程中EGCG 纳米粒体系Zeta 电位、PDI 和粒径随时间的变化见图5。贮存过程中,EGCG 溶液粒径、Zeta 电位、PDI均随时间呈显著性变化(P<0.05),而制备的CSEGCG-CTS 纳米粒体系稳定性显著提高,Zeta 电位、粒径、PDI 均未呈现明显变化(P>0.05),体系均一性和稳定性显著增强。结果表明,以物理改性CS 结合CTS 对EGCG 稳态化修饰封装载运,能实现EGCG 体系稳定性的显著提高。
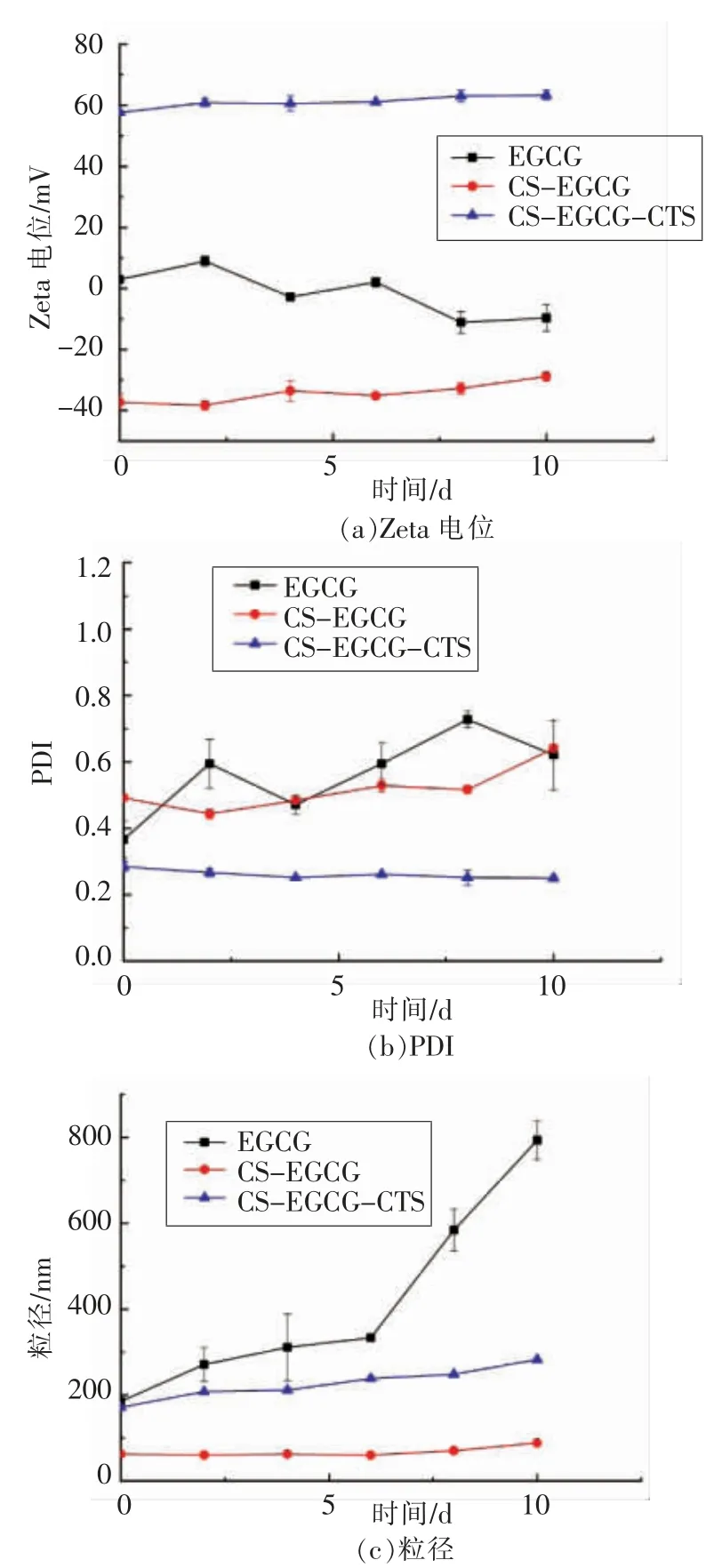
图5 贮存过程中EGCG 纳米粒体系PDI、Zeta 电位和粒径随时间的变化Fig.5 Changes of PDI,Zeta potential and particle size of EGCG nanoemulsion over time during storage
2.4 不同EGCG 纳米粒体系粒径分布随时间变化及SEM 外观形貌比较
不同EGCG 纳米体系粒径分布随时间变化见图6。由图可知,贮存过程中,空白对照EGCG溶液粒径随时间延长呈显著性变化,重现性较差且粒径分布无规律,而经稳态化改性制备的EGCG 纳米粒体系粒径稳定性显著提高(P<0.05),随着时间延长重复性好,表明EGCG 经包封改性后其体系稳定性增强。
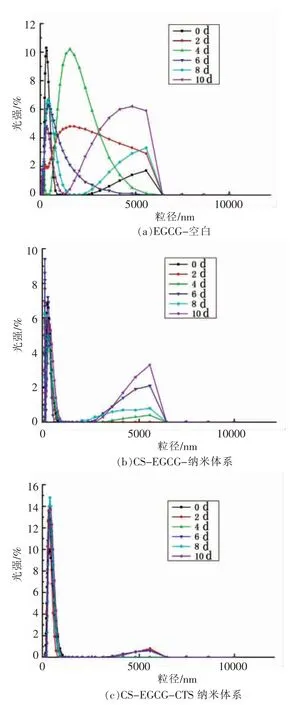
图6 EGCG 纳米粒体系粒径分布随时间变化Fig.6 Changes of particle size distribution of EGCG nanoemulsion with time
不同EGCG 纳米粒体系的SEM 微观形貌见图7。由图可知,SEM 结果显示研究制备的EGCG 纳米粒相比空白EGCG 的微观形貌有显著性改变,呈表面不光滑的相互聚集状态,聚集后粒径基本分布于1~3 μm 之间,微粒表面有凹痕,CS-EGCG-CTS 微粒的粒径趋于均一,结构形态趋同[37]。

图7 不同EGCG 纳米粒的SEM 微观形貌图Fig.7 SEM microscopic morphology of different EGCG nanoparticles
2.5 DSC 热力学性质
EGCG 纳米粒DSC 热流曲线对比分析见图8。由图可知,空白EGCG 在(119±2.0)℃和(215±2.1)℃分别出现2 个强吸热峰,前者可能是由于内部结构的差向异构转变[38],后一个吸热峰对应于EGCG 熔融温度,此时有相变发生[22-23]。对比可知,CS-EGCG-CTS 纳米粒在升温过程中,仅在100~150 ℃间出现放热谷,DSC 热流曲线变化平稳,表明EGCG 经包封改性后热力学稳定性得到增强。

图8 EGCG 纳米粒DSC 热流曲线分析Fig.8 DSC heat flow curve of EGCG nanoparticles
2.6 CS-EGCG-CTS 纳米粒体外释放动力学
缓释特性是衡量纳米化产物稳定性的重要指标,当被包封的活性成分从纳米粒体系中逐渐释放后,能够延长有效成分的作用时间,促进应用功效更好发挥[36]。CS-EGCG-CTS 纳米粒体外缓释性能曲线见图9。由图可知,在11 h 内对照EGCG 的释放量随着时间较快增加,在11 h 后溶出介质中多酚含量趋于稳定,基本保持不变。11 h 的释放量占90 h 释放量的95.9%,表明对照EGCG 在11 h左右大部分内含成分已完成溶出释放。CSEGCG-CTS 表现出了缓慢逐步释放特性,11 h 的释放量占90 h 释放量的45.2%,在48 h 作用内含成分的释放量才趋于稳定,占90 h 释放量的90.2%。分析其原因,可能在于CS-EGCG-CTS 纳米粒中EGCG 被包封于纳米粒内部,内含成分与纳米粒子间存在较强分子间作用力,使其表现出较好缓释特性[39-40]。这表明EGCG 经包封改性后,其体外释放特性得到了改善,有利于应用功效的发挥。

图9 CS-EGCG-CTS 纳米粒体外缓释性能曲线Fig.9 Sustained release character in vitro of CS-EGCG-CTS nanoparticles
3 结论
针对茶叶多酚组分稳定性差等限制其应用的问题,以EGCG 为研究对象,通过多极性pH 变换结合超声同步热诱导对CS 改性以提高其包封载运能力,结合涡旋孵育建立自组装模型构建EGCG 三元纳米粒体系,获得高荷载EGCG 纳米粒体系,平均粒径173 nm,Zeta 电位60 mV,包封率达90%~95%,装载率均高于305 μg/mg。体系中EGCG 包封率及装载率均随CS 溶液占比的增加而增大,即被包封EGCG 增加同时体系均匀性和稳定性也增强。离子浓度50 mmol/L 时,体系粒径达最小163.23 nm,PDI 分散指数达0.22。在酸性条件下纳米粒体系具有较好粒径稳定性。相较于对照,贮存过程中EGCG 纳米粒体系稳定性显著提高,Zeta 电位、粒径、PDI 均未呈现明显变化(P>0.05)。SEM 显示EGCG 经包封后粒径趋于均一,呈球状颗粒,相互聚集后粒径分布于1~3 μm,并具有较好的热力学稳定性。
本研究采用绿色安全的稳态化修饰手段对EGCG 包封和保护,提高了EGCG 的稳定性和分散性,在保证EGCG 纳米粒较高装载率及包封率的同时促进了EGCG 体系相容性和应用缓释特性的增强,避免了化学改性手段所存在的安全风险。与常规微纳米载体技术相比,多酚负载量得到提高,能够作为茶叶酚类化合物及其衍生物包封、保护和递送系统,实现活性功效高效发挥和稳态化应用的潜力,从而为其更好地应用于食品添加剂绿色制备、靶向药物、特殊用途食品、高活性日用洗护产品、环境改良剂开发等领域提供理论和实践基础。
