红茶菌中降解亚硝酸盐乳酸菌的筛选、鉴定及其功能特性
2021-09-09郭志华陈红玲
郭志华,王 聪,陈红玲
(1 宿州学院生物与食品工程学院 安徽宿州 234000 2 宿州学院化学与化工学院 安徽宿州 234000)
红茶菌饮料是以红茶水为原料,经微生物发酵而成的一种功能性饮料[1]。红茶菌中的微生物主要包括醋酸菌、酵母菌和乳酸菌[2]。红茶菌发酵液中含有茶叶的浸出物,活的微生物及其代谢产物,具有抗氧化、抗癌,提高免疫力等保健功能。
乳酸菌是革兰氏阳性菌,可发酵碳水化合物生成乳酸等有机酸,广泛存在于动物肠道、植物表面、发酵乳制品、泡菜、青贮饲料等环境中[3]。乳酸菌不仅有利于食品发酵,而且能够提高食品的营养价值,对人体的生理功能起到较好的调节作用[4]。
为充分了解红茶菌中乳酸菌的功能特性,从红茶菌中分离纯化具有降解亚硝酸盐能力的优良乳酸菌,通过形态观察、生化性质测定和16S rDNA 菌株鉴定,研究其发酵性能、耐胃肠道性和黏附性能等功能,并评价红茶菌中乳酸菌的安全性,为更好地开发红茶菌提供安全优质的乳酸菌株。
1 材料与方法
1.1 材料与试剂
MC 培养基、氨基酸脱羧酶对照培养基和血琼脂平板,广东环凯公司;MRS 肉汤培养基,杭州百思公司;细菌基因组DNA 提取试剂盒,北京天根公司;16S 上、下游引物,上海生工;抗菌药敏纸片,杭州微生物公司;HiBio 生化鉴定试剂盒,Hi-Media 公司。其余均为国产分析纯或化学纯试剂。
1.2 仪器与设备
722 型紫外-可见分光光度计,上海仪电;My-Cycler PCR 扩增仪,美国Bio-Rad;SW-CJ-1D 超净工作台,上海沪净;电热恒温培养箱,上海尚仪。
1.3 方法
1.3.1 降解亚硝酸盐乳酸菌的筛选 蘸取红茶菌汁在MC 平板上划线,37 ℃培养48 h,用灭菌牙签挑取有明显溶钙圈的单菌落接入MRS 液体培养基中培养。接触酶反应阴性,革兰氏染色镜检阳性的菌株初步鉴定为乳酸菌。
将初步鉴定为乳酸菌的菌株活化,按体积分数5%接种于含有125 mg/L NaNO2的MRS 液体培养基,37 ℃培养48 h,菌液离心后取上清液2 mL,加入2 mL 对氨基苯磺酸溶液,避光静置5 min,再加入1 mL 盐酸萘乙二胺溶液,避光静置15 min,观察各菌株培养液的颜色变化,选出颜色较浅的菌株[5]。
1.3.2 筛选乳酸菌的鉴定
1.3.2.1 形态特征观察 筛选出的菌株在MRS 平板划线,观察单菌落颜色、大小、质地、边缘等培养特征;革兰氏染色镜检菌体颜色、菌体性状和排列方式。
1.3.2.2 生化鉴定 采用HiBio 生化鉴定试剂盒,进行七叶苷水解试验、接触酶试验、木糖发酵试验、纤维二糖发酵试验、麦芽糖发酵试验、半乳糖发酵试验、甘露糖发酵试验、蜜二糖发酵试验、棉子糖发酵试验、蔗糖发酵试验、海藻糖发酵试验、阿伯拉糖发酵试验等生化试验,根据颜色变化判断试验是阳性还是阴性。
1.3.2.3 16S rDNA 的扩增和序列分析 提取乳酸菌基因组,用细菌通用引物27f 和1492r 扩增细菌的16S rDNA 的保守序列,PCR 产物测序后与Genbank 数据进行BLAST 核酸数据比对[6]。
1.3.3 筛选乳酸菌功能特性研究
1.3.3.1 发酵特性研究
1)降解亚硝酸盐能力测定 乳酸菌按体积分数5%接种于含有125 mg/L NaNO2的MRS 液体培养基,37 ℃培养,每隔3 h 测定培养液中NaNO2含量,计算培养液中亚硝酸盐降解率。
NO2-降解率(%)=(初始NO2-含量-培养后NO2-含量)/初始NO2-含量%
亚硝酸盐含量的测定采用GB/T 5009.33-2010《食品中亚硝酸盐与硝酸盐的测定》中盐酸萘乙二胺分光光度法[7]。
2)产酸能力测定 按体积分数5%接种于MRS 液体培养基,每3 h 测培养液的pH 值和滴定酸度。
总酸的测定按GB/T 12456-2008 《食品中总酸的测定》进行,总酸含量以乳酸计[8]。
1.3.3.2 耐胃肠道研究 将含有125 mmol/L Na-Cl、7 mmol/L KCl、45 mmol/L NaHCO3的溶液灭菌,溶解胃蛋白酶,过滤除菌,胃蛋白酶终质量浓度为3 g/L,调pH 值到2.5,制得人工胃液[9]。
将含有45 mmol/L NaCl 和3 g/L 的牛胆盐溶液灭菌,溶解胰蛋白酶,过滤除菌,胰蛋白酶终质量浓度为1 g/L,调pH 值到8.0,制得人工肠液[9]。
将乳酸菌按5%接种量接入MRS 液体培养基中,37 ℃培养24 h。低温离心收集菌体,将菌体分别重悬人工胃液和人工肠液3 h 和6 h,收集菌液,根据GB 47892-2010《食品安全国家标准食品微生物学检验菌落总数测定》进行活菌计数,耐受性以存活率计算,公式如下:
存活率(%)=lgN1/lgN0×100
式中,N1——经耐受处理后的活菌数(CFU/mL);N0——耐受处理前的活菌数(CFU/mL)。
1.3.3.3 黏附性能测定
1)表面疏水性测定[10]将乳酸菌活化后接种到MRS 液体培养基中,37 ℃培养24 h,低温离心收集菌体,用无菌PBS(pH 7.0)洗涤菌体两次,重悬于0.1 mol/L KNO3溶液中,在波长600 nm 处调吸光度值为0.6,记为A0。将1 mL 二甲苯、氯仿和乙酸乙酯分别加入3 mL 菌液中,混匀后放置10 min 再混匀,放置20 min,在波长600 nm 处测上层吸光度值,记为At。
通过公式计算乳酸菌黏附有机溶剂的百分比,即乳酸菌的疏水率。
疏水率(%)=(1-At/A0)×100
2)自凝聚测定[11]将乳酸菌37 ℃培养过夜,低温离心收集菌体,用无菌PBS(pH 7.0)洗涤菌体两次,重悬无菌PBS 中,在波长600 nm 处调吸光度值为0.6,记为Ao。取3 mL 菌液振荡混匀10 s,37 ℃静置1,2,3 h 和4 h,取1 mL 上清液,在600 nm 处测吸光度值,记为At。
自动聚集率/%=(1-At/Ao)×100
3)黏附率的测定[12]将乳酸菌37 ℃培养过夜,低温离心收集菌体,用无菌PBS(pH 7.0)洗涤菌体两次,重悬DMEM 培养液中,将Caco-2 细胞置CO2培养箱中37 ℃培养至单层细胞,用胰酶-EDTA 消化液消化后重悬DMEM 培养液中。制备好的细胞悬液置于24 孔培养板中培养至单层细胞。将100 μL 乳酸菌悬液和900 μL DMEM 培养液加入细胞培养孔中,置CO2培养箱中37 ℃培养90 min,用无菌PBS 洗涤细胞两次,除去未黏附的菌体。再加入1 mL Triton100(体积分数为1%),使Caco-2 与黏附菌体分开,培养液根据GB 47892-2010 进行活菌计数,通过公式计算乳酸菌对Caco-2 细胞的黏附率。
黏附率(%)=黏附菌数/每孔中添加菌数×100
1.3.3.4 安全性评价
1)耐药性检测 采用药敏纸片琼脂扩散法将菌液培养至105~106CFU/mL,涂布在MRS 琼脂平板上,将无菌水纸片、青霉素G 纸片、阿莫西林纸片、四环素纸片、万古霉素纸片、氯霉素纸片和红霉素纸片贴于MRS 琼脂平板上,37 ℃培养48 h,观察并测量抑菌圈直径大小[13]。
2)有害代谢物评价 氨基脱羧酶试验:在灭菌后的氨基酸脱羧酶培养基中分别加入质量分数为0.1%的酪氨酸、组氨酸、赖氨酸、鸟氨酸和精氨酸和质量分数为0.005%的5-磷酸吡哆醛,乳酸菌按体积分数5%接入上述液体培养基中,每24 h转接1 次,转接6~8 次后,按10%的量分别接入对应的氨基脱羧酶培养基中,37 ℃培养3~4 d 后观察试验管(加入氨基酸接入乳酸菌)与空白管(不加氨基酸接入乳酸菌)的颜色变化。空白管为黄色,若试验管为黄色,则结果为阴性;若试验管为紫色,则结果为阳性[14]。
硝酸盐还原酶检测试验:乳酸菌活化后,按体积分数5%接入硝酸盐培养基中,37 ℃培养3 d,滴加KI 溶液和淀粉溶液,同时做空白试验。培养液变蓝色为阳性,不变色为阴性[15]。
溶血试验:挑取活化后的乳酸菌在血琼脂平板上划线,37 ℃培养48 h,观察有无溶血圈,同时用金黄色葡萄球菌作为阳性对照比较[15]。
吲哚试验:把乳酸菌按体积分数5%接入蛋白胨水培养基中,37 ℃培养48 h 后加入2 mL 乙醚,充分震荡,待乙醚浮在上层液面,沿管壁加入吲哚试剂,观察两层交界处颜色变化[11]。
所有试验均做3 次平行试验,试验数据采用Origin 8.5 进行数据统计分析,对各组数据进行单因素方差分析,P<0.05 表示数据间存在显著性差异。
2 结果与分析
2.1 优良乳酸菌的筛选
MC 培养基中含有CaCO3,乳酸菌发酵糖产酸使菌落周围CaCO3溶解产生溶钙圈,产酸越强,溶钙圈越大。从红茶菌中共分离出有明显溶钙圈的菌株42 株。红茶菌中含有较多产酸的醋杆菌和酵母菌,镜检革兰氏阳性同时接触酶阴性的有27株,初步鉴定为乳酸菌,编号为HCR-1、HCR-2、HCR-3……。
分离的乳酸菌,按体积分数5%接入含有NaNO2的MRS 液体培养基中,37 ℃培养36 h,NaNO2与对氨基苯磺酸生成重氮盐,重氮盐再与盐酸萘乙二胺进行偶合反应生成紫红色的偶氮化合物[5]。MRS 液体培养基中的NaNO2经乳酸菌降解,降解能力越强,NaNO2含量越低,颜色越浅。不同乳酸菌降解NaNO2能力不同,其中HCR-8、HCR-20 和HCR-24 显色较浅。
2.2 乳酸菌的鉴定
2.2.1 形态特征观察 筛选3 株菌在MRS 固体培养基上的菌落较小,呈白色,圆形,表面光滑湿润。3 株乳酸菌的镜检如图1所示,HCR-8 和HCR-24 革兰氏染色阳性,菌体均为杆状,链状排列;HCR-20 革兰氏染色阳性,菌体短杆状,成对或链状排列。

图1 3 株乳酸菌的镜检图Fig.1 Microscopic examination of three strains of lactic acid bacteria
2.2.2 生化鉴定 采用HiBio 生化鉴定试剂盒检测HCR-8、HCR-20、HCR-24 对碳源的利用能力,结果七叶苷水解试验、纤维二糖发酵试验、麦芽糖发酵试验、甘露糖发酵试验、蜜二糖发酵试验、蔗糖发酵试验和海藻糖发酵试验均为阳性;木糖发酵试验、阿拉伯糖发酵试验、半乳糖发酵试验和棉籽糖发酵试验均为阴性。
2.2.3 16 S rDNA 的扩增和序列分析 以乳酸菌的DNA 为模板,PCR 扩增得到约1.5 kb 片段(图2)。将16S rDNA 的测序结果提交NCBI 进行BLAST 比对分析,结果发现HCR-8 和HCR-24 与植物乳杆菌同源性为97%,HCR-20 与干酪乳杆菌同源性为98%。
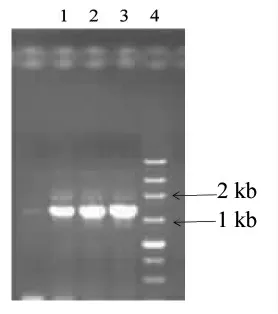
图2 3 株乳酸菌16S rDNA 序列扩增电泳图Fig.2 Electrophoresis pattern of 16S rDNA sequence amplification of three strains of lactic acid bacteria
根据乳酸菌菌落特征、菌体形态特征、糖发酵试验和16S rDNA 的序列分析,HCR-8 和HCR-24 鉴定为植物乳杆菌,HCR-20 鉴定为干酪乳杆菌[16]。
2.3 乳酸菌功能特性
2.3.1 发酵特性
2.3.1.1 产酸能力 从图3可看出HCR-8、HCR-20 和HCR-24 在6~15 h 间pH 值和总酸度含量变化幅度较大,组内差异显著(P<0.05),乳酸菌处于生长对数期,菌体数量不断增加,产酸量不断升高。15 h 后产酸量趋于平缓(P>0.05),可能是菌体生长进入平稳期。其中HCR-20 产酸能力较强,发酵至21 h,pH 值降至3,27 h 时 pH 值降至2.7;HCR-8 其次,发酵至24 h,pH 值降至3;HCR-24发酵至27 h,pH 值降至3.4。乳酸菌在厌氧环境下,利用碳水化合物产生乳酸等有机酸[17],与乳酸菌的抑菌性、降低亚硝酸盐能力等有关[18]。

图3 3 株乳酸菌生长过程中pH 值和酸度的变化Fig.3 Changes of pH value and acidity of three strains of lactic acid bacteria in growth
2.3.1.2 降解亚硝酸盐能力 由图4可看出,3 株乳酸菌随着培养时间的延长,菌株降解亚硝酸盐能力增强。在6~15 h 间,亚硝酸盐降解率上升幅度较大,组内差异显著(P<0.05),第15 小时亚硝酸盐降解率是第6 小时的7~8 倍,这与产酸特性一致。6~15 h 乳酸菌处于对数生长期,菌体数量增幅较大。3 株乳酸菌发酵至24 h,亚硝酸盐降解率均在90%左右;发酵至27 h,亚硝酸盐降解率大于或等于93%,其中HCR-20 亚硝酸盐降解率达99%。乳酸菌降解亚硝酸盐与pH 值呈显著负相关,与总酸度呈正相关[18],当pH 值小于4.0 时,亚硝酸盐的降解主要是酸降解。
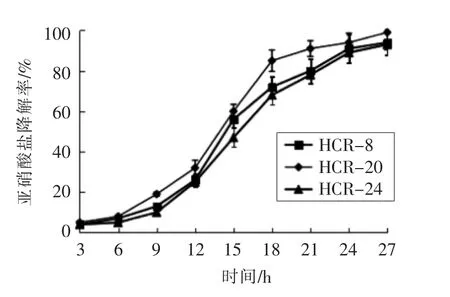
图4 3 株乳酸菌发酵过程中亚硝酸盐降解率的变化Fig.4 Changes of nitrite degradation rate of three strains of lactic acid bacteria in growth
2.3.2 耐胃、肠道环境研究 人们在饮用红茶菌时,一般无需加热直接饮用,乳酸菌进入人体后,只有活菌顺利通过胃抵达小肠,才能对宿主起到益生作用[19],这就要求乳酸菌能够耐受胃、肠道的环境。流体食物在胃内停留时间约2~3 h,人体胃液pH 值通常在3.0 左右,食物经胃液消化后进入小肠,在小肠停留时间约2~6 h,因此本研究选择人工胃液的pH 3.0,消化时间3 h;人工肠液的pH 8.0,消化时间6 h[20]。HCR-8、HCR-20、HCR-24 对人工胃、肠液的耐受性见表1。3 株菌在人工胃液消化3 h 后,存活率分别为 (46.00±0.16)%,(62.00±0.20)%和(39.00±0.11)%,3 株菌有显著性差异(P<0.05),其中HCR-20 的存活率大于60%。3 株菌在人工肠液消化6 h 后存活率均大于50%,3 株菌没有显著性差异(P>0.05)。

表1 3 株乳酸菌耐胃肠道环境研究Table 1 Three strains of lactic acid bacteria resistant to gastrointestinal tract
2.3.3 黏附性能 乳酸菌进入人体后,不仅要耐受胃、肠道环境,还要具有良好的肠道黏附性能,才能最终定殖在肠道发挥其益生特性[21]。本文研究了HCR-8、HCR-20、HCR-24 的表面疏水性、自凝聚性和体外Caco-2 细胞黏附性。
2.3.3.1 表面疏水性 微生物细胞表面疏水性是微生物细胞重要的理化性质之一,主要影响细菌非特异性吸附到生物表面[22]。菌体的表面疏水性能反映其黏附性,疏水性越强,对肠上皮细胞的黏附作用越强[23]。3 株乳酸菌的疏水性见图5。3 株乳酸菌对氯仿的疏水性均高于乙酸乙酯,尤其是HCR-20 对氯仿的疏水性大于80%,组间显著性差异(P<0.05)。氯仿是酸性溶剂,属电子受体,而乙酸乙酯是单碱性溶剂,属电子供体[21],这3 株乳酸菌都是电子供体。二甲苯是一种非极性溶剂,除菌株HCR-24 外,HCR-8 和HCR-20 对二甲苯的疏水性均大于50%,说明这两株菌都有疏水的细胞表面。

图5 3 株乳酸菌在3 种有机溶剂中的表面疏水性Fig.5 Surface hydrophobicity of three strains of lactic acid bacteria in three organic solvents
2.3.3.2 自凝聚 3 株乳酸菌分别在2,4,6 h 的自凝聚率测定结果如图6所示。2 h 时,3 株菌的自凝聚率分别为32%,36%和19%,其中HCR-8和HCR-20 显著高于HCR-24(P<0.05)。随着时间的延长,所有菌株凝聚率逐渐增大,HCR-8 和HCR-20 自凝聚率增速显著高于HCR-24 (P<0.05)。HCR8 和HCR-20 在起始涡旋震荡后沉降较快,4 h 后菌悬液的上层溶液澄清,而HCR-24在6 h 试验结束时上层溶液较浑浊。结合疏水性试验结果,菌株的自聚集性与表面疏水性相一致,即表面疏水性强的菌株也具有较强的自聚集性,这与文献报道一致[21]。
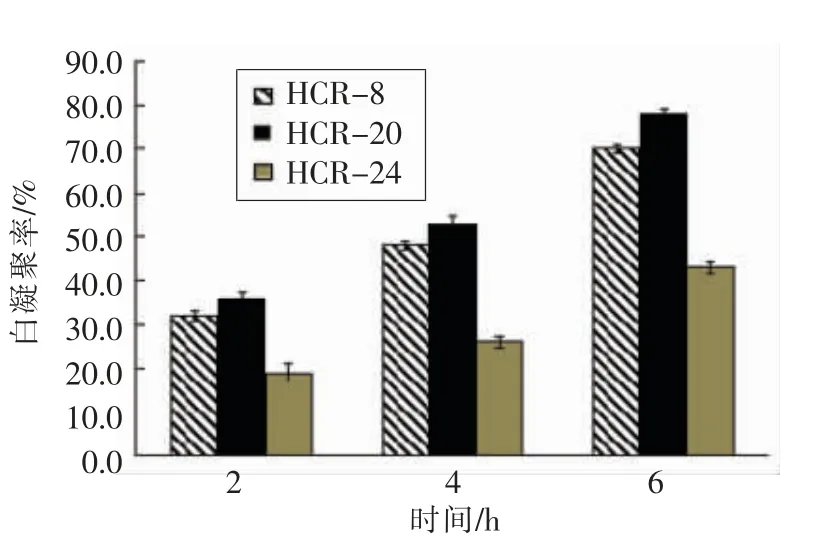
图6 3 株乳酸菌自凝聚性Fig.6 Three strains of lactic acid bacteria self-cohesive
2.3.3.3 黏附率测定 乳酸菌要发挥益生作用,首先要黏附到肠上皮细胞,通过体内试验评价乳酸菌的黏附性能较困难,可以用体外模拟,Caco-2细胞为人体结肠腺癌细胞,无论是形态还是功能都与动物小肠上皮细胞非常接近[23],被广泛用作体外细胞模型来评价乳酸菌的黏附性能。筛选的3 株乳酸菌与Caco-2 细胞共培养90 min 后,除去未黏附的菌体,黏附的乳酸菌根据食品安全国家标准食品微生物学检验(GB 4789-2010)进行活菌计数,乳酸菌对Caco-2 细胞的黏附率见图7。3株乳酸菌的黏附率存在较明显的菌株差异性(P<0.05),其中HCR-20 的黏附率最高17%,HCR-8和HCR-24 的黏附率分别为14%和9%。

图7 3 株乳酸菌对Caco-2 细胞的黏附率Fig.7 Adhesion rate of three strains of lactic acid bacteria to Caco-2 cells
2.3.4 安全性评价结果
2.3.4.1 耐药性 随着抗生素的广泛应用,微生物的耐药性问题日益严重。含有乳酸菌的发酵产品食用前一般不进行加热或消毒等处理,耐药性基因可能通过食物链进入人体肠道并在肠道内积累和传播,对人体健康产生潜在的威胁[25]。选取常用的9 种抗生素,3 株乳酸菌的耐药试验结果见表3。供试3 株乳酸菌对9 种抗生素的敏感性参照美国临床和实验标准协会(CLSI)规定标准划分为敏感(S)、中度敏感(I)和耐药(R)3 个等级[25]。由表2可知,3 株乳酸菌对大部分抗生素均未产生耐药性,只对庆大霉素产生耐药性,而多数乳酸菌对氨基糖苷类抗生素具有天然耐受能力[25]。

表2 3 株乳酸菌耐药性检测结果Table 2 Three strains of lactic acid bacteria resistance test results
2.3.4.2 有害代谢物评价 3 株乳酸菌有害代谢物评价结果见表3。如果乳酸菌具有氨基脱羧酶活性,则可分解氨基酸生成胺和二氧化碳[26]。培养基pH 值升高,显碱性,滴加溴甲酚紫,呈黄色为阴性,说明没有发生脱羧反应;如呈紫色,则说明发生脱羧反应。试验结果显示,这3 株菌均表现出阴性反应,说明它们的代谢产物中均不含有氨基脱羧酶。硝酸盐还原酶可将硝酸盐还原为亚硝酸盐,亚硝酸盐是强致癌物亚硝胺的前体物质[15]。3株乳酸菌硝酸还原酶试验结果显示,所有培养液均未变蓝,为阴性反应,说明3 株菌中不含有硝酸盐还原酶。通过吲哚试验可检测乳酸菌是否产生色氨酸酶,该酶能够分解色氨酸产生吲哚,色氨酸是人体必需氨基酸,色氨酸分解会引起肝功能衰退,恶性肿瘤等疾病[15]。吲哚试验中3 株乳酸菌的培养液均未变色,说明未产生吲哚类物质,试验结果为阴性。很多细菌会产生溶血素,使血液中的红细胞破裂溶解,3 株乳酸菌均没有溶血圈,说明它们对红细胞没有影响。

表3 3 株乳酸菌有害代谢物评价Table 3 Evaluation of harmful metabolites of three strains of lactic acid bacteria
3 讨论与结论
红茶菌中的乳酸菌有的是天然存在的,有的是人为加入的。植物乳杆菌和干酪乳杆菌都属于乳杆菌属,可发酵产酸、细菌素等多种抑菌物质,能够抑制和杀死发酵食品中的腐败菌和致病菌[27]。许多乳杆菌可产生挥发性物质,使发酵食品具有特殊风味。乳杆菌具有很多生理功能,包括耐受胃、肠环境,与人体上皮细胞黏附,增强机体免疫力,降低胆固醇,预防心血管疾病,促进营养物质吸收及维持肠道内菌群平衡等[28]。红茶菌中乳酸菌不仅有助于抑制红茶菌中杂菌和致病菌的生长,还可改善红茶菌的风味与口感,赋予红茶菌更多益生特性。
乳酸菌能发酵碳水化合物产生乳酸等有机酸,抑制有害微生物的生长繁殖,使产品质量得到有效控制。亚硝酸盐对环境和人类均造成严重危害,亚硝酸盐能形成具有强致癌作用的亚硝胺类物质,长期摄入可诱发癌变[29],乳酸菌对亚硝酸盐有很好的降解作用[29]。本研究以产酸和降解亚硝酸盐能力为指标筛选优良乳酸菌。乳酸菌在发酵的前期,培养液pH 值>4.5 时,乳酸菌对亚硝酸盐降解以亚硝酸盐还原酶降解为主;发酵后期,乳酸菌产生酸,培养液pH 值降低,pH 值<4.0 后,亚硝酸盐的降解主要以酸降解为主[29]。其中HCR-20发酵27 h,发酵液pH 值降到2.7,产酸能力优于林龙镇等[30]从酸性风味食品中筛选的戊糖乳杆菌和发酵乳杆菌,且优于常见的保加利亚乳杆菌、嗜热链球菌等[31]。HCR-20 发酵27 h 对亚硝酸盐降解率达99%,高于丁娟芳等[32]从扬州酱菜中筛选的乳酸肠球菌亚硝酸盐降解率为91.7%;程方方等[33]从酸马乳中筛选的肠膜明串珠菌亚硝酸盐降解率88.91%;吴慧昊等[34]从食品和动物肠道中筛选的玉米乳杆菌,亚硝酸盐降解率达到93.47%。
乳酸菌若要发挥改善肠道菌群结构、抑制肠道致病菌等功能则要求其能够克服胃、肠道中的物理及化学因素的影响,以活菌状态到达胃、肠道[9]。HCR-8,HCR-20 和HCR-24 经人工胃液和肠液处理后均有一定的存活率。乳酸菌进入人体后,具有良好的肠道黏附性能,最终定殖于肠道发挥其益生特性。HCR-20 对氯仿的疏水性大于80%,HCR-8 和HCR-20 对二甲苯的疏水性大于50%。3 株乳酸菌的自凝聚性随着时间的延长逐渐增大,HCR-20 对Caco-2 细胞的黏附率达17%。通过对3 株乳酸菌的安全性评价可知:3 株菌对大部分常见的抗生素均无抗性;不会产生氨基脱羧酶和色氨酸酶,不含有硝酸还原酶,不会产生溶血现象。
本试验从红茶菌中筛选的3 株乳酸菌,具有良好的降解亚硝酸盐能力,能耐受胃、肠道环境,不会产生有害代谢产物,为特定功能益生菌的开发利用提供参考依据。
