盐城滨海湿地土壤多环芳烃分布特征及影响因素
2021-09-09蔡杨李伟左雪燕崔丽娟雷茵茹赵欣胜翟夏杰李晶潘旭
蔡杨 ,李伟 *,左雪燕 ,崔丽娟 ,雷茵茹 ,赵欣胜 ,翟夏杰 ,李晶 ,潘旭
1. 中国林业科学研究院湿地研究所,北京 100091;2. 湿地生态功能与恢复北京市重点实验室,北京 100091
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是由两个或两个以上苯环构成的有机化合物,是环境中广泛存在的一类有代表性的半持久性有机污染物(倪妮等,2016;Kannan et al.,2005)。因具有“三致”作用(致癌、致畸、致突变)和远距离运输的特点,已有16种PAHs(表1)被美国环境保护署(US EPA)列为“优先控制污染物”(Jeon et al.,2019),其中7种被国际癌症研究机构(IARC)列为致癌物,苯并(a)芘被列为第一类致癌物(IARC,2010)。
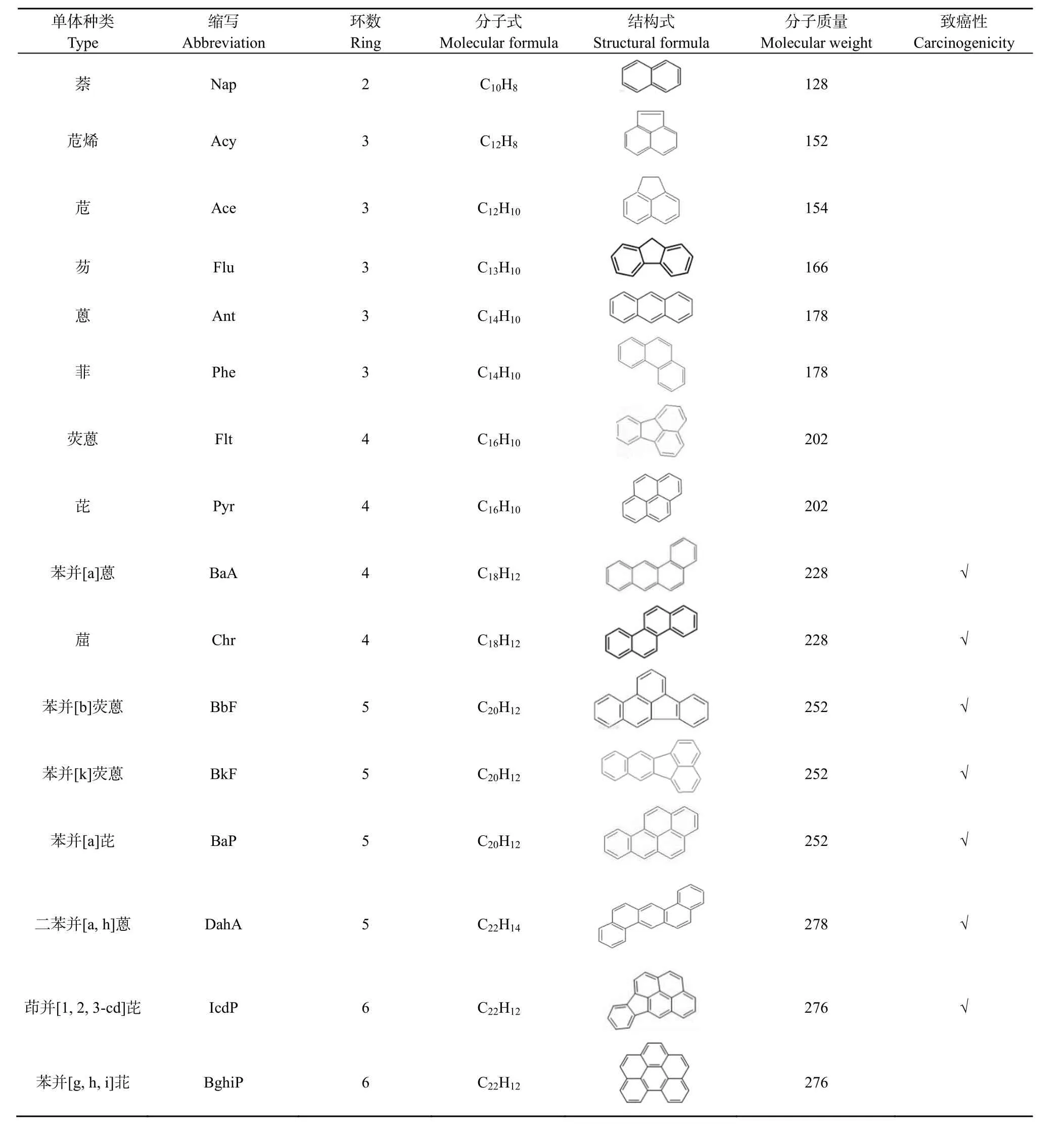
表1 EPA所列16种优先控制PAHsTable 1 16 priority PAHs listed in EPA
湿地中的PAHs可以指示当前的环境条件和生态系统的累积效应,近年来受到广泛关注(Culotta et al.,2006;孙玉川等,2014;Yang et al.,2018)。滨海湿地作为海陆交互的过渡带,是兼具海、陆特征的生态系统类型,生态系统更复杂、水产资源更丰富,是重要的PAHs收纳所,PAHs在其中的迁移转化过程也更复杂(Jafarabadi et al.,2019)。同时,中国滨海湿地开发强度大、人口稠密等现状也使得PAHs的存在对环境和人类的潜在威胁更大(Yang et al.,2015)。滨海湿地中的土壤和沉积物会优先吸附有较强疏水性的PAHs,成为PAHs的暂时性储藏库和二次污染源(Yao et al.,2016)。近年来,国内外针对滨海湿地土壤PAHs的研究主要集中于PAHs的分布特征、来源、风险评价和PAHs在土壤中的迁移转化(Pazi et al.,2019;Zhao et al.,2019),但少有关注生物和非生物综合环境因素与土壤PAHs互相关系的研究。
盐城滨海湿地是亚洲大陆边缘最大的海岸性滩涂湿地,是中国典型滨海滩涂湿地之一,分布着江苏盐城湿地珍禽国家级自然保护区和江苏大丰麋鹿国家级自然保护区,是生物多样性保护的热点区域,被誉为“东方湿地之都”(刘娜,2017)。研究区内分布有众多国家一级保护动物和二级保护动物,联合国教科文组织世界遗产委员会于2019年审议通过,将包括研究区在内的中国黄(渤)海候鸟栖息地(第一期)列入《世界遗产名录》,这对盐城滨海湿地生态环境提出了更高的要求。PAHs易在生物体内富集,并通过食物链生物放大,进而对候鸟生存和生态系统健康产生威胁。
鉴于此,本研究对盐城滨海湿地土壤PAHs展开研究,在分析污染现状的基础上,探究其来源及环境因子对PAHs分布的影响,为进一步防控和修复PAHs污染提供依据,进而为保障我国滨海湿地的生态安全提供科学参考。
1 材料与方法
1.1 研究区概况
盐城地处江苏中部沿海,濒临黄海,海岸线长582 km,是太平洋西岸和亚洲大陆边缘面积最大的海岸型湿地,属于典型滨海湿地。本研究位于江苏大丰麋鹿国家级自然保护区实验区(120.9°E,32.9°N),该地属于亚热带和暖温带的过渡地带,气候类型以季风气候为主,年平均气温介于13.7—14.8 ℃,年平均积温达 4.60×103℃,年降水量为900—1100 mm,湿地类型属于粉砂淤泥质滩涂湿地。研究区内有明显的互花米草(Spartina alterniflora)、盐地碱蓬(Suaeda salsa)、白茅(Imperata cylindrica)和海三稜藨草(Scirpus×mariqueter)植被群落分化,选择植被生长期采集土壤样本,有利于本研究的开展。
1.2 样品采集
2019年8月,在江苏大丰麋鹿国家级自然保护区实验区现有优势植被分布的基础上,选择远离公路和潮沟150 m以上区域设置样点采集土壤样品,其中在互花米草群落采集5个,盐地碱蓬群落采集5个,白茅群落采集5个,海三稜藨草群落采集6个,共计土壤样品 21个。采样点之间的间隔大于200 m。采样时,在每个样点设置1 m×1 m样方并进行群落调查,样方内以五点采样法采集表层(0—20 cm)土壤样品,混匀,填满装实洁净的磨口棕色玻璃瓶。在4 ℃条件下密封、避光运送至实验室。−50 ℃冻干48 h后,等待分析。采样区域见图1,采样点基本概况见表2。
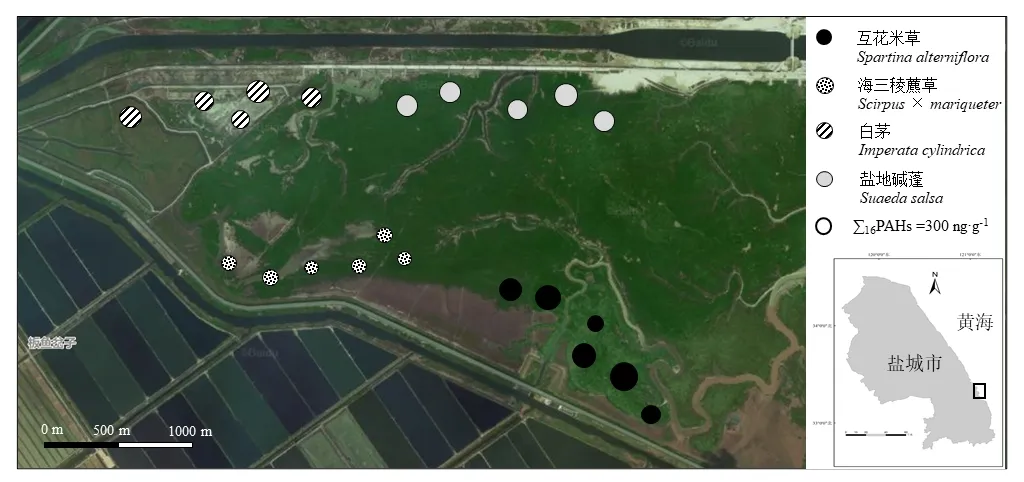
图1 采样区域和土壤中PAHs质量分数分布图Fig. 1 Map of the study area and distribution of PAHs contents in soil
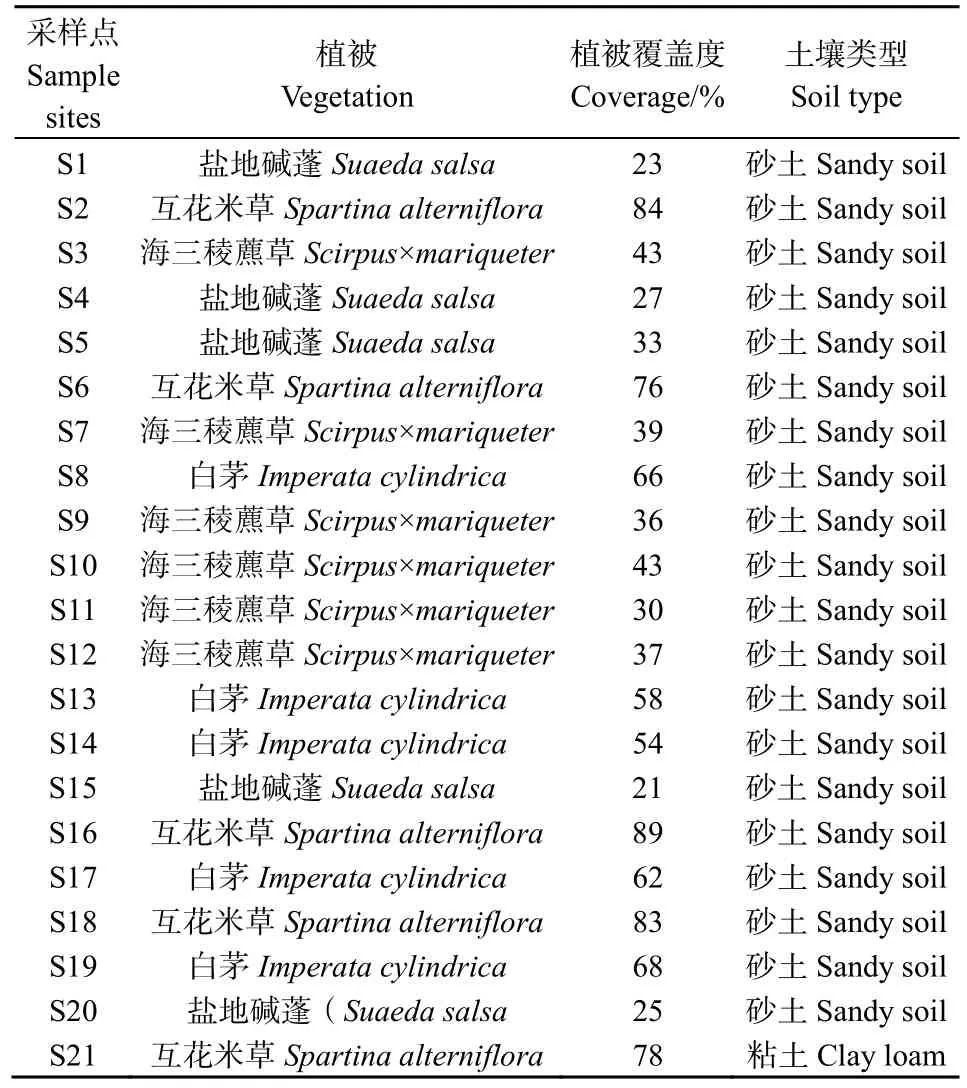
表2 样点植被土壤基本概况Table 2 Basic situation of vegetation and soil in sample sites
1.3 研究方法
1.3.1 土壤PAHs测定方法
土壤样品预处理及分析方法参考《中华人民共和国国家环境保护标准H J805—2016》(环境保护部,2016)。准确称取土壤样品20 g,加入替代物(2-氟联苯和对三联苯-d14)和180 mL丙酮-正己烷混合溶剂(体积比1꞉1)索氏提取16 h,每小时回流5次。待萃取结束后,将萃取液在旋转蒸发仪上浓缩至2 mL,过硅酸镁净化小柱进行净化,将净化后试液置于氮吹仪上再浓缩,加入适量内标液定容至1.0 mL。然后使用型号为Aglient 7890A-5975C的气相色谱-质谱联用仪(GC-MS)测定16种PAHs的质量分数,色谱柱为 HP-5MS石英毛细管色谱柱(30 m×0.25 mm×0.25 μm)。柱温箱升温程序为:70 ℃保持 2 min,以 25 ℃·min−1速率升至150 ℃,再以 3 ℃·min−1速率升至 200 ℃,最后以 8 ℃·min−1速率升至 280 ℃,保持 10 min。载气为氦气,流速为 1 mL·min−1,选择全扫描(Scan)模式进行扫描。
1.3.2 质量控制
整个实验分析过程按方法空白、空白加标、样品平行样进行质量保证和质量控制。每7个样品设置1个平行样和空白样,所有空白样和样品都进行相同处理,空白样品未检出 PAHs,得到样品回收率为78.5%—105%,平均回收率为91.6%,符合美国EPA标准。
1.3.3 土壤含水率测定方法
带盖铝盒于 (105±5) ℃下烘干1 h,稍冷,盖好盖子,然后置于干燥器中冷却后,测定带盖铝盒的质量,精确至0.01 g,记数。用样品勺将30—40 g去除石块、树枝等杂质的新鲜土壤转移至已称重的带盖铝盒中,盖上盖子称质量,精确至0.01 g,记数。取下盖子,将盛有鲜土的铝盒放入烘箱,同时放入铝盒盖,在 (105±5) ℃下烘干至恒质量。盖上铝盒盖,置于干燥器中冷却后,取出后立即测定带盖容器和烘干土壤的总质量,精确至0.01 g,记数。通过差值计算含水率。
1.3.4 土壤pH测定方法
称取过10目(2 mm)筛的风干土10.00 g于50 mL离心管中,加入25 mL煮沸的蒸馏水,180 r·min−1振荡 5 min,3000 r·min−1离心 2 min,用 pH计测定上清液的pH。
1.3.5 土壤有机质测定方法
重铬酸钾氧化-外加热法测定。称0.2000 g过100目(0.149 mm)筛的风干土样,放入硬质试管中,同时做无土样空白,向比色管中加5 mL重铬酸钾溶液和5 mL浓硫酸,摇匀。放入180 ℃恒温油浴锅中,10 min后取出自然冷却。将冷却后的混合物洗入250 mL三角瓶中,加入 4滴邻菲罗啉指示剂,用 0.2 mol·L−1硫酸亚铁铵溶液滴定至红棕色,记录硫酸亚铁铵溶液用量,计算土壤中有机质的质量分数。
1.3.6 土壤粒径测定方法
采用比重计法测定土壤粒径。称取过2 mm筛的风干土样10 g(精确至0.001 g)于105 ℃烘干至恒定质量后计算土壤水分换算系数。另称取过2 mm筛的风干土样50 g(精确至0.01 g),根据土壤pH值加入50 mL氢氧化钠溶液(酸性土壤)、六偏磷酸钠溶液(碱性土壤)或草酸钠溶液(中性土壤),加水至230 mL,置于电热板上加热微沸1 h。将溶液过0.25 mm孔径洗筛洗入1000 mL量筒内,直至洗液澄清,将残留砂粒105 ℃烘干至恒质量。搅拌悬浮液1 min,静置1 min后放入土壤比重计,读数记录为<0.05 mm粒级的含量。静置5 min、8 h后分别读数,记录为<0.02 mm粒级和<0.002 mm粒级的含量,同时记录温度用于校正。运用公式计算各粒级含量(陈丽琼,2010),据此计算样品中砂粒(sand)、粘粒(silt)、粉砂粒(clay)所占的百分比。

式中:
K为水分换算系数;
m0为风干土烘干后的质量,g;
m1为风干土质量。

式中:
C1为0.25—2.0 mm粒级含量;
C2为0.05粒级以下,小于某粒级含量;
m2为0.25—2.0 mm粒级烘干土质量,g;
m3为0.05粒级以下,小于某粒级的土壤比重计校正后读数;
m为风干土质量,g。
1.3.7 数据分析
运用Excel 2019进行数据基本处理。PAHs源解析采用特征比值法和主成分分析法;PAHs单体与环境因子相关性分析采用皮尔逊(Pearson)相关分析法;PAHs总质量分数与环境因子的关系采用偏相关分析;不同植被群落覆盖下土壤中PAHs的差异采用单因素方差分析(One-way ANOVA),P<0.01为极显著差异,P<0.05为显著差异;对砂粒、粘粒、粉砂粒进行主成分分析提取 PC1代表土壤粒径(Soil grain size,SGS),使用R语言和SPSS进行主成分分析和相关性分析,运用Origin 2021绘图。
2 结果与分析
2.1 PAHs质量分数
2019年8月采集的21个土壤样品中,16种PAHs(∑16PAHs)的检出率为 100%,7种致癌性 PAHs(∑7PAHs,分别为BaA、Chr、BbF、BkF、BaP、DahA和IcdP)的检出率为100%,表明在盐城滨海湿地表层土壤中PAHs普遍存在。土壤中∑16PAHs质量分数为 227—884 ng·g−1,平均值为 479 ng·g−1,∑7PAHs质量分数为 79.8—553 ng·g−1,均值为 286 ng·g−1。
从∑16PAHs质量分数来看,各采样点的浓度存在着较大的差异,其中 S2为∑16PAHs质量分数最高点位,而S16的∑7PAHs质量分数最高。根据土壤∑16PAHs污染分类评价系统(Maliszewska-Kordybach,1996),由EPA所列16种优先控制PAHs所引起的污染,其污染水平可分为:未污染(<200 ng·g−1)、轻度污染(200—600 ng·g−1)、中度污染(600—1000 ng·g−1)、重度污染(>1000 ng·g−1)。由此可见,盐城滨海湿地 4个点位(S2、S4、S16和S21)的土壤处于中度污染水平,约占全部点位的1/5;其余17个点位均处于轻度污染水平。
2.2 PAHs分布特征
图2展示了各采样点16种PAHs单体对总质量分数的贡献率。从图中可见,BkF、Pyr、DahA和IcdP 4种组分的平均比例较大,且变化幅度也较大。其中,各采样点BkF的质量分数占总质量分数的平均比例最大,为24.2%,变化范围为6.83%—52.3%。而Nap、Acy、Ace和Flu占总质量分数的平均比例均小于5%。
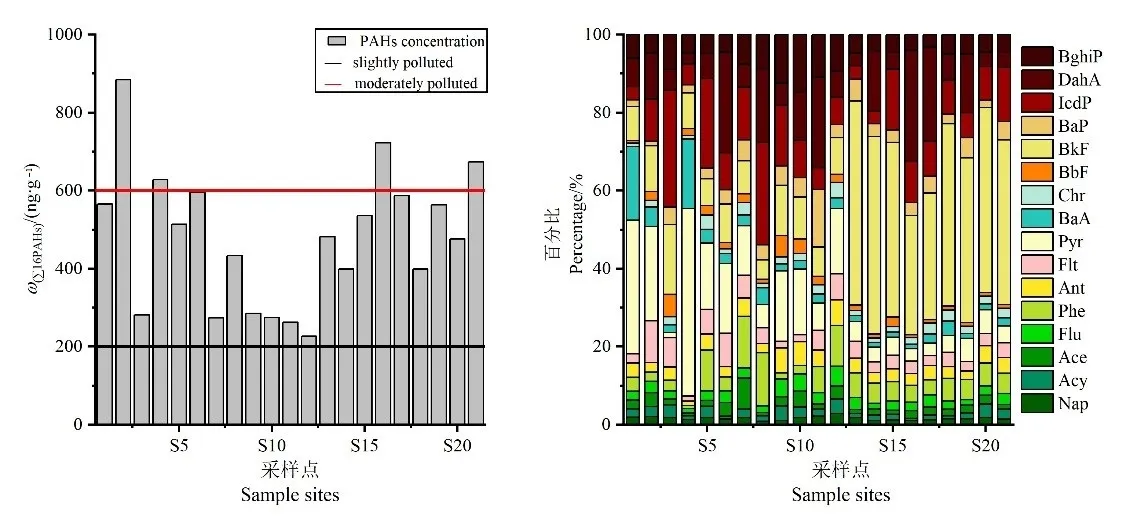
图2 各采样点多环芳烃分布Fig. 2 Distribution of the 16 PAHs at different sampling sites
根据 PAHs单体的环数差异,本文将研究的16种PAHs分为5类:2环、3环、4环、5环和6环。其中2环和3环属于低环,4环、5环和6环属于高环。对采集的21个土壤样品PAHs进行分析,结果显示2环平均占比为1.57%,3环占16.3%,4环占22.7%,5环占41.6%,6环占17.9%。低环PAHs所占比例为 5.98%—32.5%,平均占比为 17.8%,高环PAHs所占比例为67.5%—94.0%,平均占比为82.2%。
由图3可知,不同采样点PAHs的环数组成存在着差异:在所有采样点中,低环比例最高的是S7和S12点位,高环比例最高的是S4点位。总体而言,3环比例最高的有1个点位,4环比例最高的有5个点位,5环比例最高的有13个点位,6环比例最高的有2个点位。

图3 各土壤样品中不同环数PAHs的贡献率Fig. 3 Contribution of different ring numbers of PAHs at different sampling sites
不同植被覆盖下土壤中PAHs质量分数如表3所示。不同植被覆盖下土壤平均PAHs总质量分数大小排序为互花米草>盐地碱蓬>白茅>海三稜藨草,互花米草覆盖下土壤平均PAHs总质量分数最高(655 ng·g−1),海三稜藨草最低(267 ng·g−1)。不同植被类型对土壤中 Nap、Flt、BkF、DahA 及PAHs总质量分数分布存在显著差异。具体而言,Nap在海三稜藨草覆盖土壤中的质量分数显著低于互花米草和盐地碱蓬,但与白茅覆盖下土壤中Nap的质量分数差异不显著;互花米草覆盖土壤中 Flt的质量分数显著高于其他3种植被;互花米草和白茅覆盖土壤中BkF的质量分数差异不显著,但两者都明显高于海三稜藨草;DahA在互花米草覆盖下土壤中的质量分数显著高于海三稜藨草和盐地碱蓬;海三稜藨草、互花米草和白茅覆盖下土壤中PAHs的总质量分数呈现显著差异,但互花米草和盐地碱蓬、白茅和盐地碱蓬覆盖下的土壤中 PAHs的总质量分数差异不显著。
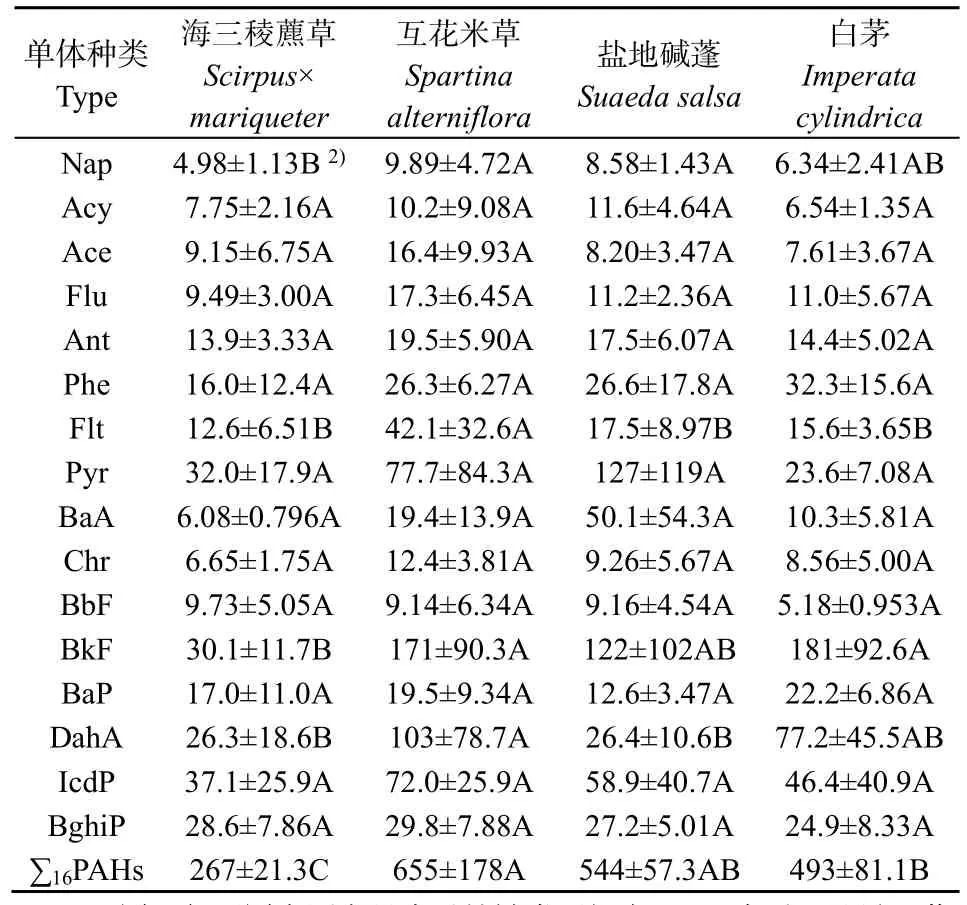
表3 不同植被覆盖下土壤中PAHs质量分数1)Table 3 PAHs concentration in soil under different vegetation cover
2.3 PAHs来源解析
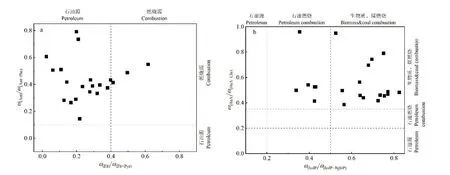
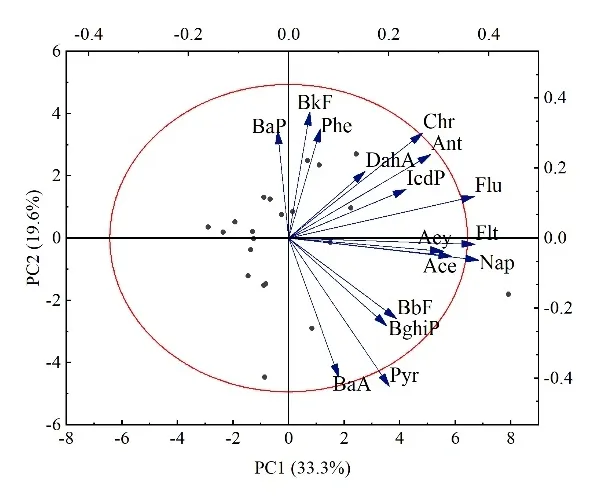
2.3.1 特征比值法
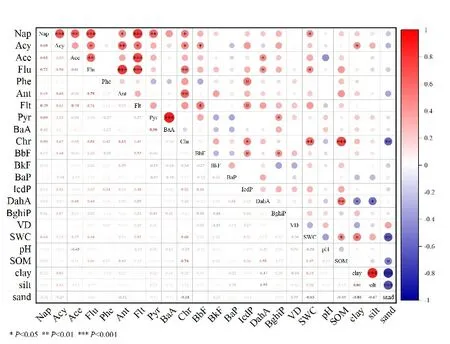
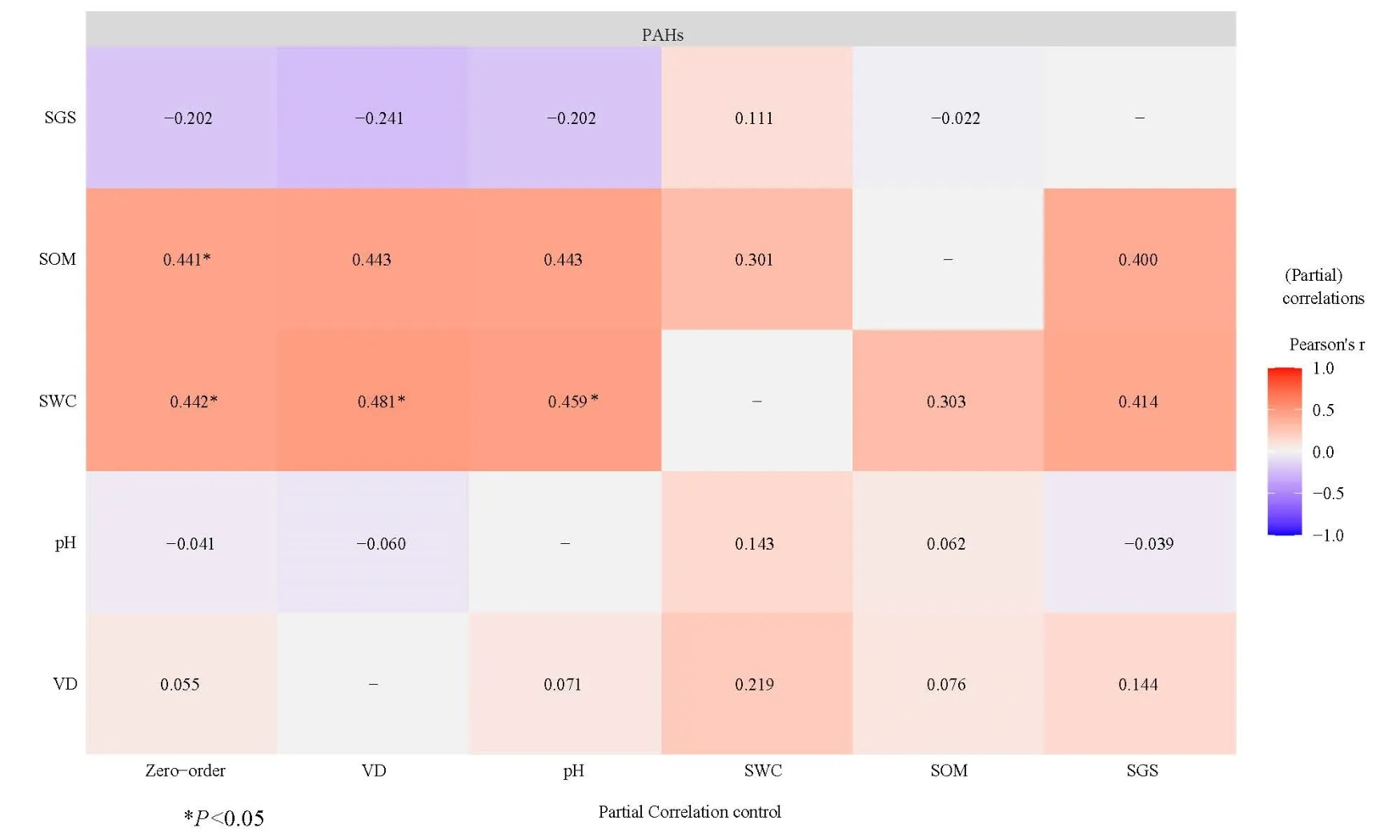
特征比值法作为一种定性的方法,常被用来直观呈现PAHs的来源(Cai et al.,2019)。16种PAHs中存在着5组同分异构体:Ant和Phe(摩尔质量178 g·mol−1),Flt和 Pyr(202 g·mol−1),BaA 和 Chr(228 g·mol−1),BbF、BkF 和 BaP(252 g·mol−1),IcdP和 BghiP(276 g·mol−1)。本文依据 Yunker(2002)对异构体比值判定的结论,选用 Ant/(Ant+Phe)、Flt/(Flt+Pyr)、BaA/(BaA+Chr)和 IcdP/(IcdP+BghiP) 4组比值对土壤中 PAHs进行污染源解析。Ant/(Ant+Phe)>0.1表示燃烧占优势,Ant/(Ant+Phe)<0.1常表示是石油源。Flt/(Flt+Pyr)以0.4为界区分石油源和燃烧源,大多数石油源比值低于 0.4,而比值大于 0.4更具有燃烧源的特征。BaA/(BaA+Chr)和IcdP/(IcdP+BghiP)小于0.2都表示PAHs来源于石油,BaA/(BaA+Chr)>0.35和 IcdP/(IcdP+BghiP)>0.5表明是生物质、煤燃烧产生的 PAHs,0.2 表4 PAHs同分异构体特征比值大小及对应来源Table 4 Isomer ratios and corresponding sources of PAHs 图4为盐城滨海湿地土壤PAHs的特征比值分析结果。由图 4a可见,盐城滨海湿地土壤Ant/(Ant+Phe)集中在大于0.1范围内,推断各样点PAHs的潜在污染源为燃烧源。Flt/(Flt+Pyr)分布于0.1—0.7之间,且仅有3个样点大于0.4,推断石油产品是大部分样点 PAHs的潜在来源。根据Ant/(Ant+Phe)和 Flt/(Flt+Pyr)结果得出的推断有矛盾之处。从图 4b可以看出,所有土壤样品IcdP/(IcdP+BghiP)都大于 0.2,且大部分集中于 0.5—0.85,推断燃烧源是所有样点PAHs的潜在来源,且其中生物质、煤燃烧为主要潜在来源。BaA/(BaA+Chr)集中在大于0.35范围内,推断所有样点PAHs的潜在来源均为生物质、煤燃烧。综合以上分析结果,燃烧源为盐城滨海湿地土壤 PAHs主要潜在来源,石油源也可能是来源之一。 图4 PAHs特征比值图Fig. 4 Ratio of PAHs Characteristics 2.3.2 主成分分析 特征比值法判别来源具有不稳定性,为了更准确地解析盐城滨海湿地PAHs的来源,采用主成分分析法(PCA)分析了各污染源对盐城滨海湿地PAHs的贡献。对研究区土壤16种PAHs单体进行主成分分析,得到因子载荷图(图 5)和主成分分析矩阵表(表5)。从中提取出3个主成分,共解释了方差变量的62.8%。主成分1(PC1)的贡献率为 33.3%,其中Nap、Flt、Flu、Acy、Ace的因子载荷相对较高,因子载荷数分别为 0.381、0.373、0.373、0.327和 0.310。前人研究表明,Nap、Ace为石油及相关产品的主要产物(Simcik et al.,1999);Khalili et al.(1995)的研究表明,Acy主要来源于木柴燃烧;Duval et al.(1981)认为Flu主要来源于煤炭或焦炉燃烧。因此,PC1可以被认为是混合源。主成分2(PC2)的贡献率为19.6%,其中因子载荷相对较高且为正的是BkF、Phe和Chr,因子载荷数分别为0.361、0.312和0.301。Simcik et al.(1999)认为,BkF、Phe和Chr都是煤燃烧的标志产物。因此,可以推断PC2为煤燃烧源。主成分3(PC3)的贡献率为9.93%,其中因子载荷相对较高的是 DahA,因子载荷数为 0.352,Larsen et al.(2003)研究表明,DahA主要来源于汽油和柴油的不完全燃烧过程。因此,PC3可被视为燃烧源。可见,盐城滨海湿地土壤中的 PAHs主要来源于燃烧过程,同时石油源也有很大的可能是来源之一,这与特征比值法得出的结果具有很大的相似性。 图5 多环芳烃各组分比例主成分负荷图Fig. 5 Principal component load chart of PAH component proportion 表5 主成分分析矩阵Table 5 Principal component analysis matrix 实验测得 21个土壤样品理化性质,土壤含水率的变化范围为5.74%—60.4%,土壤pH的变化范围为6.11—8.40,土壤有机质(SOM)质量分数的变化范围为 3.11—80.5 g·kg−1。从土壤类型来看,S1—S20为砂土;S21为粘壤土。将各样点的PAHs浓度与环境因子建立相关关系(图6)。 图6 PAHs与各环境因子相关关系分析Fig. 6 Correlation analysis of PAHs and environmental factors 从图 6可知,SWC、SOM、Clay和植被密度(Vegetation density,VD)都与大多数PAHs存在正相关关系。具体来说,Nap、Flu和Chr与SWC呈显著正相关关系(P<0.05);除Pyr、BaA、BbF、BghiP与SOM呈负相关外,其余PAHs都与SOM呈正相关关系,其中Chr和DahA与SOM呈极显著正相关关系(P<0.01);Acy与Clay呈显著正相关关系(P<0.05),DahA与Clay呈显著负相关关系(P<0.05),Chr与土壤沙粒(Sand)呈极显著负相关关系(P<0.01)。同时本研究发现,多环芳烃单体之间也存在一定的相关关系。 零级相关与偏相关之间的差异表明了VD、pH、SWC、SOM和SGS与PAHs之间的相关性程度(图7)。剔除VD或pH的影响后,SOM与PAHs的正相关(零级相关系数分别为0.441和0.442,P<0.05)显著减弱(偏相关系数均为0.443),土SWC与PAHs的相关性仍显著(P<0.05)。剔除SGS的影响后,SOM和SWC与PAHs的正相关关系显著减弱(相关系数分别为0.400和0.414)。剔除SWC和SOM的任一影响后,另一变量与PAHs的正相关均显著减弱(SOM与PAHs相关关系r=0.301,SWC与PAHs相关关系r=0.303)。 图7 ∑16PAHs与5个变量的偏相关关系Fig. 7 Partial correlations (Pearson's r) between ∑16PAHs and the five variables 盐城滨海湿地具有良好的植被群落分化,选择人为干扰相对较少的保护区进行研究,有利于明晰环境因子与 PAHs分布的关系,为滨海湿地 PAHs的防控提供科学依据。有学者指出,在没有人为干扰的地区,PAHs的质量分数约为100 ng·g−1(Trapido,1999);另有学者认为,植物等因素导致的土壤内源性 PAHs为 1—10 ng·g−1(Edwards, 1983)。而与国内外其余滨海湿地土壤 PAHs质量分数比较发现(表6),本研究区域土壤PAHs质量分数略高于辽河口湿地(235—374 ng·g−1),明显高于爱丁堡湾(0.650—175 ng·g−1),与汕头红树林湿地(79.1—853 ng·g−1)大致处于同一污染水平,但与崇明岛(47.97—1.67×103ng·g−1)和印度申达本红树林湿地(9.4—4.22×103ng·g−1)相比,污染程度较低。目前,盐城滨海湿地的土壤已受到了自然以外的污染,对比国内外其他滨海湿地,本研究区土壤PAHs污染处于中等水平。这与其他学者的研究结论大体一致,如Liu et al.(2018)的研究发现盐城滨海湿地表层沉积物样品中16种优先控制的PAHs质量分数范围为17.1—4.43×103ng·g−1,平均质量分数为 (778±998)ng·g−1。盐城滨海湿地作为中国最大的滩涂型湿地和《世界遗产名录》列入地,生物多样性丰富,PAHs潜在污染风险大,应引起人们重视。 表6 国内外不同研究区域PAHs质量分数比较Table 6 Comparison of PAHs in different research areas at home and abroad 有学者研究表明,高分子量的PAHs有更强的疏水性,更易吸附于有机质上,使得其在环境中能更稳定存在,在土壤和沉积物中累积(Qu et al.,2019),但高分子量的PAHs不易通过水体运送和大气沉降,因此通过沉积直接进入土壤和水体的可能性增加。本研究区土壤PAHs主要为4—5环,而2—3环所占比例较小,2环PAHs比例最小。可能是因为2—3环PAHs在环境中易受光照、微生物等因素的影响,不易稳定存在;而性质相对稳定且较易吸附于有机物上的4—5环PAHs在研究区内占据主导地位。加拿大大西洋地区的表层沉积物中,4环PAHs中的Flt和Pyr质量分数较高(Yang et al.,2018)。哈利法克斯港(Halifax Harbor)表层沉积物也呈现出相似的趋势(Hellou et al.,2002),这与本研究呈现的结果相近。 土壤作为PAHs重要的贮存库,其中PAHs的来源广泛而复杂,主要分为自然源和人为源。自然源包括森林火灾、火山喷发和沉积物成岩等过程,人为源包括汽车尾气排放、石油开采过程中的泄漏以及煤和生物质的燃烧过程(Maliszewska-Kordybach et al.,1998;Nam et al.,2008)。不同的来源过程会产生不同的PAHs,导致土壤中PAHs组成和各单体比例呈现差异。通常情况下,低环PAHs主要来源于石油及其附属产品,而高环PAHs多在不完全燃烧过程中产生,常见于含有热源PAHs的样品中(Abbasi et al.,2019;杨国义等,2007)。 解析PAHs来源的途径和手段很多,特征比值法和主成分分析是其中的两种。特征比值法,就Ant/(Ant+Phe)这组比值而言,通常将0.1作为区分石油源和燃烧源的界限,但也有研究发现,页岩油、柴油等某些原油 Ant/(Ant+Phe)>0.1。Flt/(Flt+Pyr)以0.4为界区分石油源和燃烧源,但燃料和气液相等因素会影响PAHs的组成,因此该界限的确定性较 Ant/(Ant+Phe)更小。总体而言,Ant/(Ant+Phe)和BaA/(BaA+Chr)对不同的燃烧源和石油源敏感性较弱,且易光解。因此,特征比值法确定的污染源可以作为潜在污染源,但不能被确定为准确污染源。结合特征比值法和主成分分析法结果,推断盐城滨海湿地土壤中PAHs主要来源于生物质燃烧和石油燃烧,石油源也是其中的来源之一。 PAHs的来源与其所处地域的经济发展状况和周边污染情况相关。前人的研究表明,生物质燃烧、森林火灾和空气污染沉降是农村地区PAHs污染的主要来源(Zhang et al.,2006)。而在城市地区,工业活动和汽车尾气是城市主要的排放来源(Jenkins et al.,1996)。盐城滨海湿地属于国家级自然保护区,远离城区且附近无工业区,毗邻港口,周边有村庄。因此,解析结果中的燃烧源可能来自于附近农村地区的农业和居住活动。农村地区,木炭和柴火仍作为做饭所用部分燃料,农作物残渣和植物枯落物的露天焚烧近年来虽有改善,但仍普遍。这可能成为土壤中PAHs的来源。附近港口运作时产生的交通源PAHs也可能会污染研究区内的土壤(Davis et al.,2019)。同时,盐城以季风气候为主,研究区恰好处于受季风影响区域,因此空气沉降可能也是该地PAHs的污染来源。 近年来,一些学者关于受PAHs污染土壤的修复研究发现,植被状况和土壤理化性质直接或间接影响修复效果(Samanta et al.,2002;Gan et al.,2009)。然而,各环境因素之间相互影响,其对PAHs分布的贡献率还不明确。一般来说,SOM被广泛认为是影响土壤中 PAHs行为的一个重要变量(Bucheli et al.,2004;Wang et al.,2013;Aichner et al.,2013),会影响PAHs在土壤中的滞留、迁移和转化。在污染严重的区域,土壤PAHs与SOM呈显著正相关关系,当PAHs质量分数较高时,SOM含量也很高;但当PAHs处于较低水平时,两者无显著相关关系(Simpson et al.,1996)。Fernández-Luqueño et al.(2011)的研究从机理上入手,证实SOM含量低不利于保持土壤水分,进而导致土壤致密化,减少PAHs与外界环境的互相作用。SOM具有柔软、柔韧的结构,而由于PAHs具有疏水性,往往被分配到SOM的内基质中(Sun et al.,2005)。本研究探究土壤PAHs与SOM相关关系发现,多数PAHs单体与SOM呈正相关关系,Chr和DahA与SOM呈极显著正相关(P<0.01)。但通过偏相关性分析发现,控制SGS这一因素后,SOM和SWC与PAHs的相关性显著减弱。由此推断,SGS在SOM与SWC和PAHs的关系中起调控作用。 Ma et al.(2010)发现PAHs的去除和降解强烈依赖于根际过程,并可能因植物种类的不同而不同。本研究发现,不同植被群落覆盖下SWC具有显著差异(F=3.54,P=0.037),这与 PAHs总质量分数在不同植被覆盖下呈现的差异具有一致性,说明植被类型可能会影响SWC,进而影响土壤PAHs分布。本研究发现海三稜藨草覆盖下的土壤中∑16PAHs浓度相对其他更低,可能与其植株本身特性、根系分泌物及根际土壤微生物有关(朱鸣鹤等,2010)。本研究只对表层土壤(0—20 cm)进行了研究,在今后的研究中,可同时检测水体、大气和植被中的PAHs,明晰其在盐城滨海湿地中的迁移转化规律。同时,PAHs热点地区(例如,保护区的核心区和保护区周边农田、鱼塘等居民暴露风险较大的区域)的研究尤为重要,需要引起关注。 本研究调查了盐城滨海湿地土壤中PAHs污染现状,并分析了PAHs来源及其与环境因素的关系。结果表明: (1)盐城滨海湿地土壤中的∑16PAHs质量分数范围为 227—884 ng·g−1,均值为 479 ng·g−1,PAHs质量分数在不同点位之间波动较大,整体处于轻度污染和中度污染水平,存在一定的潜在生态风险。 (2)特征比值法和主成分分析法确定了盐城滨海湿地土壤PAHs的主要来源为燃烧源,石油源也是来源之一。 (3)盐城滨海湿地土壤中∑16PAHs与SOM和SWC呈显著正相关关系,该关系受到VD、pH和SGS的影响。

2.4 PAHs分布的影响因素
3 讨论

4 结论
