气相色谱-一测多评法同时测定佛手挥发油中6种成分的含量
2021-09-06罗忻昳李培何兵张春张丹田吉
罗忻昳 李培 何兵 张春 张丹 田吉


中圖分类号 R284.1 文献标志码 A 文章编号 1001-0408(2021)16-1995-07
DOI 10.6039/j.issn.1001-0408.2021.16.13
摘 要 目的:建立同时测定佛手挥发油中α-蒎烯、β-蒎烯、月桂烯、柠檬烯、γ-松油烯、α-松油醇等6种成分含量的方法。方法:采用气相色谱-一测多评法。色谱柱为Agilent DB-17毛细管柱,检测器为火焰离子化检测器,载气为氮气(纯度99.999%),载气流速为0.5 mL/min,氮气(尾吹)流速为25 mL/min,氢气流速为30 mL/min,空气流速为400 mL/min,进样口温度为250 ℃,检测器温度为280 ℃,程序升温,进样量为0.5 μL,分流比为35 ∶ 1。以柠檬烯为内参物,计算α-蒎烯、β-蒎烯、月桂烯、γ-松油烯等4种成分的相对校正因子,再根据相对校正因子计算佛手挥发油中4种成分的含量,并与内标法(以十二烷为内标物,测定6种成分)进行比较。结果:α-蒎烯、β-蒎烯、月桂烯、柠檬烯、γ-松油烯、α-松油醇检测质量浓度的线性范围分别为0.030 5~0.213 8、0.066 6~0.466 0、0.021 8~0.152 3、0.765 2~5.356 4、0.387 3~2.710 8、0.034 2~0.239 6 mg/mL(r均大于0.999);检测限分别为4.82、7.89、4.01、4.54、5.53、2.47 ?g/mL,定量限分别为15.34、25.91、13.69、15.70、18.68、8.36 ?g/mL;精密度、重复性、稳定性(24 h)试验的RSD均小于2%;平均加样回收率分别为96.08%、97.48%、100.90%、101.22%、100.54%、95.84%(RSD均小于3%,n=6)。α-蒎烯、β-蒎烯、月桂烯、γ-松油烯的平均相对校正因子分别为0.997 8、1.530 7、0.952 4、1.025 5(RSD均小于1%)。内标法测得α-蒎烯、β-蒎烯、月桂烯、柠檬烯、γ-松油烯、α-松油醇的含量分别为3.296 9~20.994 1、11.300 6~39.440 9、3.684 2~11.291 4、174.857 8~511.611 8、0~285.127 3、0~48.858 6 mg/g;一测多评法测α-蒎烯、β-蒎烯、月桂烯、γ-松油烯的含量分别为3.296 8~20.994 0、11.300 3~39.439 7、3.684 1~11.291 1、0~285.126 6 mg/g;两种方法测得α-蒎烯等4种成分含量的相对误差均小于1%。结论:所建气相色谱-一测多评法简便、快捷,准确度高,重复性好,可用于佛手挥发油成分的定量分析及质量控制。
关键词 佛手挥发油;气相色谱法;一测多评法;含量测定
Simultaneous Determination of 6 Components in Volatile Oil from Citrus medica by GC-QAMS
LUO Xinyi,LI Pei,HE Bing,ZHANG Chun,ZHANG Dan,TIAN Ji(School of Pharmacy, Southwest Medical University, Sichuan Luzhou 646000, China)
ABSTRACT OBJECTIVE: To establish a method for simultaneous determination of α-pinene, β-pinene, myrcene, limonene, γ-terpinene and α-terpineol in volatile oil from Citrus medica. METHODS: GC-QAMS method was adopted. The determination was performed on Agilent DB-17 capillary column. Flame ionization detector was adopted with nitrogen as carrier gas (purity 99.999%) at the flow rate of 0.5 mL/min. The flow rate of nitrogen (make-up gas) was 25 mL/min, the flow rate of hydrogen was 30 mL/min, and the flow rate of air was 400 mL/min. The inlet temperature was 250 ℃, and the detector temperature was 280 ℃ (programmed temperature), and injection volume was 0.5 μL with split ratio of 35 ∶ 1. Using limonene as internal reference, relative correction factors of α-pinene, β-pinene, myrcene and γ-terpinene were calculated. The contents of 4 components in the samples were calculated according to the relative correction factors. The results were compared between QAMS and internal standard method (ISM, using dodecane as internal substance, 6 components to be determined). RESULTS: The linear range of α-pinene, β-pinene, myrcene, limonene, γ-terpinene and α-terpineol were 0.030 5-0.213 8, 0.066 6-0.466 0, 0.021 8-0.152 3, 0.765 2-5.356 4, 0.387 3- 2.710 8, 0.034 2-0.239 6 mg/mL (all r>0.999). The limits of detection were 4.82, 7.89, 4.01, 4.54, 5.53, 2.47 ?g/mL, and the limits of quantification were 15.34, 25.91, 13.69, 15.70, 18.68, 8.36 ?g/mL, respectively. RSDs of precision, repeatability and stability tests (24 h) were all less than 2%. The average recovery rates were 96.08%, 97.48%, 100.90%, 101.22%, 100.54%, 95.84% (all RSD<3%, n=6). The average relative correction factors of α-pinene, β-pinene, myrcene and γ-terpinene were 0.997 8, 1.530 7, 0.952 4 and 1.025 5 (all RSD<1%). The contents of α-pinene, β-pinene, myrcene, limonene, γ-terpinene and α-terpineol by ISM were 3.296 9-20.994 1, 11.300 6-39.440 9, 3.684 2-11.291 4, 174.857 8-511.611 8, 0-285.127 3, 0-48.858 6 mg/g, respectively. The contents of α-pinene, β-pinene, myrcene and γ-terpinene determined by QAMS were 3.296 8-20.994 0, 11.300 3- 39.439 7, 3.684 1-11.291 1, 0-285.126 6 mg/g, respectively. Relative content errors of 4 components as α-pinene determined by 2 methods were all less than 1%. CONCLUSIONS: The established GC-QAMS method is simple, rapid, accurate and repeatable, and can be used for quantitative analysis and quality control of volatile oil from C. medica.
KEYWORDS Volatile oil from Citrus medica; GC; QAMS; Content determination
佛手为芸香科植物佛手Citrus medica L. var. sarcodactylis Swingle 的干燥果实,收载于2020年版《中国药典》(一部),具有疏肝理气、和胃止痛、燥湿化痰之功[1]。佛手主产于我国广东、四川、浙江等地,根据产地不同被称为广佛手、川佛手和浙佛手等[2],主要含挥发油、黄酮、香豆素和多糖等成分[3]。佛手外皮为黄绿色或橙黄色,有皱纹和油点,气香,是挥发油的主要来源[1]。近年来,关于佛手挥发油药理作用的报道逐渐增多,且研究显示其具有抑菌[4]、止咳平喘祛痰[5]、抗抑郁[6]、抗肿瘤[7-9]等作用,现已被广泛用于香水、化妆品、医药、食品等行業。此外,佛手挥发油还可用于芳香疗法,用于调节患者情绪和改善轻微的应激障碍症状,如焦虑、抑郁、痴呆症的行为障碍和慢性疼痛等[10]。目前关于佛手挥发油的研究主要集中在成分分析方面,有学者采用气质联用技术(GC-MS)分析了不同产地佛手挥发油的成分,结果表明,佛手挥发油中含有萜烯类及其含氧衍生物,其中柠檬烯、α-蒎烯、β-蒎烯、月桂烯、γ-松油烯、α-松油醇等6种成分在佛手挥发油中的含量较高[11-16];有研究指出,柠檬烯是佛手挥发油的主要成分,具有抗炎、抗焦虑、抑制细胞增殖、抗肿瘤等作用[17]。此外,α-蒎烯、β-蒎烯、月桂烯、γ-松油烯、α-松油醇等也具有抗菌、抗肿瘤、抗氧化以及抗哮喘等多种药理作用[18-20]。
2020年版《中国药典》(一部)中佛手“含量测定”项仅规定以高效液相色谱法测定橙皮苷的含量[1]。本课题组前期虽然采用气相色谱法(GC)测定了佛手挥发油中主成分柠檬烯的含量[21],但考虑到挥发油是由多种萜类成分组成的有效部位,故单一成分的含量测定不能完全反映挥发油的整体质量。现代中药质量评价提倡采用多指标质量控制模式,对对照品的种类和数量需求均较大[22],而一测多评法(QAMS)可通过单一对照品而实现对多个成分的同步检测,检测成本大大降低[22],但文献报道的QAMS相关研究以液相色谱法居多[23-24]。基于此,本研究采用气相色谱-一测多评 法(GC-QAMS)测定佛手挥发油中α-蒎烯、β-蒎烯、月桂烯、柠檬烯、γ-松油烯、α-松油醇等成分的含量,旨在为佛手药材及其挥发油的质量控制提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器有Agilent 7890A型GC仪、Agilent 8890型GC仪(美国Agilent公司),岛津GC-2030型GC仪(日本shimadzu公司),XR 205SM-DR型十万分之一电子天平(瑞士Precisa公司)。
1.2 主要药品与试剂
α-蒎烯对照品(批号00016834-424,纯度98.9%)、α-松油醇对照品(批号00020105-FMC,纯度98.0%)均购自美国ChromaDex公司;β-蒎烯对照品(批号131559,纯度99.5%)购自德国Dr. Ehrenstorfer GmbH公司;月桂烯对照品(批号BCBW0611,纯度93.0%)、γ-松油烯对照品(批号STBH9503,纯度98.8%)均购自西格玛奥德里奇(上海)贸易有限公司;柠檬烯对照品(批号100470-201503,纯度96.0%)购自中国食品药品检定研究院;十二烷对照品(内标,批号K1920078,纯度99.7%)购自上海阿拉丁生化科技股份有限公司;乙酸乙酯为分析纯,水为超纯水。
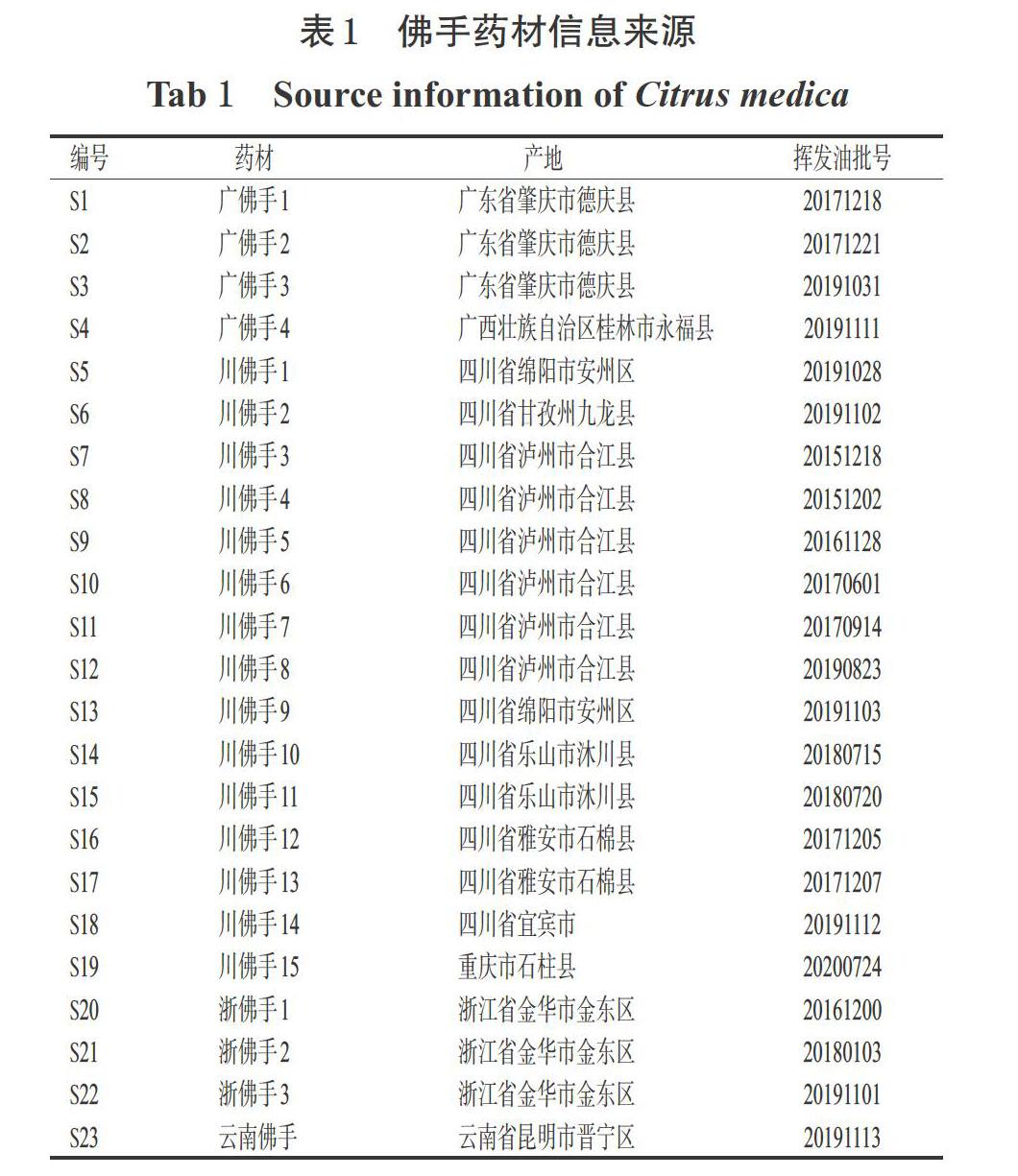
23批佛手药材(编号S1~23)均购自原产地,经西南医科大学药学院张春教授鉴定为佛手芸香科植物佛手C. medica L. var. sarcodactylis Swingle 的干燥果实。采用水蒸气蒸馏提取法制备佛手挥发油(共23批,以无水硫酸钠去除挥发油中的残余水分,得率为0.2%~1.0%)。佛手药材信息来源见表1。
2 方法与结果
2.1 溶液的制备
2.1.1 单一对照品贮备液 精密称取α-蒎烯、β-蒎烯、月桂烯、柠檬烯、γ-松油烯、α-松油醇对照品76.34、83.22、90.68、191.30、203.82、90.06 mg,分别置于10 mL量瓶中,加入乙酸乙酯溶解,制成上述6种成分质量浓度分别为7.634、8.322、9.068、19.130、20.382、9.006 mg/mL的单一对照品贮备液。
2.1.2 内标溶液 精密称取十二烷对照品适量,加入乙酸乙酯溶解,混匀,制成质量浓度为7.327 mg/mL的内标溶液。
2.1.3 混合对照品溶液 分别精密量取“2.1.1”项下6种单一对照品贮备液400、800、240、4 000、1 900、380 μL,置于10 mL量瓶中,加入乙酸乙酯定容,混匀,得各成分质量浓度分别为0.305 4、0.665 8、0.217 6、7.652 0、3.872 6、0.342 2 mg/mL的混合对照品贮备液。精密量取上述贮备液5 mL及“2.1.2”项下内标溶液1 mL,加入乙酸乙酯定容至10 mL,混匀,即得α-蒎烯、β-蒎烯、月桂烯、柠檬烯、γ-松油烯、α-松油醇、十二烷质量浓度分别为0.152 7、0.332 9、0.108 8、3.826 0、1.936 3、0.171 1、0.732 7 mg/mL的混合对照品溶液。
2.1.4 供试品溶液 精密称取佛手挥发油0.1 mL,置于10 mL量瓶中,精密加入“2.1.2”项下内标溶液1 mL,加入乙酸乙酯定容,混匀,即得供试品溶液。
2.2 色谱条件
色谱柱为Agilent DB-17毛细管柱(30 m×0.32 mm,0.25 μm);检测器为火焰离子化检测器;载气为氮气(纯度99.999%),载气流速为0.5 mL/min;氮气(尾吹)流速为25 mL/min,氢气流速为30 mL/min,空气流速为400 mL/min;进样口温度为250 ℃,检测器温度为280 ℃,程序升温(起始温度50 ℃,以5 ℃/min升温至60 ℃,再以2 ℃/min升温至100 ℃,然后以20 ℃/min升温至250 ℃,保留5 min);进样量为0.5 μL,分流比为35 ∶ 1。
2.3 系统适用性试验
分别取“2.1”项下混合对照品溶液、供试品溶液以及空白对照溶液(乙酸乙酯),按“2.2”项下色谱条件进样测定,记录色谱图,详见图1。由图1可知,各待测成分色谱峰与相邻色谱峰的分离度均大于1.5,理论板数按柠檬烯峰计均不低于100 000,空白对照对测定无干扰。
2.4 线性关系考察
分别精密量取“2.1.3”项下混合对照品贮备液0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL,置于2 mL量瓶中,精密加入“2.1.2”项下内标溶液0.2 mL,加入乙酸乙酯定容,混匀,得不同质量浓度的系列线性溶液(表2),按“2.2”项下色谱条件进样,记录峰面积。以各待测成分质量浓度(x,mg/mL)为横坐标、各成分与内标的峰面积比值(y)为纵坐标进行线性回归,结果见表3。
2.5 检测限与定量限考察
取“2.1.3”项下混合对照品溶液,用乙酸乙酯逐级稀释,按“2.2”项下色谱条件进样测定,分别以信噪比3 ∶ 1、10 ∶ 1计算α-蒎烯、β-蒎烯、月桂烯、柠檬烯、γ-松油烯、α-松油醇等6种成分的检测限与定量限。结果,上述6种成分的检测限分别为4.82、7.89、4.01、4.54、5.53、2.47 ?g/mL,定量限分别为15.34、25.91、13.69、15.70、18.68、8.36 ?g/mL。
2.6 精密度试验
精密量取“2.1.3”项下混合对照品溶液,按“2.2”项下色谱条件连续进样测定6次,记录α-蒎烯、β-蒎烯、月桂烯、柠檬烯、γ-松油烯、α-松油醇等6种成分与内标的峰面积比值。结果,上述6种成分与内标峰面积比值的RSD分别为0.37%、0.55%、1.09%、0.13%、0.07%、0.11%(n=6),表明仪器精密度较好。
2.7 重复性试验
取佛手挥发油样品(批号20191028),按“2.1.4”项下方法制备供试品溶液,共6份,再按“2.2”项下色谱条件进样测定,记录α-蒎烯、β-蒎烯、月桂烯、柠檬烯、γ-松油烯、α-松油醇等6种成分与内标的峰面积比值,并按内标法计算样品中上述6种成分的含量。结果,上述6种成分含量的RSD分别为0.71%、1.07%、1.51%、0.72%、0.66%、0.82%(n=6),表明方法重复性良好。
2.8 稳定性试验
取“2.1.4”项下供试品溶液(批号20191028),分别于室温下0、2、4、8、16、24 h时按“2.2”项下色谱条件进样测定,记录α-蒎烯、β-蒎烯、月桂烯、柠檬烯、γ-松油烯、α-松油醇等6种成分与内标的峰面积比值。结果,上述6种成分与内标峰面积比值的RSD分别为0.74%、0.58%、1.02%、0.41%、0.56%、0.23%(n=6),表明佛手挥发油供试品溶液于室温下放置24 h内稳定性良好。
2.9 加样回收率试验
分别精密称取已知含量的佛手挥发油(批号20191028)50 μL(约0.043 g),共6份,置于10 mL量瓶中,分别精密加入“2.1.1”项下α-蒎烯、β-蒎烯、月桂烯、柠檬烯、γ-松油烯、α-松油醇等6种单一对照品贮备液100、190、54、1 040、480、90 μL,精密加入“2.1.2”项下内标溶液1 mL,加入乙酸乙酯定容,按“2.2”项下色谱条件进样测定,记录各待测成分与内标的峰面积比值并计算加样回收率,结果见表4。
2.10 QAMS法的建立
2.10.1 相对校正因子的计算 取“2.4”项下系列线性溶液(质量浓度与表2中各浓度梯度对应),按“2.2”项下色谱条件进样测定,记录峰面积。以柠檬烯为内参物(因柠檬烯为佛手挥发油的主要成分,具有多种药理活性,含量较高且对照品价格便宜,故选择柠檬烯为内参物),计算其余4种成分的相对校正因子(fk/s):fk/s=(Cs×Ak)/(Ck×As)。式中,Cs为内参物质量浓度,As为内参物色谱峰峰面积,Ck为其余成分质量浓度,Ak为对照成分色谱峰峰面积。具体结果见表5(因采用内标法和QAMS法时α-松油醇的结果差异较大,RSD>3%,不适用于 QAMS法测定,故未纳入)。
2.10.2 相对校正因子的耐用性考察 取“2.4”项下系列线性溶液,按“2.2”项下色谱条件分别以不同色谱仪(Agilent 7890A型、Agilent 8890型、岛津GC-2030型GC仪)、不同品牌色谱柱(Agilent DB-17、岛津 InertCap 17、岛津 WondaCap 17,规格均为30 m×0.32 mm,0.25 μm,下同)进样。结果,以Agilent 7890A型、Agilent 8890型GC仪以及不同品牌色谱柱得到的相对校正因子变化均较小,可共用;虽然以岛津GC-2030型GC仪在不同品牌色譜柱上的相对校正因子变化也较小,但与上述两种GC仪比较,所得相对校正因子差异较大,提示同一厂家仪器的相对校正因子耐用性较好;同一色谱仪在不同品牌色谱柱上所得的相对校正因子差异较小,耐用性好,详见表6。此外,由于3种不同品牌色谱柱以Agilent DB-17的分离度、峰形更好,基线更平稳,故选择Agilent DB-17色谱柱进行后续考察。
2.10.3 不同仪器对含量的影响 取佛手挥发油(批号20191028),按“2.1.4”项下方法制备供试品溶液,再按“2.2” 项下色谱条件进样测定,按各自的相对校正因子计算α-蒎烯等4种成分的含量,每样品平行测定3次。结果,内标法和QAMS法以不同仪器所得含量测定结果基本一致,RSD<2%,详见表7。
2.10.4 待测成分色谱峰定位 以柠檬烯峰的保留时间为参照,计算α-蒎烯、β-蒎烯、月桂烯及γ-松油烯峰的相对保留时间,考察不同色谱仪(Agilent 7890A型、Agilent 8890型、岛津GC-2030型GC仪)、色谱柱(Agilent DB-17、岛津 WondaCap 17、岛津 InertCap 17)对相对保留时间的影响。结果,不同型号仪器、不同色谱柱对4种成分相对保留时间的影响均不明显,RSD为0.20%~1.41%,提示可以通过相对保留时间来定位待测成分的色谱峰,详见表8。
2.11 含量测定
分别精密称取23批佛手挥发油各100 μL,按“2.1.4”项下方法制备供试品溶液,再按“2.2”项下色谱条件进样测定,记录峰面积,分别以内标法和QAMS法计算含量,每样品平行测定3次,取平均值,结果见表9。
由表9可知,各批次佛手挥发油中,两种方法所得α-蒎烯、β-蒎烯、月桂烯、γ-松油烯等4种成分含量的相对误差(RE)均小于1%(以每批样品计),表明所得结果无明显差异。
3 讨论
本课题组前期对Agilent DB-5、Agilent DB-17两种不同极性的色谱柱进行了考察,结果发现,当以Agilent DB-5为色谱柱时,佛手挥发油中多数成分的分离效果较好,但柠檬烯峰后面有个小峰(基本包进了柠檬烯峰中),经反复调整色谱条件也不能将之与柠檬烯基线分离。采用Agilent DB-17色谱柱后,柠檬烯与后面的小峰达到基线分离,色谱图中的大部分峰的分离效果较好,但β-蒎烯峰与月桂烯峰保留时间相近,易重合,未达到基线分离,经反复试验,最终通过降低初始温度实现基线分离,得到各成分分离均较好的色谱图,故最终选择Agilent DB-17为色谱柱。载气流速通常选用1 mL/min,但因十二烷峰旁边有小色谱峰,二者未能分开;当将载气流速调为0.5 mL/min后,十二烷峰峰形较好,且与相邻色谱峰基线分离。
外标法简便但要求进样量十分准确,要严格控制在与标准物相同的色谱条件下进行,否则易造成分析误差;内标法测定结果准确,由于内标物与待测成分峰面积的比值不受进样量波动的影响,因而在一定程度上消除了操作条件等变化所引起的误差[25-26],但内标物的选择很重要。本课题组前期在参考文献[27]的基础上,分别选择萘、正十一烷、十二烷为内标物,结果发现,十二烷在GC图谱中的出峰时间与前后相邻峰相差较大,分离度好,且十二烷的保留时间在6种待测成分之间,故选择十二烷为内标物。
由于α-松油醇的相对保留时间在不同色谱柱中相差较大,无法准确定位,且采用QAMS法与内标法计算所得的含量相差亦较大,故未采用QAMS法检测α-松油醇的含量,最终采用QAMS法测定其他4种成分的含量。本研究结果显示,QAMS法和内标法所得α-蒎烯、β-蒎烯、月桂烯、γ-松油烯等4种成分含量的RE均小于1%,两种方法比较无明显差异。
综上所述,所建GC-QAMS法简便、快捷,准确度高,重复性好,可用于佛手挥发油成分的定量分析及质量控制。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:185-186.
[ 2 ] 张桂芳,徐鸿华.佛手种质资源研究概况[J].广州中医药大学学报,2007,24(1):69-72.
[ 3 ] 赵永艳,胡瀚文,彭腾,等.佛手的化学成分药理作用及开发应用研究进展[J].时珍国医国药,2018,29(11):2734-2736.
[ 4 ] 郭卫东,郑建树,邓刚,等.佛手挥发油抑菌活性的研究[J].中国粮油学报,2009,24(8):103-107.
[ 5 ] 施长春,王建英,朱婉萍,等.佛手挥发油对哮喘的治疗作用[J].实用儿科临床杂志,2012,25(4):287-288.
[ 6 ] 高洪元,田青.佛手挥发油的抗抑郁作用机制探讨[J].中国实验方剂学杂志,2012,18(7):231-234.
[ 7 ] 吕学维,邵邻相,张均平,等.佛手挥发油对B16黑色素瘤细胞体外增殖的抑制作用[J].中国粮油学报,2011,26(8):50-54.
[ 8 ] 邵邻相,高海涛,成文召,等.佛手挥发油对小鼠体内B16黑色素瘤生长的影响[J].浙江师范大学学报(自然科学版),2012,35(2):184-188.
[ 9 ] 麻艳芳,邵邻相,张均平,等.佛手挥发油对MDA-MB435人乳腺癌细胞体外增殖的影响[J].中国药学杂志,2010,45(22):1737-1741.
[10] BAGETTA G,MORRONE L A,ROMBOLA L. Neuropharmacology of the essential oil of bergamot[J]. Fitoterapia,2010,81(6):453-461.
[11] 赵永艳,张军银,彭腾,等.不同产地佛手的挥发油成分比较分析[J].中国药房,2020,31(4):423-428.
[12] 马越,王利明,王晓杰,等.超临界CO2萃取佛手挥发油的工艺研究及GC-MS分析[J].食品科学,2009,30(2):221-223.
[13] 王建英,施长春,朱婉萍.金佛手挥发油化学成分的GC- MS研究[J].中国现代应用药学,2006,4(1):32-34.
[14] 金晓玲,徐丽珊,施潇,等. 4种佛手挥发油化学成分的研究[J].中国药学杂志,2002,37(10):19-21.
[15] 王俊华,符红.广佛手挥发油化学成分的GC-MS分析[J].中药材,1999,22(10):516-517.
[16] 胡明,权美平.佛手挥发油的化学成分分析研究进展[J].粮食与油脂,2019,32(1):7-9.
[17] 李思思,王涛,董志红,等.右旋柠檬烯的研究进展及其新型专利技术[J].河南医学研究,2013,22(4):636-638.
[18] SALEHI B,UPADHYAY S,ORHAN I E,et al. Therapeutic potential of α- and β-pinene:a miracle gift of nature[J]. Biomolecules,2019,9(11):738.
[19] DU Y,LUAN J,JIANG R P,et al. Myrcene exerts anti-asthmatic activity in neonatal rats via modulating the matrix remodeling[J]. Int J Immunopathol Pharmacol,2020,34(48):1-10.
[20] 章斌,侯小楨,秦轶,等.柠檬果皮精油主要组分抑菌及抗氧化活性研究[J].食品与机械,2017,33(12):138-142.
[21] 田吉,刘艳,雷素娟.气相色谱法测定佛手挥发油中柠檬烯含量[C]//2014年中国药学大会暨第十四届中国药师周论文集.石家庄:中国药学会,2014:1-6.
[22] 王智民,钱忠直,张启伟,等.一测多评法建立的技术指南[J].中国中药杂志,2011,36(6):657-658.
[23] 李倩,刘伟,罗祖良,等.一测多评法测定丹参中丹参酮ⅡA、隐丹参酮、丹参酮Ⅰ、二氢丹参酮Ⅰ的含量[J].中国中药杂志,2012,37(6):824-828.
[24] 王钰莹,冯伟红,杨菲,等.“一测多评”法测定三黄片中的大黄蒽醌类成分[J].中国中药杂志,2012,37(2):212- 217.
[25] 刘楚楚,王超,王录.内标法和外标法测定浓香型白酒中甲醇含量的比较分析[J].酿酒,2017,44(4):65-67.
[26] 薛敏.手动进样条件下内标法测酒中有机物指标的优势[J].大众标准化,2016,4(10):67-68.
[27] 付滢舟,冯有龙,曹玲,等.一测多评法测定速效救心丸中冰片的含量[J].药物分析杂志,2012,32(5):775-778,796.
(收稿日期:2021-04-20 修回日期:2021-07-16)
(编辑:陈 宏)
