贝莱斯芽孢杆菌LJ02中植物免疫蛋白的筛选及其功能
2021-09-02魏艳侠李卓然张斌苑瑜瑾于玮玮常若葵王远宏
魏艳侠,李卓然,张斌,苑瑜瑾,于玮玮,常若葵,王远宏
贝莱斯芽孢杆菌LJ02中植物免疫蛋白的筛选及其功能
魏艳侠1,李卓然1,张斌1,苑瑜瑾1,于玮玮1,常若葵2,王远宏1
1天津农学院园艺园林学院,天津 300384;2天津农学院工程技术学院,天津 300384
【】贝莱斯芽孢杆菌()LJ02菌株能够诱导黄瓜等植物产生免疫抗病反应。本研究从生防菌LJ02中分离鉴定具有激发植物免疫活性的蛋白分子,通过验证其功能,进一步解析免疫蛋白的免疫信号通路。用硫酸铵沉淀法处理LJ02菌株发酵液,离心获得LJ02蛋白粗提物,将其经凝胶层析后再利用半制备高效液相色谱(high performance liquid chromatography,HPLC)分离,收集不同峰值处的蛋白组分。以烟草花叶病毒(tobacco mosaic virus,TMV)为靶标进行活性组分的筛选,从而获得具有免疫活性的组分。液相质谱联用仪(LC-MS)检测分析活性组分后发现,在组分F-23中含鞭毛蛋白(flagellin,FlgLJ02)。将鞭毛蛋白FlgLJ02进行原核表达并纯化,经过敏性坏死反应(hypersensitive reaction,HR)和抗病试验验证其免疫功能。为确定其主要免疫信号通路,采用实时荧光定量PCR(qRT-PCR)检测水杨酸(salicylic acid,SA)和乙烯(ethylene,ET)途径的相关合成酶基因、以及免疫相关抗性基因、、和,通过免疫相关抗性基因的相对表达量解析鞭毛蛋白FlgLJ02免疫信号转导途径。HPLC层析分离出贝莱斯芽孢杆菌LJ02菌液产生的60个外泌蛋白组分(F-1—F-60),免疫烟草接种TMV后,观察分析发现组分F-20、F-23、F-41、F-44具有显著的免疫抗病效应,其中组分F-23抗TMV效果最为显著,其抑制率为81.7%。经过质谱数据分析发现该组分包含鞭毛蛋白FlgLJ02等7种物质。选择鞭毛蛋白FlgLJ02为研究对象构建表达载体,转化大肠杆菌BL21,诱导表达后破碎细胞,获得粗提蛋白。将粗提蛋白过柱、透析纯化后的FlgLJ02渗入珊西烟(var.)叶片,24 h后能观察到过敏性坏死反应。将FlgLJ02稀释为终浓度50、100、200 μg·ml-1的稀释液后预处理珊西烟叶片,24 h后接种TMV,其对TMV的枯斑抑制率分别为65.6%、76.1%、88.1%。用鞭毛蛋白FlgLJ02处理珊西烟,其SA途径和ET信号途径的免疫抗病相关基因、、、、、、的相对表达量在24—48 h均显著上调。贝莱斯芽孢杆菌LJ02外泌的鞭毛蛋白FlgLJ02可以激发珊西烟植株的免疫防御反应,提高烟草植株对TMV的抗病性。
贝莱斯芽孢杆菌;鞭毛蛋白;免疫蛋白;珊西烟;烟草花叶病毒
0 引言
【研究意义】贝莱斯芽孢杆菌()是一类好氧产芽孢的革兰氏阳性细菌,能分泌多种活性物质,直接或间接地诱导植物产生抗病性,进而减轻病原真菌、细菌和病毒等引起的多种病害[1-2]。分离贝莱斯芽孢杆菌免疫蛋白并研究其抗病功能及机制,对农业生产具有重要的实践意义和理论价值。【前人研究进展】贝莱斯芽孢杆菌是解淀粉芽孢杆菌()自植物亚种上升为种后的新命名[3]。贝莱斯芽孢杆菌通过促进植物生长、与病原菌竞争营养、分泌抗菌肽和抗生素以及诱导植物产生系统抗病性等多种机制抵御植物病原菌的侵染和危害[4-6]。贝莱斯芽孢杆菌在代谢过程中分泌某些蛋白和微生物相关分子模式(microbial-associated molecular pattern,MAMP)[1,7],这些分子能被植物细胞膜上特定受体蛋白(pattern recognition receptor,PRR)识别从而触发PTI(PAMP-triggered immunity)反应[8-9]。一些特定的效应蛋白能够触发植物的深层免疫ETI(effector-triggered immunity),导致过敏性坏死反应(hypersensitive response,HR)[10],使植株获得系统抗病性[11]。植物识别免疫因子后通过多种信号传导途径激发植物多重免疫防御反应,最终使植物产生系统抗病性。水杨酸(salicylic acid,SA)是介导植物由局部免疫抗病反应到获得系统抗病性产生的重要信号分子[12]。苯丙氨酸解氨酶(phenylalanine ammonia- lyase,PAL)和异分支酸合酶1(isochorismate synthase 1,ICS1)是SA合成的关键限速酶[13-14],二者的表达变化可以用来判断参与SA合成的时序动态。和是植物体内由SA信号介导系统获得抗性(systemic acquired resistance,SAR)反应途径的标志基因[15-16]。乙烯(ethylene,ET)是一种气态植物激素,在植物生长发育中起着至关重要的作用,ACS是合成乙烯前体的关键酶[17-18]。膜结合蛋白EIN2在乙烯信号传导途径中至关重要[19],裂解的EIN2羧基末端的核易位会介导乙烯信号免疫途径的激活[20],EIN2和正调控因子EIN3协同促进抗病基因表达[21]。鞭毛蛋白是细菌特有的结构性蛋白[22],是细菌运动的重要支架、动力元件和毒力因子[23-24],也是触发宿主免疫的重要元件[25]。鞭毛蛋白极易被宿主的天然免疫受体TLR5识别,同时向免疫系统发出预警信号,继而诱发宿主免疫反应抵御病原体[26]。菌株VB7的鞭毛蛋白可诱导番茄产生对GBNV(groundnut bud necrosis virus)的抗性[27];超表达的拟南芥识别细菌鞭毛蛋白flg22,对轮纹病的抗性明显提高[28];解淀粉芽孢杆菌CRN9的MAMP分子(鞭毛蛋白)能够通过激活SA和茉莉酸(jasmonate,JA)信号通路触发辣椒植株的免疫反应从而抑制花生芽坏死病毒(groundnut bud necrosis virus)[29]。【本研究切入点】贝莱斯芽孢杆菌LJ02是一种防治多种作物病害的生防菌株,其发酵上清对黄瓜尖镰孢(f. sp.)、灰葡萄孢()具有免疫抗性,能激发植物防御反应而有效防治病害[30-32],但其免疫因子尚未被分离研究。【拟解决的关键问题】通过分离纯化、质谱分析和诱导抗病性分析,分离贝莱斯芽孢杆菌LJ02中激发植物抗病的免疫蛋白并研究其激发植物免疫的信号传导通路。
1 材料与方法
试验于2018年7月至2020年9月在天津农学院植物免疫与生物防治实验室完成。
1.1 供试材料
供试菌株:贝莱斯芽孢杆菌LJ02由天津农学院植物免疫与生物防治实验室保存,LJ02活化和发酵均用LB 培养基;病原:烟草花叶病毒(tobacco mosaic virus,TMV)由本实验室保存;供试植株:珊西烟(var.)种子由本实验室保存。珊西烟置于相对湿度65%,温度20—25℃,16 h 光照/8 h 黑暗,光强 10 000 lx的INE800 Memmert培养箱生长至约2 cm时,移植于装有预处理的营养土(营养土于烘箱中121℃干热灭菌1 h后与蛭石按2﹕1混匀)的花盆(8 cm×8 cm)中,生长至两片真叶待用。
表达载体pET-30a,菌株 DH5和表达菌株 BL21(DE3)由本实验室提供。限制性内切酶和重组酶购自Takara,纯化镍柱购自GE公司,SDS-PAGE凝胶配制试剂盒购自Applygen,其他试剂均为国产常规试剂。
1.2 LJ02免疫蛋白的提取
收集 LJ02发酵液1 L,在4℃,9 500 r/min条件下离心10 min获得LJ02上清液,将上清液冰上预冷10 min后加入5 g EDTA充分搅拌,再加入8 ml巯基乙醇和50%硫酸铵搅拌混匀,4℃冰箱静置10 h后离心分离上清和沉淀,收集上清,沉淀用1 mmol·L-1pH=5.2、7.2、8.0、8.7 Tris-HCl依次溶解后离心取上清;制备型 HPLC分离,分离条件:Spehadex-G200柱,流动相Tris-HCl﹕甲醇=1﹕2;流速0.2 ml·min-1;检测波长:280 nm;柱温:25℃。观察峰图并收集,按出峰顺序标记蛋白组分 F-1 至结束。
免疫组分筛选:选两叶期珊西烟植株茎基部注射100 μl蛋白组分,设置Tris-HCl溶液、清水对照,每组处理5个重复,24 h后在珊西烟顶2叶参照Gooding等[33]方法接种TMV并观察记录枯斑数,以Tris-HCl 溶液为对照,计算抑制率。对抗TMV最明显的蛋白组分经LC-MS检测所含蛋白成分。抑制率(%)=(对照平均枯斑数-处理平均枯斑数)/对照平均枯斑数×100。
1.3 FlgLJ02的载体构建及表达纯化
载体构建:菌株LJ02在NCBI的登录号为CP024797.1,根据鞭毛蛋白(flagellin,FLgLJ02)的基因序列设计特异引物(F:5′GAAGGAGATATACA TATGCATCATCACCAC3′;R:5′GCTCGAGTGCGGC CGCAAGCTTTCATTAATCAAC3′),用内切酶酶切载体pET-30a和扩增的目的片段,回收后连接、转化到DH5中,提取质粒、酶切和测序验证,将构建的载体pET-30a-FlgLJ02转化至大肠杆菌BL21(DE3)。
诱导表达:挑单菌落,37℃培养至 OD600=0.8时,加入0.5 mmol·L-1IPTG溶液,在16℃摇床摇培16 h后,将培养液12 000 r/min离心5 min除上清液,加PBS 缓冲液重悬沉淀,取100 μl重悬液加等体积2×SDS sample buffer煮沸10 min,离心取上清,加入SDS-PAGE制备胶,电泳分析结果。
纯化:PBS 重悬液超声裂解后,同时以20 mmol·L-1Tris(pH 8.0),300 mmol·L-1NaCl,20 mmol·L-1咪唑缓冲液平衡Ni-IDA柱后,用50、300 mmol·L-1咪唑缓冲液洗脱目的蛋白,并收集每个洗脱组分进行SDS-PAGE分析,将目的蛋白透析到储存液(20 mmol·L-1Tris,5%甘油,pH 8.0)中,透析后用0.22 μm滤器过滤,进行SDS-PAGE 和蛋白印记(Western blot)分析,采用 Bradford 法测定蛋白浓度。
1.4 鞭毛蛋白FlgLJ02在珊西烟上的免疫分析
1.4.1 FlgLJ02的HR效应分析 选取3—4片真叶的珊西烟植株,将100 μl 200 μg·ml-1FlgLJ02表达蛋白通过渗入器渗入到顶2叶上,设置Tris甘油和清水对照,每处理5个重复,24 h后观察叶片渗入部位表型变化。
1.4.2 FlgLJ02诱导珊西烟抗TMV效果检测 选两叶期珊西烟植株,分别用50、100、200 μg·ml-1的FlgLJ02纯化蛋白在烟草植株茎基部注射100 μl,设置清水、蛋白储存液Tris甘油对照,每组处理5个重复, 24 h后在顶2叶接种TMV,3 d后观察记录枯斑数,并计算抑制率(方法同1.2)。
1.4.3 免疫抗病相关基因qRT-PCR分析 引物设计:参考GenBank(www.ncbi.nlm.nih.gov/genbank/)珊西烟数据库中、、、、、、基因序列,以为内参基因,设计特异性引物(表1)。样品预处理:选两叶期珊西烟植株,用200 μg·ml-1的FlgLJ02纯化蛋白在烟草植株茎基部注射100 μl,设置清水、Tris甘油对照,每处理3个重复,分别在0、12、24、36、48、96 h收集叶片,提取待测样品总RNA(Trizol Reagent TaKaRa),反转录为cDNA模板(RT reagent Kit 试剂盒,TaKaRa)。反应体系:cDNA 2 μl,目的基因上下游引物各1 μl,TB Green Premix(TaKaRa)12.5 μl,ddH2O补足25 μl。反应程序:95℃,5 min;95℃,10 s;55℃,30 s;60℃,5 s;50个循环,设置5个机械重复。采用 2-ΔΔCt计算方法[34]进行分析。

表1 实时荧光定量PCR相关表达基因的引物
2 结果
2.1 LJ02外泌免疫蛋白组分筛选
免疫外泌组分通过HPLC分离,共获得60个分离组分。将分离的60个组分分别处理珊西烟后,进行抗TMV活性检测,3 d后观察结果,发现组分F-20、F-23、F-41和F-44处理的叶部枯斑数明显少于Tris-HCl 和清水处理的对照组,对TMV的抑制率分别为26.7%、81.7%、67.2%和61.8%(图1),说明发酵液中存在有活性的可外泌的免疫蛋白。在4种LJ02蛋白组分中,组分F-23诱导的珊西烟植株对TMV抗性效果较好,据此对组分F-23中的成分进一步分析和鉴定。
2.2 免疫组分F-23的质谱检测与分析
经LC-MS检测后发现,F-23蛋白成分中包含鞭毛蛋白(FlgLJ02)等7种蛋白(表2),其中FlgLJ02在蛋白库的匹配率为1.8%,占比最高。该蛋白由306个氨基酸组成,分子量为32.6kD。与基因组数据比对分析发现编码FlgLJ02的开放阅读框918 bp,FlgLJ02上有一段氨基酸序列(EKLSSGLRINRAGDDAAG LAIS)与Flg22(QRLSTGSRINSAKDDAAGLQIA)相似性63.6%,具有较高的保守性。

柱上不同小写字母表示经单因素方差分析差异显著(P≤0.05)。图4-B同
2.3 鞭毛蛋白FlgLJ02原核表达和纯化
鞭毛蛋白能够与植物受体互作,激发植物免疫[23],笔者推测FlgLJ02同样具备免疫效应,但其功能是否一致尚不清晰。构建表达载体,在大肠杆菌BL21(DE3)中表达FlgLJ02,将细胞裂解后,发现融合蛋白存在于上清液中(图2-A),用 50 mmol·L-1咪唑过Ni-IDA柱进行洗脱,得到融合表达的FlgLJ02,对洗脱蛋白进行透析浓缩,纯化后进行SDS-PAGE和蛋白印迹western blot分析,其分子量在31—33 kD,与预测的分子量大小基本一致,得到表达蛋白终浓度为0.5 mg·ml-1(图2-B、2-C)。

表2 组分F-23中蛋白质谱检测结果

A:SDS-PAGE分析FlgLJ02蛋白在 BL21(DE3)中表达情况SDS-PAGE analysis of the expression of FlgLJ02 protein in BL21(DE3);M:protein marker;1:对照(不加IPTG)Control (no IPTG);2:16℃诱导16 h Induction at 16℃ for 16 h;3:破碎离心后上清Supernatant after breaking cells;4:破碎离心后沉淀Precipitate after centrifugation。B:纯化蛋白FlgLJ02的SDS-PAGE分析 SDS-PAGE analysis of purified protein FlgLJ02;5:BSA (1.50 μg);6:FlgLJ02纯化物(1.50 μg) Purified FlgLJ02 product (1.50 μg)。C:纯化蛋白的Western blot 分析Western blot analysis of purified protein
2.4 鞭毛蛋白FlgLJ02的免疫功能
2.4.1 FlgLJ02在珊西烟上引起HR反应 为初步判断FlgLJ02能否产生免疫效应,将纯化的FlgLJ02稀释为200 μg·ml-1后取100 μl渗入珊西烟叶片,以Tris甘油和清水为对照,24 h后观察HR表型。结果显示,对照无明显HR反应,但在渗入FlgLJ02的叶部周围产生约0.8 cm的快速坏死斑(图3),说明FlgLJ02能引起珊西烟HR反应。
2.4.2 FlgLJ02免疫珊西烟抵御TMV侵染 分别用50、100、200 μg·ml-1FlgLJ02纯化蛋白注射处理珊西烟24 h 后在顶2叶摩擦接种TMV,观察其产生的枯斑表型(图4-A),发现经FlgLJ02处理的烟草植株叶片接种TMV后产生枯斑数明显少于对照组,不同处理对TMV枯斑抑制率(图4-B)依次为65.6%、76.1%、88.1%,且200 μg·ml-1FlgLJ02处理的植株抗TMV活性最为显著,说明FlgLJ02能够免疫植物且具有剂量效应。

图3 FlgLJ02在烟草叶片上的HR反应
2.5 FlgLJ02 诱导后启动SA免疫信号通路中关键基因的表达
为进一步探究FlgLJ02激发珊西烟免疫抗病的信号通路,将200 μg·ml-1FlgLJ02通过茎基部注射处理珊西烟,分析系统叶SA途径与抗性信号相关的标志性基因、、、的相对表达量(图5)。、两者表达同时上调,但最大表达量较早12 h。是免疫信号传导的关键枢纽,通过与SA结合启动免疫抗病信号转录,其转录产物包括SA信号终端标志性抗病基因。、的转录上调进一步说明SA信号途径参与了FlgLJ02启动的免疫调节。

图4 FlgLJ02诱导烟草对TMV的抗性
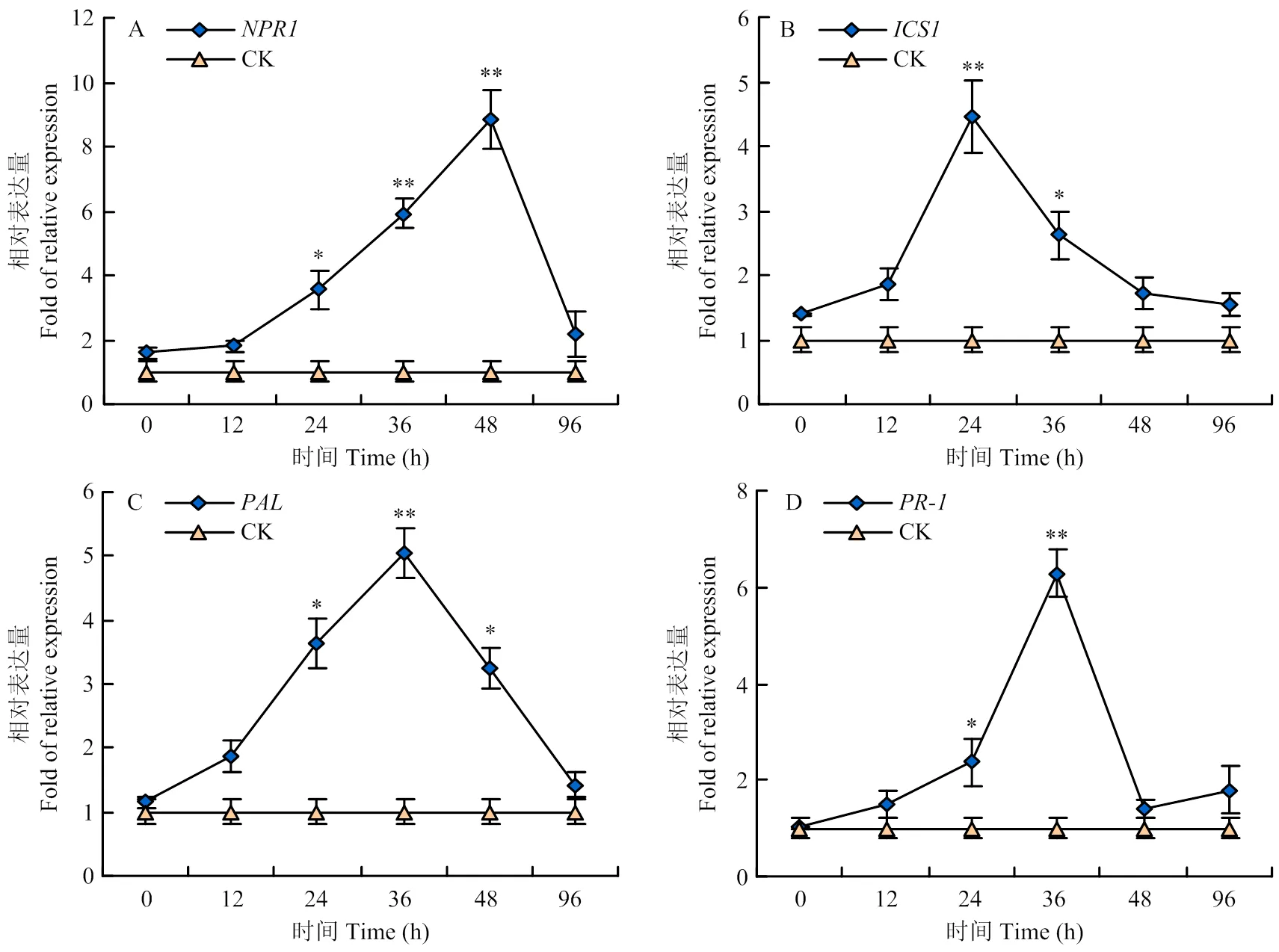
通过t检验确定显著性(n=3)Significance was determined by t-test (n=3). * P<0.05; ** P<0.01 。图6同The same as Fig. 6
2.6 FlgLJ02 诱导后启动ET免疫信号通路关键基因的表达
ET信号转导途径是植物免疫的另一重要通路,EIN2在细胞核中与其他因子协同启动乙烯信号传导[35]。核蛋白EIN3是乙烯信号转导途径的下游因子[36]。由图6可见,合成乙烯途径的关键酶基因[37]在24 h时相对表达量极显著上调至最大值;和在36 h时相对表达量极显著上调至最大值,显示了免疫信号启动的时序性。上述结果表明ET也参与了FlgLJ02启动的免疫抗病反应。

图6 FlgLJ02 诱导后ET通路关键基因的相对表达量
3 讨论
贝莱斯芽孢杆菌LJ02是一株根际土壤生防菌,研究发现LJ02发酵液处理盆栽黄瓜根部能免疫黄瓜植株对灰葡萄孢产生明显抗性,并诱导病程相关基因的表达上调[31],但LJ02中具有免疫功能的因子尚未被分离。本研究从LJ02发酵上清中分离筛选到诱导烟草抗TMV效果明显的4种外泌组分,说明菌株LJ02存在多种免疫激发因子。经 LC-MS检测发现组分F-23含有鞭毛蛋白FlgLJ02等7 种物质(表2),鞭毛蛋白FlgLJ02在总组分中占比最高,确证了FlgLJ02是诱导烟草抗TMV的一个作用因子。组分中含有肌苷5′-单磷酸脱氢酶(inosine-5′- monophosphate dehydrogenase,IMPDH),IMPDH在生物体内主要负责GTP的合成,在医学领域常作为免疫抑制剂的靶标[38],在植物体内是否促进GTP的合成进而弥补由植物免疫抵御病原菌造成的能量损失或者参与了其他免疫调节途径还不清楚。另外,P型ATP酶(P-type ATPases,ATPase P)等物质也可能具有激发珊西烟免疫抗病的作用[39]。
植物与微生物互作过程中,细菌鞭毛蛋白被植物体内感知系统识别[40],植物感知到信号后,传递信号至下游靶标,进而启动宿主的多层免疫机制[41-42]。本研究比对分析后发现,鞭毛蛋白FlgLJ02与Flg22相似度>60%,且存在6个连续相似的氨基酸序列(DDAAGL),保守性相对较高。Flg22通过结合诱导FLS2与BAK1异构化,激活下游的植物免疫信号传导[43],FlgLJ02序列的保守性是保证其与受体互作传递信号的结构基础。Flg是植物与细菌互作诱发植物PTI的模式分子,用FlgLJ02处理烟草能够强烈抑制TMV的侵染,并在24 h能观察到明显的HR 反应,HR反应是效应因子与抗病基因互作产生ETI的一种表现。本研究中的HR反应可能与高剂量FlgLJ02处理烟草激发高强度的免疫反应有关。PTI和ETI之间除了模式分子、互作的受体不同之外,另一个重要的区别在于ETI激发的免疫强度更高,是一种快速、强度大的PTI[11],试验中虽然没有对FlgLJ02导致的HR表型更进一步的分子解析,但可以推测FlgLJ02与受体结合产生的免疫强度高于一般的PTI,更接近于ETI。此外,不同细菌的鞭毛蛋白与植物互作激发的免疫反应程度差异很大,例如土壤杆菌和中华根瘤菌的鞭毛蛋白激发的免疫反应要远弱于丁香假单胞鞭毛蛋白[41]。因此,FlgLJ02产生HR反应也可能与其特异性有关。
高强度的免疫与SA和ET的活力冗余相关联[44],为探索FlgLJ02是否激活了SA、ET信号通路、免疫时效及其与HR的关系,本研究持续检测了这两个信号通路中的关键基因的表达。用FlgLJ02处理珊西烟植株叶片,、在24 h表达量最高,、、、在36 h表达量上调至最高,而在48 h表达量最高,表明FlgLJ02可以提高植物经SA和ET传导的免疫强度,下游免疫相关因子促使产生HR反应(图3)。研究还发现,在FlgLJ02处理烟草后,ET和SA信号通路的关键基因表达表现出较好的协调性和一致性,这两个通路的协同有助于强化FlgLJ02的免疫效果,这与之前对LJ02的其他研究结果较为一致[31-32]。
4 结论
从贝莱斯芽孢杆菌LJ02中分离到外泌的鞭毛蛋白FlgLJ02,该表达蛋白可使烟草产生过敏性反应,显著增强对TMV的抗性,处理后SA内源合成酶基因和表达量上调,增强了免疫抗病相关基因表达;ET合成关键酶基因及抗病转录因子和表达上调,表明鞭毛蛋白FlgLJ02能激活ET信号免疫途径。因此,FlgLJ02可以通过SA、ET两条信号通路激发植物产生免疫抗性。
[1] RABBEE M F, ALI M S, CHOI J, HWANG B S, JEONG S C, BAEK K H.: A valuable member of bioactive molecules within plant microbiomes. Molecules, 2019, 24(6): 1046.
[2] RAHMAN A, UDDIN W, WENNER N G. Induced systemic resistance responses in perennial ryegrass againstelicited by semi-purified surfactin lipopeptides and live cells of. Molecular Plant Pathology, 2015, 16(6): 546-558.
[3] FAN B, BLOM J, KLENK H P, BORRISS R.,, andform an “Operational Group” within thespecies complex. Frontiers in Microbiology, 2017, 8: 22.
[4] FAN B, WANG C, SONG X F, DING X L, WU L M, WU H J, GAO X F, BORRISS R.FZB42 in 2018: The Gram-positive model strain for plant growth promotion and biocontrol. Frontiers in Microbiology, 2018, 9: 2491.
[5] PANDIN C, DARSONVAL M, MAYEUR C, LE COQ D, Aymerich S, Briandet R. Biofilm formation and synthesis of antimicrobial compounds by the biocontrol agentQST713 in ancompost micromodel. Applied and Environmental Microbiology, 2019, 85(12): e00327-19.
[6] CHEN M, WANG J, LIU B, Zhu Y, Xiao R, Yang W, Ge C, Chen Z. Biocontrol of tomato bacterial wilt by the new strainFJAT-46737 and its lipopeptides. BMC Microbiology, 2020, 20(1): 160.
[7] WANG N B, LIU M J, GUO L H, YANG X F, QIU D W. A novel protein elicitor (PeBA1) froms NC6 induces systemic resistance in tobacco. International Journal of Biological Sciences, 2016, 12(6): 757-767.
[8] RANF S, GISCH N, SCHAFFER M, ILLIG T, WESTPHAL L, KNIREL Y A, SANCHEZ-CARBALLO P M, ZAHRINGER U, HUCKELHOVEN R, LEE J, SCHEEL D. A lectin S-domain receptor kinase mediates lipopolysaccharide sensing in. Nature Immunology, 2015, 16(4): 426-433.
[9] HE P, SHAN L, SHEEN J. Elicitation and suppression of microbe- associated molecular pattern-triggered immunity in plant-microbe interactions. Cellular Microbiology, 2007, 9(6): 1385-1396.
[10] NEWMAN M A, SUNDELIN T, NIELSEN J T, ERBS G. MAMP (microbe-associated molecular pattern) triggered immunity in plants. Frontiers in Plant Science, 2013, 4: 139.
[11] Naveed Z A, Wei X, Chen J, Mubeen H, Ali G S. The PTI to ETI continuum in-plant interactions. Frontiers in Plant Science, 2020, 11: 593905.
[12] KUMAR D. Salicylic acid signaling in disease resistance. Plant Science, 2014, 228: 127-134.
[13] SUMAYO M S, SON J S, GHIM S Y. Exogenous application of phenylacetic acid promotes root hair growth and induces the systemic resistance of tobacco against bacterial soft-rot pathogensubsp.. Functional Plant Biology, 2018, 45(11): 1119-1127.
[14] ZHENG X Y, ZHOU M, YOO H, PRUNDA-PAZ J L, SPIVEY N W, KAY S A, DONG X. Spatial and temporal regulation of biosynthesis of the plant immune signal salicylic acid. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(30): 9166-9173.
[15] BACKER R, NAIDOO S, VAN DEN BERG N. The nonexpressor of pathogenesis-related genes 1 (NPR1) and related family: Mechanistic insights in plant disease resistanceFrontiers in Plant Science, 2019, 10: 102.
[16] LINCOLN J E, SANCHEZ J P, ZUMSTEIN K, GILCHRIST D G. Plant and animal PR1 family members inhibit programmed cell death and suppress bacterial pathogens in plant tissues. Molecular Plant Pathology, 2018, 19(9): 2111-2123.
[17] FRANKOWSKI K, KESY J, KOTARBA W, KOPCEWICZ J. Ethylene signal transduction pathway. Postepy Biochemii, 2008, 54(1): 99-106.
[18] PETRUZZELL L, CORAGGIO I, LEUBNER-METZGER G. Ethylene promotes ethylene biosynthesis during pea seed germination by positive feedback regulation of 1-aminocyclo-propane-1-carboxylic acid oxidase.Planta, 2000, 211(1): 144-149.
[19] ZHANG F, WANG L, QI B, ZHAO B, KO E E, RIGGAN N D, CHIN K, QIAO H. EIN2 mediates direct regulation of histone acetylation in the ethylene response. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(38): 10274-10279.
[20] Wen X, Zhang C, Ji Y, Zhao Q, He W, An F, Jiang L, Guo H. Activation of ethylene signaling is mediated by nuclear translocation of the cleaved EIN2 carboxyl terminus. Cell Research, 2012, 22(11): 1613-1616.
[21] AN F, ZHAO Q, JI Y, LI W, JIANG Z, YU X, ZHANG C, HAN Y, HE W, LIU Y, ZHANG S, ECKER J R, GUO H. Ethylene-induced stabilization of ETHYLENE INSENSITIVE3 and EIN3-LIKE1 is mediated by proteasomal degradation of EIN3 binding F-box 1 and 2 that requires EIN2 in. The Plant Cell, 2010, 22(7): 2384-2401.
[22] KIM M, LEE C, PARK J, JEON B Y, HONG M. Crystal structure offlagellin and structure-guided fusion-protein designs.Scientific Reports, 2018, 8(1): 5814.
[23] MOHARI B, THOMPSON M A, TRINIDAD J C, SETAYESHGAR S, FUQUA C. Multiple flagellin proteins have distinct and synergistic roles inmotility.Journal of Bacteriology, 2018, 200(23): e00327-18.
[24] BERG H C, ANDERSON R A. Bacteria swim by rotating their flagellar filaments. Nature, 1973, 245(5425): 380-382.
[25] FORSTNERIC V, IVICAK-KOCJAN K, LJUBETIC A, JERALA R, BENCINA M. Distinctive recognition of flagellin by human and mouse toll-like receptor 5. PLoS One, 2016, 11(7): e0158894.
[26] MCNAMARA N, GALLUP M, SUCHER A, MALTSEVA I, MCKEMY D, BASBAUM C. AsialoGM1 and TLR5 cooperate in flagellin-induced nucleotide signaling to activate Erk1/2. American Journal of Respiratory Cell and Molecular Biology, 2006, 34(6): 653-660.
[27] VANTHANA M, NAKKEERAN S, MALATHI V G, RENUKADEVI P, VINODKUMAR S. Induction of in planta resistance by flagellin (Flg) and elongation factor-TU (EF-Tu) of(VB7) against groundnut bud necrosis virus in tomato. Microbial Pathogenesis, 2019, 137: 103757.
[28] 刘秀霞, 梁宇宁, 张伟伟, 霍艳红, 冯守千, 邱化荣, 何晓文, 吴树敬, 陈学森. 超表达的拟南芥突变体识别细菌鞭毛蛋白提高对轮纹病菌的抗性. 园艺学报, 2018, 45(5): 827-844.
LIU X X, LIANG Y N, ZHANG W W, HUO Y H, FENG S Q, QIU H R, HE X W, WU S J, CHEN X S.recognizes bacterial flagellin flg22 and enhances immune resistance against apple ring rot causal fungi inmutant. Acta Horticulturae Sinica, 2018, 45(5): 827-844. (in Chinese)
[29] RAJAMANICKAM S, NAKKEERAN S. Flagellin ofworks as a resistance inducer against groundnut bud necrosis virus in chilli (L.). Archives of Virology, 2020, 165(7): 1585-1597.
[30] 谷医林, 王远宏, 常若葵, 李宁, 李娟, 徐明珠. 解淀粉芽孢杆菌LJ1诱导黄瓜抗白粉病的研究. 农药学学报, 2013, 15(3): 293-298.
GU Y L, WANG Y H, CHANG R K, LI N, LI J, XU M Z. Characterization of powdery mildew resistance induced byLJ1 in cucumber. Chinese Journal of Pesticide Science, 2013, 15(3): 293-298. (in Chinese)
[31] 柴庆凯, 张斌, 常若葵, 刘慧芹, 田小卫, 王远宏. 解淀粉芽孢杆菌LJ02对黄瓜抗灰霉病菌的生防效果及其诱导抗性机理的初步研究. 植物病理学报, 2019, 49(6): 828-835.
CHAI Q K, ZHANG B, CHANG R K, LIU H Q, TIAN X W, WANG Y H. Preliminary study on the effect of the induced resistance in cucumber withLJ02 against. Acta Phytopatholgica Sinica, 2019, 49(6): 828-835. (in Chinese)
[32] LI Y L, GU Y L, LI J, XU M Z, WEI Q, WANG Y H. Biocontrol agentLJ02 induces systemic resistance against cucurbits powdery mildew. Frontiers in Microbiology, 2015, 6: 883.
[33] GOODING G V, HEBERT T T. A simple technique for purification of tobacco mosaic virus in large quantities. Phytopathology, 1967, 57(11): 1285.
[34] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod. Methods, 2001, 25(4): 402-408.
[35] ALONSO J M, HIRAYAMA T, ROMAN G, NOURIZADEH S, ECKER J R. EIN2, a bifunctional transducer of ethylene and stress responses in.Science, 1999, 284(5423): 2148-2152.
[36] SOLANO R, STEPANOVA A, CHAO Q, ECHER J R. Nuclear events in ethylene signaling: a transcriptional cascade mediated by ETHYLENE-INSENSITIVE3 and ETHYLENE-RESPONSE-FACTOR1. Genes and Development, 1998, 12(23): 3703-3714.
[37] WANG S, HAN K, PENG J, ZHAO J, JIANG L, LU Y, ZHENG H, LIN L, CHEN J, YAN F. NbALD1 mediates resistance to turnip mosaic virus by regulating the accumulation of salicylic acid and the ethylene pathway in. Molecular Plant Pathology, 2019, 20(7): 990-1004.
[38] SHAH C P, KHARKAR P S. Inosine 5′-monophosphate dehydrogenase inhibitors as antimicrobial agents: recent progress and future perspectives. Future Science Medicinal Chemistry, 2015, 7(11): 1415-1429.
[39] SHUKLA D, HUDA K M, BANU M S, Gill S S, TUTEJA R, TUTEJA N. OsACA6, a P-type 2B Ca2+ATPase functions in cadmium stress tolerance in tobacco by reducing the oxidative stress load. Planta, 2014, 240(4): 809-824.
[40] LU Y, SWARTZ J R. Functional properties of flagellin as a stimulator of innate immunity. Scientific Reports, 2016, 6: 18379.
[41] FELIX G, DURAN J D, VOLKO S, BOLLER T. Plants have a sensitive perception system for the most conserved domain of bacterial flagellin. The Plant Journal, 1999, 18(3): 265-276.
[42] LOPEZ M, MIRANDA E, RAMOS C, GARCIA H, NEIRA- CATTILLO A. Activation of early defense signals in seedlings oftreated with chitin nanoparticles.Plants, 2020, 9(5): 607.
[43] LU D, WU S, GAO X, ZHANG Y, SHAN L, HE P. A receptor-like cytoplasmic kinase, BIK1, associates with a flagellin receptor complex to initiate plant innate immunity. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(1): 496-501.
[44] TSUDA K, SATO M, STODDARD T, GLAZEBROOK J, KATAGIRI F. Network properties of robust immunity in plants. PLoS Genetics, 2009, 5(12): e1000772.
Screening and Function of Plant Immune Proteins fromLJ02
WEI YanXia1, LI ZhuoRan1, ZHANG Bin1, YUAN YuJin1, YU WeiWei1, CHANG RuoKui2, WANG YuanHong1
1Department of Horticulture, Tianjin Agricultural University, Tianjin 300384;2College of Engineering and Technology, Tianjin Agricultural University, Tianjin 300384
【】LJ02 induces the immune response of cucumbers and other crops. The objective of this study is to screen and identify the immune proteins of LJ02, and further analyze the immune signalling pathways by verifying their functions.【】The LJ02 fermentation broth was precipitated with ammonium sulfate precipitation method, and the crude proteins of LJ02 were obtained by centrifugation. Then crude proteins were gel chromatographed and separated by high performance liquid chromatography (HPLC) to collect protein components at different peaks. The immune components were tested with tobacco mosaic virus(TMV) to obtain the immune components in plant. Liquid-phase mass spectrometry (LC-MS) detection and analysis revealed that the component F-23 contained flagellin (FlgLJ02). Purified recombinant protein FlgLJ02producedfromexpressionsystem was infiltrated into tobacco leaves and its immune function was verified by hypersensitive reaction (HR) and immune resistance analysis. Real-time fluorescent quantitative PCR (qRT-PCR) was used to detect salicylic acid (SA) and ethylene (ET) key synthetase genes,,and immune-related resistance genes,,andThe relative expression of its immune-related resistance genes was tested to identify the FlgLJ02-induced immune signal transduction pathway.【】Sixty exocrine protein components (from F-1 to F-60) of LJ02 were separated from HPLC, and components F-20, F-23, F-41, F-44 had strong immune effect against TMV in tobacco, among which, component F-23 showed the most significant anti-TMV effect, with an inhibition rate of 81.7%. Further mass spectrometry analysis found that this component contained flagellin FlgLJ02and other 6 substances. The FlgLJ02expression vector was constructed, and then transformed intoBL21, the cells were broken after inducing the expression of FlgLJ02. The crude protein was eluted with Ni column purification, further dialyzed, then injected FlgLJ02into tobacco leaves, hypersensitive reactions appeared about 24 h. Tobacco leaves was infiltrated with 50, 100 and 200 μg·ml-1FlgLJ02, and then TMV was inoculated 24 hours post FlgLJ02inoculation (hpi). The inhibition rate of FlgLJ02against TMV was 65.6%, 76.1% and 88.1%, respectively. The qRT-PCR determined that the expressions of SA and ET via defense-related genes,,,,,,and【】The FlgLJ02secreted by theLJ02 activates the SA and ET signalling immune pathway, thereby improving plants disease resistance to TMV.
; flagellin; immune protein;var.;tobacco mosaic virus (TMV)

10.3864/j.issn.0578-1752.2021.16.008
2020-12-03;
2021-01-11
国家重点研发计划(SQ2017ZY060083)、天津市蔬菜现代农业产业技术体系创新团队(ITTVrS2019011)
魏艳侠,E-mail:1486981814@qq.com。通信作者王远宏,E-mail:wangyh@tjau.edu.cn。通信作者常若葵,E-mail:changrl@163.com
(责任编辑 岳梅)
