动物组织中GLUD1 基因表达与GDH 蛋白结构分析
2021-08-31徐鸿洋德宝军周欢敏
徐鸿洋,徐 晶,房 君,德宝军,周欢敏
(1.内蒙古农业大学生命科学学院,内蒙古 呼和浩特 010018;2.内蒙古自治区生物制造重点实验室,内蒙古 呼和浩特 010018)
谷 氨 酸 脱 氢 酶 (glutamate dehydrogenase,GDH)由谷氨酸脱氢酶基因(glutamate dehydrogenase 1,GLUD1) 编码, 是谷氨酰胺代谢过程中以NAD+或NADP+作为辅助因子,催化谷氨酸氧化脱氨基转变成α-酮戊二酸并进入TCA 循环的关键酶之一[1-5],也是α-酮酸在体内转化的主要途径,由GDH 催化的谷氨酸氧化过程也是机体获得ATP 的重要途径[6],该步骤的生化反应方程式为:glutamate +H2O +NAD (P)+⇌α -ketoglutarate +NADPH+NH4++H+[7]。GDH 除了催化L-谷氨酸脱氨基, 还催化L-缬氨酸、L-亮氨酸等氨基酸脱氨基。
GDH 是一种线粒体酶,在哺乳动物不同组织中的分布和活性不同,在肝脏中的活性最高,然后是肾脏、脑、骨骼肌以及白细胞[8-9]。 已有研究证实GLUD1 基因的高表达与细胞的增殖、 肝脏疾病、肿瘤发生等密切相关[10-13]。 对高胰岛素—高血氨综 合 征 (hyperinsulinism/hyperammonemia syndrome,HI/HA)[14]、帕 金 森 病(parkinson′s disease,PD)[15-16]等疾病患者进行研究,发现患者GLUD1基因发生了特异性突变。 为探究大鼠、绵羊、梅花鹿不同组织中GLUD1 基因的表达情况, 比较人、小鼠、大鼠、山羊、绵羊、牛和猪GDH 蛋白的结构差异,该研究通过采集大鼠、绵羊、梅花鹿的肝脏、肾脏、皮肤、脂肪和肌肉5 种新鲜组织样品,提取各组织总RNA, 对不同动物不同组织中GLUD1基因进行qRT-PCR 分析,并比较人、小鼠、大鼠、山羊、绵羊、牛和猪7 个物种GDH 蛋白的氨基酸序列, 模拟这7 个物种的GDH 蛋白三维空间结构, 为进一步研究GLUD1 基因的表达模式与GDH 蛋白的功能奠定基础。
1 材料和方法
1.1 试验材料
大鼠肝脏、肾脏、皮肤、脂肪和肌肉组织采自内蒙古自治区生物制造重点实验室饲养的成年大白鼠,绵羊肝脏、肾脏、皮肤、脂肪和肌肉组织采自内蒙古乌兰察布市四子王旗某屠宰场, 梅花鹿肝脏、肾脏、皮肤、脂肪和肌肉组织采自内蒙古呼和浩特市土默特左旗某梅花鹿养殖场, 上述新鲜动物组织在采样结束后立即置于液氮罐中带回实验室备用。
1.2 数据下载
从反刍动物基因组数据库(http://animal.nwsuaf.edu.cn/code/source/download/)和NCBI 数据库(https://www.ncbi.nlm.nih.gov/) 中下载大鼠、绵羊、梅花鹿GLUD1 基因序列、内参基因β-actin 序列、mRNA 序列以及人、小鼠、大鼠、山羊、绵羊、牛和猪GDH 蛋白氨基酸序列用于后续分析。
1.3 动物组织总RNA 的提取与反转录
取“1.1”项下采集的动物组织样品,用无酶剪刀快速获取适当大小的组织块置于无酶的1.5 mL离心管中, 使用研磨杵在液氮中将组织块充分研磨成粉末,使用Trizol 裂解法(TaKaRa)提取各组织总RNA,使用Nanodrop 2000 检测RNA 样品浓度。根据TaKaRa 公司反转录试剂盒说明将RNA样品反转录成cDNA;RT-PCR 反应体系为10 μL:5×PrimeScript RT Master Mix 2 μL,RNA 样品3 μL(共400 ng 以 上),ddH2O 5 μL;RT-PCR 反 应 条件:37 ℃15 min;85 ℃5 s,4 ℃保温。
1.4 GLUD1 基因的PCR 鉴定
用Primer Premier 5.0 软件分别设计大鼠、绵羊和梅花鹿的β-actin 和GLUD1 基因引物, 引物序列见表1,引物由上海生工生物工程股份有限公司合成。 分别使用大鼠、绵羊和梅花鹿肝脏组织cDNA 样品对β-actin 基因和GLUD1 基因进行PCR 扩 增,PCR 反 应 体 系 为20 μL:Taq mix 10 μL,上、下游引物各1 μL,cDNA 模板2 μL(共100 ng 以上),ddH2O 6 μL;PCR 反应条件:94 ℃预变性5 min,94 ℃变性30 s, 退火30 s,72 ℃延伸30 s,30 个循环;72 ℃后延伸5 min;4 ℃保温,退火温度见表1;对PCR 产物进行1%琼脂糖凝胶电泳检测。

表1 各基因引物序列
1.5 荧光定量PCR 检测不同动物组织中GLUD1 基因的表达
以“1.3” 项下反转录获得的cDNA 样品为模板,设置β-actin 为内参基因,进行荧光定量PCR(qRT-PCR)。荧光定量PCR 反应体系为20 μL,包括TB Green Premix Ex Taq Ⅱ10 μL,上、下游引物各0.8 μL,cDNA 模 板2 μL (共100 ng 以 上),ddH2O 6.4 μL; 反应条件为:95 ℃30 s,95 ℃5 s,60 ℃30 s,72 ℃1 min,40 个循环; 两步法试验结束后, 得到qRT-PCR 的扩增曲线和融解曲线,计算Ct 值,进行后续GLUD1 基因表达分析。 使用无重复双因素分析方法进行各组织GLUD1 基因表达量的差异分析。
1.6 不同物种GDH 蛋白的氨基酸序列比对分析
将下载得到的人、小鼠、大鼠、山羊、绵羊、牛和猪7 个物种GDH 蛋白的氨基酸序列使用python 脚本进行局部比对,将比对得到的.aln 文件导入ESPript 3.x(http://espript.ibcp.fr)工具进行全局比对, 得到比对文件进行后续氨基酸突变位点的筛选。
1.7 GDH 蛋白三维空间结构的预测
根据各物种的氨基酸序列, 使用SWISSMODEL 对蛋白的三维空间结构进行预测。
2 结果与分析
2.1 肝脏组织cDNA 样品中β-actin 和GLUD1基因的PCR 鉴定
经PCR 鉴定,大鼠、绵羊和梅花鹿肝脏组织中存在β-actin 和GLUD1 基因的表达,β-actin 和GLUD1 基因在大鼠、绵羊和梅花鹿肝脏样品中的扩 增 产 物 长 度 分 别 为76、115、167、274、157、129 bp(见图1)。
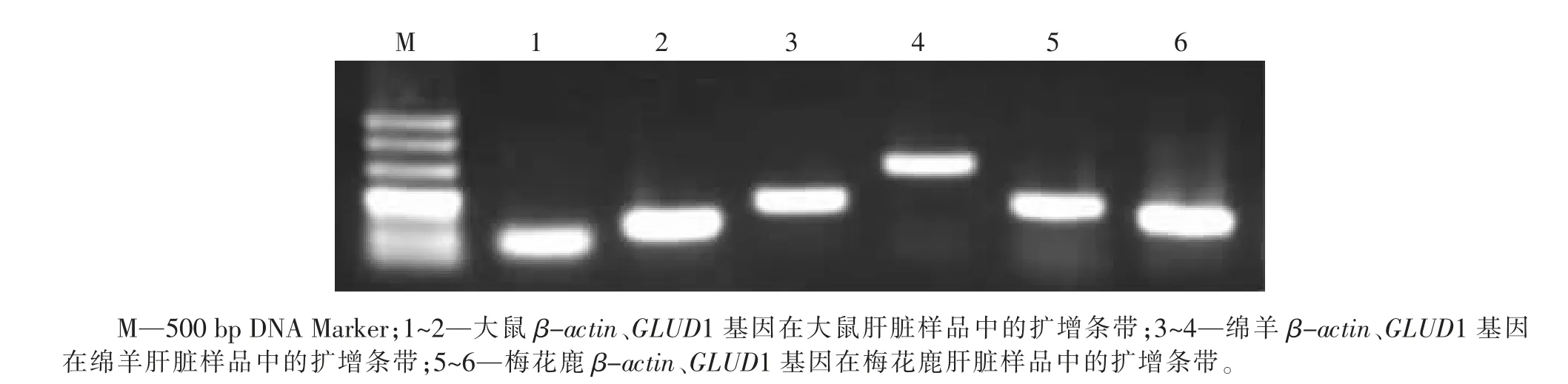
图1 β-actin和GLUD1 基因在大鼠、绵羊、梅花鹿的肝脏组织PCR 鉴定结果
2.2 不同动物组织样品中GLUD1 基因的表达量
经qRT-PCR 检测发现GLUD1 基因在大鼠、绵羊和梅花鹿的肝脏组织中的表达量高于在其他组织中的表达量;GLUD1 基因大鼠肾脏中的表达量也较高, 肌肉组织中该基因的表达水平低于在肝肾组织中的表达水平, 皮肤和脂肪组织中该基因的表达量较低;GLUD1 基因在绵羊和梅花鹿的肌肉组织中表达量较高, 仅次于在肝脏中的表达量,高于在肾脏中的表达量;绵羊和梅花鹿的脂肪组织中GLUD1 基因的表达水平低于肌肉组织中的表达水平,但高于在皮肤组织中的表达水平,而在大鼠组织中则相反(见图2)。
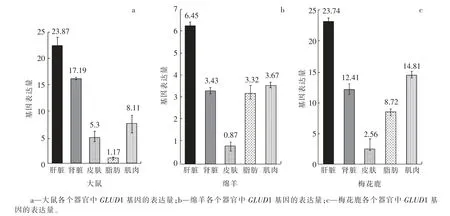
图2 GLUD1 基因在大鼠、绵羊和梅花鹿各个器官中的表达量
通过对比大鼠、 绵羊、 梅花鹿肝脏组织中GLUD1 基因的相对表达量发现该基因在大鼠和梅花鹿肝脏中的表达量极显著(P<0.01)高于在绵羊肝脏组织中的表达量, 而大鼠与梅花鹿肝脏组织中该基因的表达量差异不显著(P>0.05)。 通过比较发现GLUD1 基因在大鼠和绵羊肾脏组织中的表达量极显著(P<0.01)高于在梅花鹿肾脏组织中的表达量(见图3)。
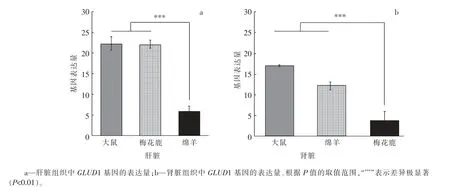
图3 不同动物相同组织样品中GLUD1 基因的表达量
2.3 7 个物种间GDH 蛋白的氨基酸序列比对与物种特异性突变位点的筛选
通过对人、小鼠、大鼠、山羊、绵羊、牛和猪7个物种GDH 蛋白的氨基酸序列进行比对,发现大鼠与小鼠GDH 蛋白的氨基酸序列高度相似,序列相似度达到99.10%, 人GDH 蛋白的氨基酸序列与猪、牛、山羊和绵羊的序列相似性较高;进一步分析发现在大鼠GDH 蛋白氨基酸序列中有2 个物种特异性突变位点, 分别为序列的第8 位和第40 位氨基酸, 且2 个位点的氨基酸都由丙氨酸(Ala)突变为缬氨酸(Val);在人GDH 蛋白氨基酸序列中有1 个物种特异性突变位点, 在序列的第23 位,该位点的氨基酸由丙氨酸(Ala)突变为丝氨酸(Ser);在猪GDH 蛋白氨基酸序列中有2 个物种特异性突变位点,为序列的第33 位和第39 位,2 个位点的氨基酸都由丙氨酸(Ala)突变为苏氨酸(Thr); 物种间GDH 蛋白的氨基酸序列比对结果见图4。
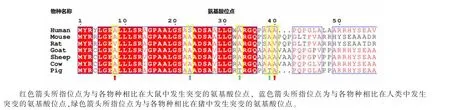
图4 7 个物种间GDH 蛋白的氨基酸序列比对图
2.4 不同物种间GDH 蛋白三维空间结构的预测
通过对7 个物种GDH 蛋白三维立体结构进行预测发现,小鼠、大鼠和人GDH 蛋白的结构相似,为三聚体结构;山羊、绵羊、牛和猪的GDH 蛋白的结构相似,为同源六聚体结构,与已报道的天然GDH[17]蛋白的结构一致(见图5)。

图5 7 个物种GDH 蛋白三维立体结构预测与比较
3 讨论
谷氨酸脱氢酶作为一种分布于肝脏、 心肌和肾细胞线粒体基质及内膜等部位的含锌线粒体酶,在肝脏组织中的活性最高,参与肝脏中多种氨基酸的代谢过程, 当肝细胞受损时分布于肝细胞线粒体内的GDH 浓度会明显升高,GLUD1 基因通过表达GDH 蛋白控制其产物α-酮戊二酸在细胞内的含量, 实现胞内能量产生和氧化还原反应的平衡[18-20]。 当GLUD1 基因的表达水平异常升高时会使机体细胞增殖异常,导致肿瘤发生,而干扰该基因的表达会使癌细胞增殖、 迁移和侵袭能力明显下降[21]。 若敲除该基因则可以显著抑制肿瘤细胞的增长[22],因此,GDH 蛋白也逐渐成为许多肿瘤治疗的靶点。 统计研究也发现,GLUD1 基因的序列变化会使GDH 蛋白调节域中氨基酸的替换,导致疾病的发生[23]。
不同动物的不同组织中GLUD1 基因的表达水平有所不同, 可能受动物个体所处的状态等因素的影响,但物种间同一组织、物种内不同组织间该基因的表达依旧具有一定规律, 根据以往的报道,GDH 蛋白在动物的肝脏中活性和表达水平较高,通过比较物种内不同组织间GLUD1 基因的表达量, 发现动物的肝脏组织中该基因的表达水平明显偏高, 而通过比较不同物种同一组织中该基因的表达情况, 发现各个物种之间该基因表达水平的差距较大, 揭示该基因在不同动物的相同组织中发挥功能的方式可能有所不同。 GDH 蛋白氨基酸序列的差异关乎该蛋白功能的发挥, 通过序列比较,发现物种间该蛋白的序列差异较大,从序列水平上看小鼠、大鼠的序列相似性较高,与其他物种的序列差异较大, 通过模拟蛋白质的功能发现人的GDH 蛋白氨基酸序列虽然与大鼠的序列差异较大, 但蛋白质的结构与大鼠的更相似,因此,猜测人的GDH 蛋白功能可能与大鼠体内该蛋白的功能更相似。通过筛选7 个物种GDH 蛋白氨基酸序列发现了数个在人、 大鼠和猪中发生的物种特异性突变位点, 有趣的是这些突变位点都集中在一定的序列范围内, 说明该区域的氨基酸可能较其他位置更容易发生突变, 这有待进一步进行验证。
4结论
该研究对大鼠、绵羊和梅花鹿3 个物种的5种组织样品通过qRT-PCR 检测GLUD1 基因在这些组织中的相对表达量,并比较了人、大鼠、小鼠、山羊、绵羊、牛和猪7 个物种GDH 蛋白的氨基酸序列和蛋白空间结构,结果发现,GLUD1 基因在不同动物不同组织中的表达量差异较大,该基因在大鼠、绵羊、梅花鹿肝脏中都有较高水平的表达,这可能与肝脏中GDH 蛋白的表达水平和活性密切相关。 不同物种中GDH 蛋白的氨基酸序列相似度较高, 但依旧存在一定的序列差异性, 同时存在数个对应物种特异性的氨基酸突变位点, 这些位点的差异可能会影响动物细胞功能。
