高孕激素促排卵与克罗米芬微刺激方案在卵巢低储备患者取卵周期的可控性比较
2021-08-26FANXingyan匡延平
FAN Xing-yan, 于 莎, 汪 云, 匡延平
上海交通大学医学院附属第九人民医院辅助生殖科,上海 200011
卵巢低储备(diminished ovarian reserve, DOR)表现为卵巢产生卵子的能力减弱,卵子数量和质量双重下降[1]。研究表明[2],约10%的育龄期妇女经历卵巢储备功能下降而寻求不孕症治疗。目前辅助生殖技术 (assisted reproductive technology,ART) 是DOR不孕症患者最有效的治疗方式。促排卵是ART治疗的首要步骤,但DOR患者在接受传统促排卵方案中,表现为对外源性促性腺激素 (gonadotropin, Gn) 刺激反应低下,周期取消率升高,获卵数、可用胚胎数减少及妊娠率低下[3-5]。因此,选择合适的促排卵方案是DOR患者接受ART治疗首要考虑的问题。
枸橼酸氯米芬 (clomiphene citrate, CC,克罗米芬)为雌激素受体拮抗剂,通过竞争结合下丘脑细胞内的雌激素受体,刺激促卵泡生成素 (follicle stimulating hormone,FSH) 和促黄体生成素 (luteinizing hormone, LH)的分泌,从而使卵巢内的卵泡生长、发育[6]。Teramoto等[7]的研究发现CC微刺激方案可以使年龄高达45岁的妇女在1个取卵周期至少获得1枚成熟卵子,提高了DOR患者的治疗效率。然而在DOR患者中使用CC微刺激方案促排卵常会引起早发LH峰的出现,导致提前排卵,降低促排卵效率[8]。
高孕激素促排卵方案 (progestin-primed ovarian stimulation, PPOS) 是基于全胚冷冻的治疗策略,利用孕激素(外源性或内源性)的负反馈机制阻止促排卵过程中早发LH峰的出现[9-13]。基于卵巢低反应患者的研究[14]发现,PPOS方案较自然周期能有效地抑制过早LH峰的发生及提前排卵,卵泡生长时间更长,且取卵前卵泡的直径更大,可控性增加;实验室结局显示PPOS方案组的获卵数和有效胚胎数较自然周期明显增多,但妊娠结局两组无差异。
因此,本研究进一步回顾性分析近10年我中心应用PPOS方案与CC微刺激方案治疗DOR患者的取卵周期结局及内分泌变化特点,以进一步证实PPOS方案在DOR患者促排卵周期中的可控性,为临床应用提供参考。
1 资料与方法
1.1 研究对象 回顾性分析2011年1月至2020年12月因DOR就诊于上海交通大学医学院附属第九人民医院,接受体外受精-胚胎移植 (invitrofertilization-embryo transfer, IVF-ET) 治疗的不孕症患者。
纳入标准[14]:符合不孕症诊断标准,即夫妻双方正常性生活,未避孕1年未孕;年龄25~45岁;双侧卵巢的基础窦卵泡数(antral follicle count,AFC)少于 5枚;基础FSH 10~30 U/L; 抗苗勒管激素 (anti-Müllerian hormone, AMH) < 1.1 ng/mL;规律自发的月经周期21~35 d。排除标准:月经第3天的雌激素(estrogen,E2)>70 pg/mL;染色体异常,生殖器官畸形和生殖系统肿瘤;患有其他全身性的急慢性疾病。
1.2 促排卵方案 PPOS方案:从月经第3天起口服醋酸甲羟孕酮(medroxyprogesterone acetate, MPA, 浙江仙琚制药,2 mg/粒)10 mg,或MPA 10 mg+乙炔雌二醇(ethinyl estradiol,EE,信宜制药,12.5 μg/粒)12.5~25 μg。用药5~7 d后复诊,当卵泡开始生长,同时伴随E2的上升,且FSH<8.0 U/L时,给予小剂量人尿促性素(human menopausal gonadotropin, hMG;上海丽珠制药有限公司,75 U/支) 75~150 U促进卵泡发育。之后每隔2~4 d进行1次经阴道超声检查以记录发育卵泡大小及数量,并同时测定血清FSH、LH、E2及孕激素(progesterone, P) 浓度,根据卵巢反应情况调整hMG用量。当主卵泡直径≥18 mm时,同时停用MPA和hMG,注射人绒毛膜促性腺激素(human chorionic gonadotropin,hCG,丽珠医药)1 000 U和短效促性腺激素释放激素激动剂(gonadotropin-releasing hormone agonist,GnRH-a,达必佳,德国辉凌)0.1 mg共同诱发排卵。
CC微刺激促排卵方案:从月经第3天起口服CC(塞浦路斯高特制药,50 mg/粒) 50 mg/d; 3~5 d后复诊,进行经阴道超声检查以记录发育卵泡大小及数量,并同时测定血清FSH、LH、E2、P的浓度。若有1个卵泡的直径大于13 mm,或血清LH较基础值升高1倍以上时,加注促性腺激素释放激素拮抗剂(gonadotropin-releasing hormone antagonist,GnRH-anti,思则凯,默克雪兰诺; 0.25 mg/支) 0.125~0.25 mg。根据卵巢反应情况决定是否需要注射hMG (75~150 U) 隔日1次。当主卵泡直径≥18 mm时,注射GnRH-a 0.1 mg诱发排卵。
1.3 取卵及胚胎评估 常规在诱发排卵后34~36 h经阴道穿刺取卵。有早发LH峰的出现(LH>20 U/L)时,则于出峰后18~30 h取卵[14]。取卵后
按常规进行IVF或卵泡浆内单精子注射(ICSI),胚胎评级按本中心标准评估。
根据胚胎原核评分、发育速度及形态学等参数,卵裂球的大小、形态、数目、胞质情况、碎片的比例进行质量评分,分为4级[15]。Ⅰ级:胚胎卵裂球大小均匀,形态规则且胞质均匀清晰,碎片无或少于10%;Ⅱ级:胚胎卵裂球不等,且形态欠规则, 碎片10%~25%;Ⅲ级:胚胎卵裂球大小不均等,碎片25%~50%;Ⅳ级:胚胎卵裂球大小严重不均,碎片大于50%。Ⅰ级和Ⅱ级胚胎定义为优质胚胎。对优质胚胎进行玻璃化冷冻保存,剩余未达到优质胚胎标准的胚胎予以继续培养,至囊胚形成后冷冻。
1.4 观察及评价指标 主要观察指标为早发LH峰比例,次要观察指标包括获卵数(率)、成熟卵数(率)、受精卵数(率)、卵裂数、优质胚胎数、有效胚胎数、促排卵过程中的Gn 用量及用药时间和激素水平变化等。
1.5 统计学处理 采用RStudio (version 1.3.1093) 建立倾向评分匹配(propensity score matching, PSM)模型,平衡两组基线特征的差异。选择11个协变量通过logistic回归来估计倾向评分,包括年龄、不孕年限、既往移植失败次数、既往无可用胚胎周期次数、体质量指数(body mass index, BMI)及AFC、AMH、FSH、LH、E2、P的基础水平。两组患者采用最近邻随机匹配算法,比例为1∶1。
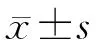
2 结 果
2.1 两组患者的一般资料 共纳入1 827例DOR不孕症患者,匹配后共972例患者,每组486例。结果(表1)表明:两组患者的年龄、不孕年限、既往移植失败周期及无可用胚胎周期次数、BMI、AMH、AFC以及基础激素水平差异均无统计学意义。
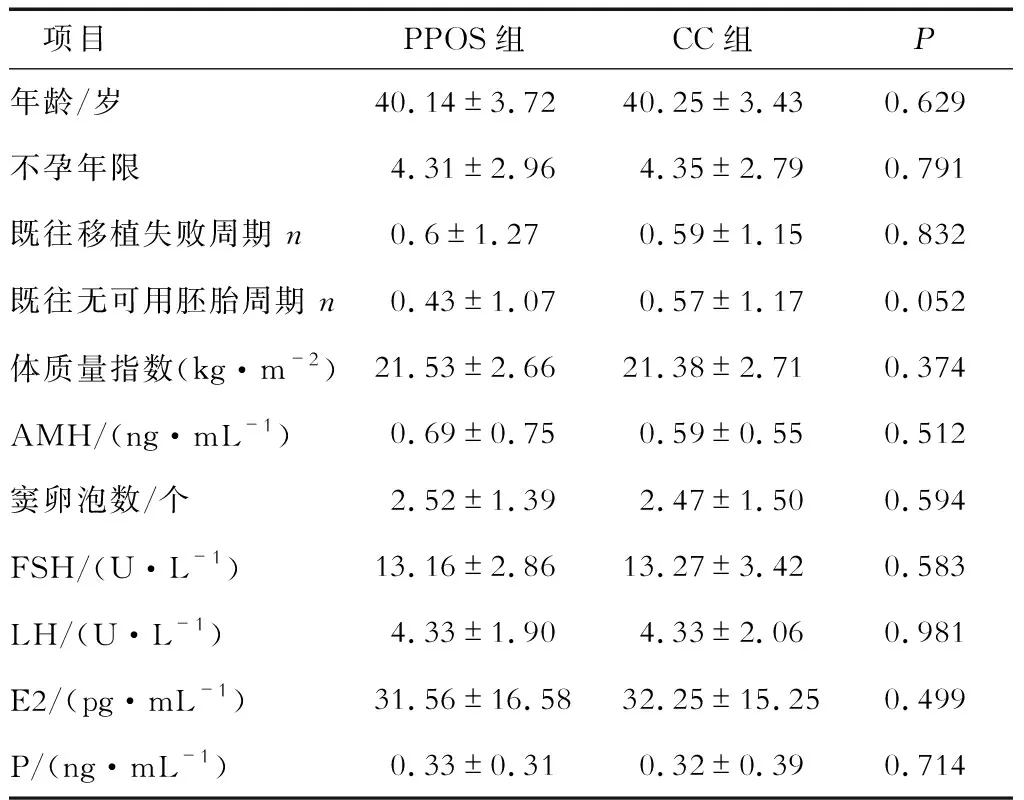
表1 两组患者基线资料的对比 N=486
2.2 两组患者促排卵结局 结果(表2)表明:治疗周期结束后,PPOS组的hMG应用天数及剂量明显多于CC组,差异均有统计学意义 (P<0.001)。但CC组中早发LH峰比例(39.92%)显著高于PPOS组(6.17%),差异有统计学意义 (P<0.001),且其诱发排卵至取卵时间较PPOS组明显缩短P<0.001)。

表2 两组患者匹配后促排卵结局对比 N=486
2.3 两组患者促排卵周期中内分泌激素水平的动态变化 结果(图1)表明:PPOS组与CC组患者基础FSH均高于10 U/L[(13.16±2.86) U/Lvs(13.27±3.42) U/L]。促排卵过程中,PPOS组FSH (D3: 13.16 U/L; D 5~6: 11.94 U/L; D8~9: 11.77 U/L)和LH[D3: (4.33±1.90) U/L;D5~6: (5.12±2.76) U/L;D8~9: (4.79±9.07) U/L]水平呈现平稳状态。而在CC组中,随着促排卵时间的延长,FSH和LH均呈明显升高趋势,特别是LH水平,在促排卵后期较基础水平明显升高(38.01 U/Lvs4.33 U/L,P<0.001)。与FSH和LH相应,CC组患者E2及P水平也较PPOS组偏高(P<0.001)。
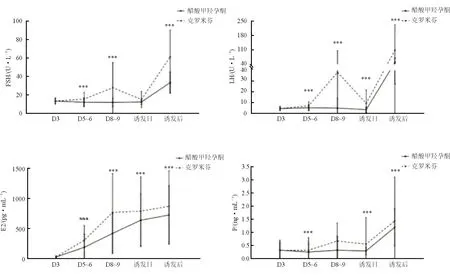
图1 促排卵过程中各时间点激素变化***P<0.001
2.4 两组患者的胚胎实验室结局 结果(表3)表明:两组患者获卵数(率)、成熟卵数、正常受精卵数(率)、卵裂数、有效胚胎数及卵子利用率差异均无统计学意义。但PPOS方案组患者成熟卵率明显高于CC组(0.87±0.29vs0.78±0.35,P<0.001),可能与PPOS方案相对容易控制取卵时间相关。
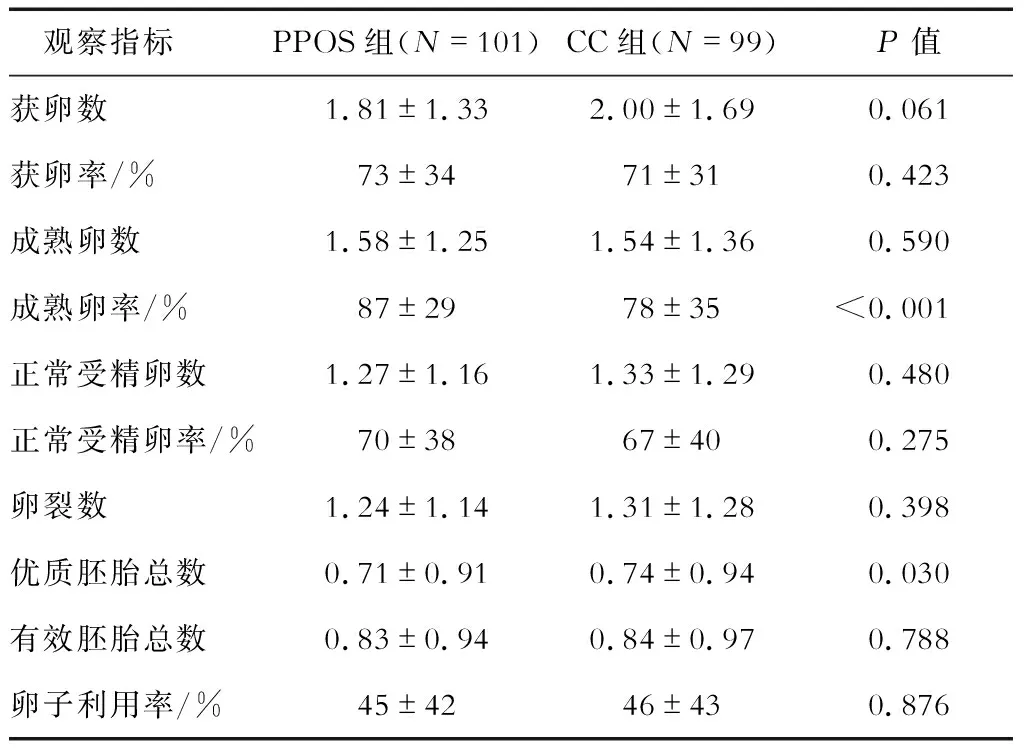
表3 两组患者胚胎实验室结局
3 讨 论
本研究回顾性分析了PPOS方案与CC微刺激方案在DOR患者接受IVF-ET治疗中的取卵周期结局。DOR患者的卵泡池中原始卵泡及对FSH敏感的卵泡已明显减少,生殖激素显示早卵泡期的FSH水平较高,振幅过大,LH持续时间延长,E2和P水平下降,与绝经过渡期描述的情况相似[16-17]。前期研究[14]显示,卵巢低反应患者易出现早发LH峰,而采用P后,此现象可以得到有效控制。本研究显示PPOS方案在用药初期,LH呈轻度上升趋势[D3: (4.33±1.90) U/L;D5~6: (5.12±2.76) U/L],这与p作用时间尚短,其负反馈作用尚未完全发挥相关。随着P使用时间的延长,其负反馈作用逐渐发挥,LH水平降低(P<0.001)。而在促排卵后期,CC组患者LH水平则较基础水平明显升高。在对早发LH峰的统计中发现,PPOS组中有30例患者出现早发LH峰,而CC微刺激组中则有194例患者出现了早发LH峰 (6.17%vs39.92%,P<0.001)。因此,PPOS方案中诱发排卵至取卵时间较CC组相对容易控制,且其更容易获得相对高的成熟卵率。这些结果提示DOR患者在促排卵过程中使用PPOS方案能有效抑制早发LH峰的出现。
临床实践发现,很多DOR患者在采用了CC微刺激方案后,由于过高的FSH水平和无卵泡发育,导致中途取消周期。而在PPOS方案中,P与位于下丘脑的P受体相结合,使GnRH的释放频率减慢,在发挥抑制早发LH峰发生的同时,也可在卵泡早期有效降低DOR患者过高的FSH水平。当FSH降至正常范围,E2慢慢上升,且卵巢有与之相匹配的基础卵泡时,采用外源性Gn来发挥促排卵作用。由于DOR患者对大剂量Gn反应欠佳,因此本研究选择小剂量hMG (75~150 U/d) 进行促排卵。本研究显示,DOR患者在接受PPOS治疗时,Gn的平均用量及时间明显大或长于CC组(P<0.001)。这可能与CC本身具有促排卵作用,无需外源性Gn的添加相关。实验室结局显示两组患者在获卵数(率)、 成熟卵数、正常受精卵数、卵裂数及有效胚胎数与CC组差异均无统计学意义。
综上所述,本研究结果显示PPOS方案可以有效抑制DOR患者促排卵过程中早发LH峰的发生,实验室结果显示该方案可获得与CC微刺激方案相似的卵子和可用胚胎。结果说明PPOS是一种适合DOR患者的促排卵方案,为DOR患者的临床用药提供了更多选择。今后将进一步回顾性分析两种方案所获得的胚胎移植后结局,并设计前瞻性多中心随机对照研究,进一步确定PPOS方案的临床有效性。
利益冲突:所有作者声明不存在利益冲突。
