沂水食用百合组培快繁体系的构建
2021-08-26胡彬杰白瑞琴尹晶晶王红彬胡月军
胡彬杰,白瑞琴,尹晶晶,王红彬,胡月军
(1.内蒙古农业大学园艺与植物保护学院,内蒙古呼和浩特 010011;2.呼和浩特市新城区科学技术局,内蒙古呼和浩特 010050;3.赤峰市林西县农牧局蔬菜站,内蒙古林西 025250)
百合是集观赏、食用、药用价值于一身的重要经济作物,以清新脱俗、雅致、纯洁深受人们的喜爱,是国际花卉市场的主流产品[1]。食用百合产业是我国重要的地方性特色农业产业,在增加农民收入、丰富农产品市场等方面发挥着重要作用。近年来,沂水食用百合是最受欢迎的百合品种之一。沂水食用百合花色艳丽,口感清甜,耐阴、抗冻、抗旱,适应性强,功能性强,在食用、保健、观赏、园林绿化方面均有发展[2-3]。
目前,百合的研究主要集中在观赏百合上,且大多是围绕观赏用百合的花香、花型、花期、花色、切花寿命、抗性和株型等方面进行。目前对食用百合的研究主要集中在脱毒防病、组织培养、病害防治等栽培养护技术方面[4]。
在离体培养条件下,百合可利用多种组织和器官繁殖。一般来说,鳞片是百合再生过程中最常见的外植体类型。选择鳞片最佳分化部位是组织培养能否成功的关键。激素在百合植物组织培养过程中起着至关重要的作用。食用百合对激素的需要量取决于其自身内源激素的水平,而这一水平随植物种类、组织部位等条件的不同而不同[5]。百合植物组织培养过程中较常用的植物生长调节剂有生长素、细胞分裂素、赤霉素、乙烯、脱落酸等[6],在食用百合组织培养的不同阶段,添加适当浓度的生长素和细胞分裂素,对其增殖分化和生根具有一定的促进作用。
本试验以沂水食用百合为试验材料,进行了组培快繁试验,旨在研究食用百合外植体的选择及植物生长调节剂在不定芽诱导、增殖培养和生根培养过程中的影响,建立沂水食用百合离体快繁技术体系,为获得大量优质百合种球及其在内蒙古地区扩大试种和产业化、规模化生产提供技术支持。本试验填补了内蒙古食用百合研究空白,为下一步食用百合产业的发展提供了理论基础。
1 材料和方法
1.1 材料
以内蒙古农业大学引种驯化的沂水食用百合N6 为试验材料,选取生长健壮、表面光滑、无病虫害且直径在5~8 cm 的种球鳞片作为外植体。
1.2 方法
1.2.1 培养基的配置 试验所用培养基为MS 培养基,添加7 g/L 琼脂粉,pH 值调至5.8~6.0。根据需要添加植物生长调节剂(NAA、6-BA、IBA)、蔗糖等,培养条件为(25±2)℃,光照强度为3 000 lx,光照16 h/d 以上。
1.2.2 外植体不同部位芽诱导试验 将种球用自来水流水冲洗2 h 后转移到超净工作台上,并先用75%酒精消毒30 s,再用2.5%次氯酸钠灭菌7 min,并用无菌水洗涤3 次后,将食用百合鳞茎剥去最外层鳞片,将剩余鳞片分为内、中、外层,每个鳞片再分上、中、下3 个部位进行试验。在操作台上沿鳞片周围切去1 mm,随后横切为0.5 cm×0.5 cm 的方块。将鳞片薄层平铺于诱导培养基中,用镊子按住外植体,使一半厚度的外植体插入MS 培养基,每瓶接种3 个外植体,每处理10 瓶。30 d 后统计污染个数并计算污染率和诱导率。

1.2.3 不定芽的诱导 试验采用二因素三水平试验设计,将消毒后的鳞片分别接种到含有不同浓度6-BA(0.5、1.0、2.0 mg/L)和NAA(0.1、0.5、1.0 mg/L)的培养基中,以不加任何激素的MS 培养基为对照,共9 个处理,每处理10 瓶,每瓶接种3 个外植体。30 d 后统计诱导率和生长状况。

1.2.4 不定芽的增殖 试验采用二因素三水平试验设计,取生长旺盛的无菌苗,将叶片较宽厚的部分切成长1 cm 左右的小段接种到含有不同浓度6-BA(0.5、1.0、1.5 mg/L)和NAA(0.1、0.2、0.3 mg/L)的培养基中,以不加任何激素的MS 培养基为对照,共9 个处理,每处理10 瓶,每瓶接种3 个外植体。观察植株长势,30 d 后统计增殖系数。

1.2.5 不定芽的生根 试验采用二因素三水平试验设计,选取长至2.00 cm 以上、尚未生根的健壮组培苗分别接种到含有不同浓度NAA(0.10、0.50、1.00 mg/L)、IBA(0.10、0.20、0.30 mg/L)的MS 培养基中,每处理10 个瓶,每瓶接3 个。观察生根情况,30 d后统计生根率、平均生根数、根长度。

1.2.6 炼苗、移栽 将生根后的组培苗进行炼苗、移栽:先打开三角瓶口,3 d 后取出并洗净附着在根部的培养基,然后分别移栽到装有国产草炭土、进口基质、水苔和草炭土+水苔的花盆中,放于通风良好的环境,适当遮阴。30 d 后统计成活率、株高及长势情况。
1.2.7 统计分析 试验数据采用Microsoft Excel 2000 软件进行基本处理,采用SPSS 25.0 软件对试验整理数据进行方差分析、多重比较。数据的表示形式为平均值±标准差。
2 结果与分析
2.1 外植体的选择
由表1 可知,百合鳞片外层污染率较高,且与内层、中层存在显著差异(P<0.05),诱导率较低;内层诱导率高,污染率相对较低。同层次鳞片上部污染率高,诱导率偏低;中部污染率相对较低,诱导率最高。可见,最佳外植体部位为鳞茎的内层中部鳞片(图1)。

表1 外植体污染率和诱导率

图1 沂水食用百合鳞茎不同层次中部鳞片诱导情况
2.2 植物生长调节剂对不定芽诱导的影响
由表2 可知,不同处理对沂水食用百合不定芽的诱导率影响不同,处理8 与处理9 差异不显著(P>0.05),与其他处理差异显著(P<0.05)。处理9(1.0 mg/L NAA+1.0 mg/L 6-BA+MS)的诱导率最高,为96.67%,植株长势较好,叶绿、苗健壮。可见,沂水食用百合最佳不定芽诱导培养基为1.0 mg/L NAA+1.0 mg/L 6-BA+MS(图2)。

图2 处理9 与CK 的不定芽诱导对比
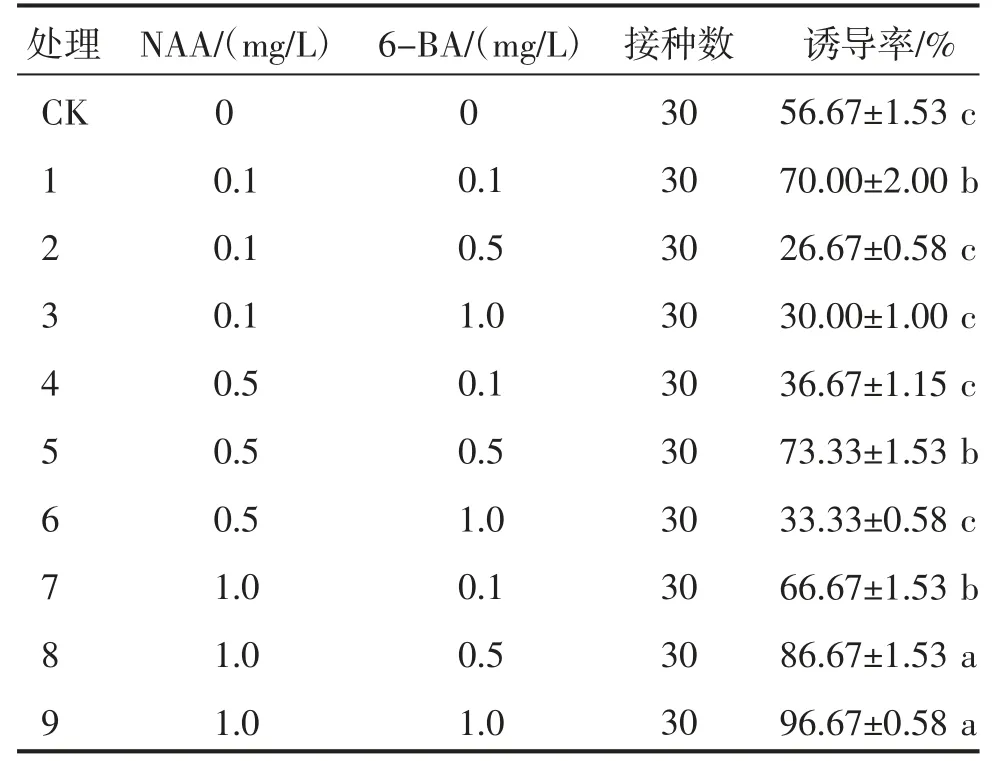
表2 不同处理沂水食用百合不定芽诱导率
2.3 植物生长调节剂对不定芽增殖的影响
由表3 可知,不同处理对沂水食用百合的增殖系数影响较大,处理1 与处理9 差异不显著(P>0.05),与其他处理差异显著(P<0.05)。处理1(0.1 mg/L NAA+0.5 mg/L 6-BA+MS)的增殖系数最高,为3.67,其不定芽成簇生长,苗健壮,植株长势最佳;CK 和处理7(0.3 mg/L NAA+0.5 mg/L 6-BA+MS)增殖系数较低,长势较差,叶浅绿且较细。可见,沂水百合最佳增殖培养基为0.1 mg/L NAA+0.5 mg/L 6-BA+MS(图3)。

图3 不同处理对沂水食用百合不定芽增殖的影响

表3 不同处理对沂水食用百合不定芽增殖的影响
2.4 植物生长调节剂对不定芽生根的影响
由表4 可知,不同处理对沂水食用百合的不定芽生根影响较大,处理5 与处理6 的根数、根长、生根率差异不显著(P>0.05),与其他处理差异显著(P<0.05)。处理6(0.5 mg/L NAA+0.3 mg/L IBA+MS)的生根率最高,为93.33%;根数最多,为14 条;根长最长,为3.67 cm。可见,沂水食用百合最佳生根培养基为0.5 mg/L NAA+0.3 mg/L IBA+MS(图4)。

图4 CK 与处理6 的不定芽生根对比

表4 不同处理对沂水食用百合不定芽生根的影响
2.5 不同基质对移栽苗成活率的影响
由表5 可知,处理4 的成活率最高,为90%;株高高于其他处理,为7.75 cm。可见,沂水食用百合最佳移栽基质为国产草炭土+水苔。
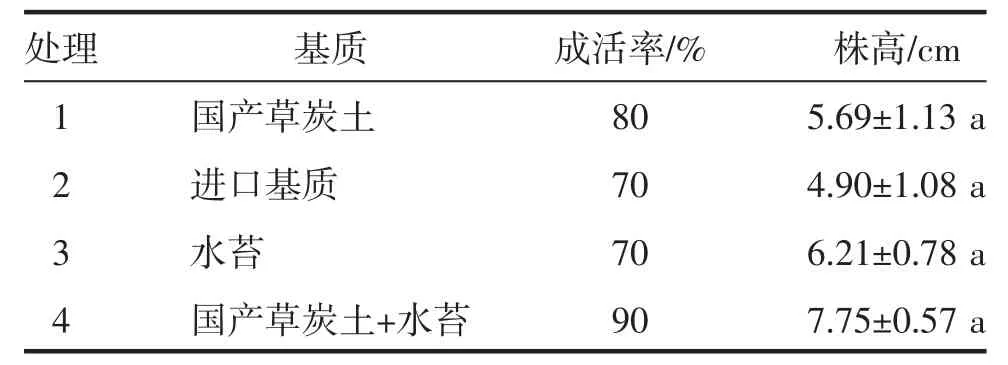
表5 不同基质对移栽苗成活率的影响
3 结论与讨论
试验以沂水食用百合鳞片为外植体诱导不定芽,目的是筛选出最佳百合鳞茎部位和层次。不同鳞片部位依次为内层>中层>外层,中部>下部>上部。不同百合外植体取材部位的不同,其诱导能力不同。分析原因可能是内源激素的含量不同,其促进和抑制鳞片生长的作用不同[7]。该结果与王雅楠[8]对新疆百合鳞片研究结果相同,与郑鑫[9]对亚洲百合鳞片研究结果不同,其原因可能与不同百合品种差异有关。
在不定芽诱导的试验中,以NAA/6-BA 组合诱导消毒后的鳞片,通过直接再生途径生成不定芽,表明高浓度的6-BA 和NAA 诱导不定芽效果最好,而对照组诱导率较低,植株长势弱,该结果与张旭红[10]和柳玉晶等[11]研究不符(1.0 mg/L NAA+0.1 mg/L 6-BA+MS)。张旭红[10]研究发现,低浓度6-BA 会促进不定芽的诱导而高浓度会抑制,与王雅楠[8]研究新疆百合鳞片相符,其结果是0.5 mg/L NAA+1.0 mg/L 6-BA+MS 为最佳不定芽诱导培养基,与本试验结果相似。在不定芽增殖试验中,以NAA/6-BA 组合诱导无菌苗叶片通过直接再生途径生成不定芽,结果表明,低浓度NAA 和适中浓度的6-BA 对不定芽增殖效果最好,该结论与王雅楠[8]结果相近(0.05 mg/L NAA+0.5 mg/L 6-BA+MS)。杨子贤等[12]研究发现,在MS+1.00 mg/L 6-BA+0.50 mg/L NAA 的培养基中香水百合和东方百合有较好的增殖效果。分析原因为两种激素存在交互作用,对植株长势和增殖分化起重要作用。在激素诱导不定芽生根试验中,适中浓度的NAA 与较高浓度的IBA 有利于百合生根。张旭红[10]研究得出,卷丹百合和欧洲百合不定芽在培养基MS+0.1 mg/L NAA+6%蔗糖的生根培养中生根率均达100%,总体生根状况良好。虞泓等[13]研究表明,大百合在生根培养基MS+2.0 mg/L 6-BA+0.5 mg/L NAA+3%蔗糖上经过30 d,接种的5 cm 芽条生根率在95%以上。王雅楠[8]对新疆百合试管苗进行生根培养得到最适生根培养基为1/2 MS+0.20 mg/L NAA+0.20 mg/L IBA,生根率达100%。在本试验中,草炭土∶水苔为1∶3 移栽成活率最高。王雅楠[8]在对新疆百合试管苗进行炼苗移栽试验中发现,草炭∶珍珠岩∶蛭石为1∶2∶1 的混合基质更有利于新疆百合试管苗移栽后生长,成活率达71.12%。而孙冬青[14]在对亚洲百合“精粹”试管苗的驯化移栽中发现,珍珠岩∶泥炭土为1∶3 的混合基质移栽效果最好,成活率为98%。杨薇红等[15]以亚洲百合品种“Asiatic hybrid”为试验材料,发现珍珠岩∶蛭石∶腐殖土为1∶1∶1 的基质移栽成活率最高。本试验与前人研究结果不同,可能是品种间存在差异及栽植环境不同导致的。
