脯氨酰寡肽酶抑制剂S17092 对脂质超载人肝细胞株LO2脂质沉积的改善作用及其机制
2021-08-25舍玲丁永年纪文静阿孜古力阿不来提
舍玲,丁永年,纪文静,阿孜古力·阿不来提
新疆医科大学第二附属医院消化科,乌鲁木齐830011
非酒精性脂肪肝病(NAFLD)是一种由遗传-环境-代谢应激相关因素所致的以肝细胞内脂肪堆积为主要表现的临床病理综合征[1]。NAFLD的发病机理尚不清楚,但已知脂质的合成和代谢在其发病中起着重要作用[2]。在肝脏中,固醇调节元件结合蛋白-1c(SREBP-1c)是脂质代谢的关键调控者,可调控与脂肪酸(FFA)、甘油三酯(TG)合成相关的靶基因,如硬脂酰辅酶A 去饱和酶(SCD1)、脂肪酸合成酶(FAS)、乙酰辅酶A 羧化酶1(ACC1)等,激活脂质合成的转录过程[3]。脯氨酰寡肽酶(POP)是一种可以裂解短肽中脯氨酸残基羧基端肽键的丝氨酸蛋白酶,参与多肽的成熟和降解,可调控炎症因子、细胞增殖、分化、凋亡等[4-6]。研究[7-8]发现,在单纯脂肪变细胞及NAFLD 动物模型中POP 表达增高,提示POP在NAFLD 进展中起重要作用,但具体调节机制尚待进一步研究。2019年11月1日—2020年12月1日,本研究观察了POP 抑制剂S17092 对脂质超载人肝细胞株LO2 脂质沉积的改善作用,并探讨其作用机制。
1 材料与方法
1.1 细胞、试剂 人肝细胞株LO2购自购自中国科学院细胞库。POP 抑制剂S17092 购自上海源叶生物科技有限公司,RPMI 1640 培养液购自Hyclone 公司,胎牛血清购自杭州四季青生物有限公司,棕榈酸钠(P9767)、油酸钠(O7501)、油红O 试剂盒购自Sig⁃ma-Aldrich 公司,GAPDH 抗体购自美国Santa Cruz公司,POP 抗体购自Abcam 公司,蛋白提取试剂盒、蛋白检测试剂盒购自凯基生物公司,甘油三酯试剂盒购自中生北控生物技术有限公司,SDS-PAGE 凝胶制备试剂盒及组织细胞RNA 微量提取试剂盒购自索莱宝公司,SYBR Green 荧光实时定量PCR 试剂盒购自Life Technologies,RT-PCR 试剂盒购自TaKa⁃Ra 公 司,AcSDKP ELISA 试 剂 盒 购 自SPI Bio and CEA公司,PCR引物由生工生物工程公司合成。
1.2 脂质超载模型制备、分组及POP 抑制剂给予方法 参照文献[9]方法,将LO2 细胞在含10%胎牛血清的1640 培养基中培养,每2~3 d 更换一次培养基,待细胞处于良好生长状态且长至80%汇合时,将配置好的油酸和棕榈酸(2∶1)的混合物按1 mmol/L加入培养液中,继续培养24 h,建立脂质超载模型。综合前期试验结果及相关文献[8],本研究选择10µg/mL S17092 处理细胞。将LO2 细胞随机分为3 组,对照组LO2 细胞用1%无FFA 的1640 培养基培养,模型组LO2 细胞制备脂质超载模型后再用1640 培养基培养,实验组LO2 细胞制备脂质超载模型后再加入含S17092 的1640 培养液培养。各组细胞继续培养24 h,用于后续实验。
1.3 各组细胞内脂质沉积观察 采用油红O 染色法。将三组细胞用PBS 洗涤3 次并用4%多聚甲醛固定15 min,然后再用PBS 冲洗3 次,加入丙二醇试剂,室温下脱水5 min,然后用新鲜稀释的油红O 溶液染色10 min,将细胞用60%异丙醇洗涤两次,每次1 min,用水冲洗,并用苏木精复染30 s,用PBS 洗涤后,显微镜下观察细胞内脂质沉积情况。
1.4 各组细胞内TG 检测 采用Bio-Rad 蛋白质测定法。取三组细胞,PBS洗涤两次后,用0.25%胰酶消化,添加100µL 细胞裂解缓冲液孵育10 min 后离心5 min,收集上清液,按照TG 测定试剂盒说明书要求检测细胞内TG。实验重复3次,取平均值。
1.5 各 组 细 胞 内POP、SREBP-1c、FAS、ACC1、SCD1 mRNA 检测 采用实时荧光定量PCR 法。取三组细胞,提取RNA 后反转录合成cDNA,以cDNA为模板,以GAPDH 为内参,配置20 µL 的PCR 反应液,于实时荧光定量PCR 仪上进行PCR 反应。PCR反应条件:50 ℃2 min、95 ℃2 min 预变性,95 ℃15 s、60 ℃15 s、72 ℃1 min,40个循环。引物序列如下:POP 正 向 引 物 为5′-CATCTCCCAAGAGGCT⁃GACTA-3′,反向引物为5′-GGGCAATAACACAAC⁃CAAAGA-3′;SREBP-1c 正 向 引 物 为 5′-GA⁃CAGCCCAGTCTTTGAGGA-3′,反向引物为5′-CAG⁃GACAGGCAGAGGAAGAC-3′;FAS 正向引物为5′-TTCCGAGATTCCATCCTACG-3′,反 向 引 物 为5′-AGGCTCACAAACGAATGGAC-3′;ACC1 正向引物为5′-TCACACCTGAAGACCTTAAAGCC-3′,反向引物 为5′-AGCCCACACTGCTTGTACTG-3′;SCD1 正向引物为5′-TTCCTACCTGCAAGTTCTACACC-3′,反 向 引 物 为5′-CCGAGCTTTGTAAGAGCGGT-3′;GAPDH 正 向 引 物 为 5′-GAAGGTGAAGGTCG⁃GAGTC-3′,反 向 引 物 为5′-GAAGATGGTGAT⁃GGGATTTC-3′。以2-ΔΔCt法表示细胞中目的mRNA的相对表达量。
1.6 统计学方法 采用SPSS21.0 统计软件。计量资料以±s表示,多组间比较用单因素方差分析,两两比较用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组细胞内脂质沉积情况比较 油红O 染色结果显示,与对照组相比,模型组LO2细胞内含有大量的红染颗粒,而实验组较模型组红染颗粒相对较少,见图1。
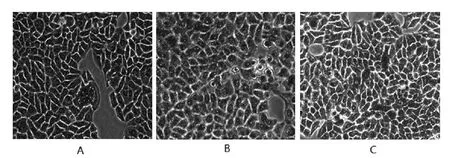
图1 显微镜下观察油红O染色的LO2细胞(×200)
2.2 各组细胞内TG 水平比较 对照组细胞内TG水平为(1.995 ± 0.221)pmole/µL,模型组细胞内TG 水平为(2.910 ± 0.030)pmole/µL,实验组细胞内TG 水平为(2.573±0.113)pmole/µL,组间相比,P均<0.05。
2.3 各 组 细 胞 内POP、SREBP-1c、FAS、ACC1、SCD1 mRNA 相对表达量比较 各组细胞内POP、SREBP-1c、FAS、ACC1、SCD1 mRNA 相对表达量比较见表1。由表1 可知,与对照组相比,模型组、实验 组 细 胞 中POP、SREBP-1c、FAS、ACC1、SCD 1 mRNA 相对表达量明显升高(P均<0.05);与模型组 相 比,实 验 组 细 胞 中POP、SREBP-1c、FAS、ACC1、SCD1 mRNA 相对表达量明显降低(P均<0.05)。
表1 各组细胞内POP、SREBP-1c、FAS、ACC1、SCD1 mRNA相对表达量比较(±s)

表1 各组细胞内POP、SREBP-1c、FAS、ACC1、SCD1 mRNA相对表达量比较(±s)
注:与对照组相比,*P<0.05;与模型组相比,#P<0.05。
组别实验组模型组对照组POP mRNA 1.369±0.0819*#1.595±0.040*1.060±0.021 SREBP1c mRNA 1.381±0.083*#2.626±0.066*1.043±0.032 FAS mRNA 1.639±0.113*#2.955±0.095*1.051±0.019 ACC1 mRNA 1.376±0.045*#1.821±0.066*1.062±0.036 SCD1 mRNA 1.311±0.019*#1.869±0.109*1.073±0.014
3 讨论
近年来,随着肥胖等代谢性疾病的增加,NAFLD的发病率明显增高。研究[11]发现,NAFLD是终末期肝病和肝癌的重要病因,即使是肝脏轻度脂肪变性,也会增加71%的死亡风险,而高循环FFA浓度可通过破坏NAFLD 患者的脂质代谢而加重肝脏脂肪的积累[12],因此研究FFA 如何影响代谢调节将进一步增进我们对NAFLD 发病机制的了解。本研究的目的是在FFA 诱导的脂质超载细胞模型中研究POP抑制剂对NAFLD 的影响,这可能有助于阐明与疾病进展有关的机制。在正常人和NAFLD 患者中,棕榈酸和油酸都是肝甘油三酯中最丰富的FFA。根据GOMEZ-LECHON 等的报告,载有含油酸/棕榈酸(比例为2∶1)的FFA(1 mmol/L)混合物的肝细胞模拟了人类的肝脏慢性脂肪变性[9]。因此,我们通过将LO2 细胞与1 mmol/L FFA 一起孵育,建立了细胞脂肪变性的脂质超载模型,油红O 染色显微观察可见细胞内脂质液泡中大量脂质沉积证实了建模成功。
目前研究[13-14]发现,POP 与糖尿病、多发性硬化、肝硬化、抑郁症、神经退行性疾病和癌症相关,在肝脏中发现POP 可促进肝脏的再生和修复。此外有研究[13]表明,POP 可作为肝硬化严重程度的评估指标。而ZHANG 等[7-8]研究发现,在高脂饮食诱导的NAFLD模型中POP表达上调,抑制POP可降低肝脂肪变性的严重性和炎症反应,而抑制POP 对肝脏炎症的保护作用与基质金属蛋白酶(MMPs)和脯氨酸-甘氨酸-脯氨酸(PGP)的产生受抑制以及嗜中性粒细胞浸润的抑制有关。而另一项细胞实验[15]表明,POP 过表达可导致Smad7 蛋白和PPAR-γ 上调,减弱大鼠肝星状细胞的活化,进而延缓肝纤维化。目前POP 在肝脏脂肪变性过程中的机制尚未阐明。一般认为,脂肪肝是由肝脏摄取FFA、TG 合成和排泄之间的不平衡引起的,与脂质代谢相关基因失调密切相关。本研究发现,与对照组相比,模型组POP mRNA 相对表达量更高,而实验组则表现出细胞脂肪变性减轻。SREBP-1c 是调节肝脏新生脂肪形成的最重要转录因子,可以通过调节内源性TG、胆固醇、FFA 等合成所需的酶的表达来维持脂质的动态平衡。SREBP-1c 及其靶基因的异常可引起胰岛素抵抗、糖尿病、心脏功能障碍、血管并发症和肝脂肪变性等一系列代谢性疾病。研究[16]发现,NAFLD 患者肝脏内的SREBP-1c 含量明显升高,表明SREBP-1c在NAFLD 发生进展中起重要作用。本研究中,FFA 刺激下的L02 细胞中SREBP-1c 基因表达显著上升,其调控的靶基因FAS、ACC1、SCD1 的表达同步上调,细胞内TG 含量亦增加,并伴有肝细胞内大量脂滴生成,表明SREBP-1c基因表达的上调启动了相关脂质生成的级联过程,促进NAFLD 的发生及进展。而与模型组比较,实验组肝LO2 细胞抑制POP 后,内源性长链脂肪酸合成的关键基因SREBP-1c及其靶向基因FAS、ACC1、SCD1 mRNA相对表达量亦显著降低,细胞内TG含量和脂滴的生成减少。这些发现表明,在L02 细胞中进行FFA 处理导致脂质蓄积可能是由POP介导的,而SREBP-1c及其靶基因FAS、ACC1、SCD1 相对表达量升高是POP诱导脂肪变性的机制的重要组成部分。
总之,POP 抑制剂S17092 可改善脂质超载LO2细胞的脂质沉积,其机制可能与抑制SREBP-1c及其靶基因的表达有关。细胞中POP 表达与脂肪合成相关基因之间的密切关系可能是治疗干预NAFLD的潜在目标。然而,POP 促进肝脂肪变性的确切机制仍有待阐明。
