沙眼衣原体Ⅲ型分泌系统效应蛋白CT143保护小鼠抵抗衣原体生殖道感染①
2021-08-23杨春芬廖文彦唐双阳陆春雪南华大学附属第一医院妇产科衡阳421001
杨春芬 廖文彦 任 林 唐双阳 陈 慧 陆春雪(南华大学附属第一医院妇产科,衡阳421001)
沙眼衣原体(Chlamydiatrachomatis,Ct)是全球范围内细菌性性传播疾病的首位病因[1]。其对抗生素治疗敏感,但由于绝大多数生殖道感染患者起病隐匿,无明显自觉症状而不能进行及时有效的治疗,导致上行感染并引发盆腔炎、不孕不育等严重并发症[2]。育龄期妇女是衣原体生殖道感染的高发人群,大量医疗费用被用于衣原体感染及相关并发症的治疗,因此全社会迫切呼吁有效的抗衣原体疫苗。Ct是严格真核细胞内寄生的革兰氏阴性细菌,根据其组织嗜性不同被划分为4种生物型,包括主要感染人类眼结膜上皮细胞的沙眼生物型,引起人类泌尿生殖道上皮细胞感染的生殖道生物型,可引起全身性感染的性病淋巴肉芽肿生物型,及引起小鼠肺炎和生殖道感染的鼠生物型,即鼠衣原体(C.muridarum,Cm)[3]。由于Ct生殖道生物型感染的自然宿主为人,在小鼠体内不能导致明显的生殖道病变,而Ct鼠生物型(即Cm)阴道接种小鼠引起的上生殖道病变,如输卵管炎、输卵管积水、扩张和不孕等,与女性Ct生殖道生物型感染后的临床病理过程极为相似,因此Cm小鼠生殖道感染模型被广泛用于Ct致病机制及免疫学研究[4]。研究者已经通过Cm感染的小鼠模型证实,Th1型细胞免疫应答及细胞因子IFN-γ在抗衣原体感染过程中发挥至关重要的作用[5-6]。
本课题组前期从Ct D标准株D/UW-3/CX基因组成功扩增出Ⅲ型分泌系统(TypeⅢsecretion systems,T3S)效应蛋白CT143的全长编码基因,并在原核系统实现高效表达及纯化[7],本实验进一步采用小鼠Cm生殖道感染模型,初步评价CT143蛋白的疫苗保护性作用及相关的免疫机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 6~8周龄雌性近交系BALB/c小鼠,体重18~22 g,动物许可证号:SYXK(湘)2020-0002,购自湖南斯莱克景达实验动物有限公司,由南华大学实验动物部饲养,相关实验动物操作均符合南华大学实验动物管理委员会的伦理学规定。
1.1.2 菌株及试剂 Cm标准株Nigg由南华大学病原生物学研究保存;CT143蛋白由本研究所纯化并保存;免疫佐剂CpG购自美国Pharmingen公司;小鼠血清抗体IgG及亚类IgG1、IgG2a、IgG2b、IgG3检测试剂盒购自上海生工生物工程公司;细胞因子IFN-γ和IL-5检测试剂盒及Cy2标记的羊抗兔二抗均购自美国eBioscience公司。
1.2 方法
1.2.1 免疫小鼠 45只雌性BALB/c小鼠随机分为CT143重组蛋白免疫组、CT143+CpG免疫组及CPG佐剂对照免疫组,15只/组。小鼠经3%异氟醚轻度麻醉后,分别于第0天、第14天和第28天接受滴鼻免疫。CT143+CpG组小鼠每次免疫的CT143蛋白和CpG佐剂剂量分别为30μg和10μg,其他两组小鼠仅接受CT143蛋白或CpG佐剂免疫。
1.2.2 血清抗体检测 最后1次加强免疫后20 d,对小鼠(5只/组)实施安乐死,收集血液,分离血清,测量抗体水平。ELISA酶标板用重组CT143蛋白包被(1μg/孔),4℃吸附过夜。将血清从1∶100倍比稀释至1∶12 800,加入反应板孵育2 h、0.05%PBST洗涤3次后,以HRP标记的山羊抗小鼠总IgG为二抗,ABTS为显色剂,酶标仪测定405 nm处吸光度(OD值)。将CT143免疫组及CT143+CpG免疫组的小鼠血清分别进行1∶800倍稀释,进一步以HRP标记的山羊抗小鼠IgG1、IgG2a、IgG2b、IgG3抗体为二抗,检测IgG亚类。
1.2.3 细胞因子检测 最后1次加强免疫后20 d,对小鼠(5只/组)实施安乐死,收集脾脏,并制作单细胞悬液。用含10%胎牛血清的细胞培养基RPMI1640调整脾细胞数为5×106个/ml,1 ml/孔加入24孔细胞培养板,以不加抗原的培养基(medium)、10μg BSA或10μg CT143抗原体外刺激3 d,收集上清,按照细胞因子IFN-γ和IL-5检测试剂盒说明书,ELISA法检测405 nm处OD值,根据制备的标准曲线,计算各样本的细胞因子浓度,以ng/ml表示。
1.2.4 小鼠阴道感染及下生殖道脱落上皮的衣原体含量检测 末次免疫后25 d,每只小鼠皮下注射2.5 mg Depo-provera,同步化月经周期并增加小鼠对衣原体的易感性;5 d后,用20 ml衣原体溶液(含2×104IFUs)阴道感染小鼠。为检测小鼠下生殖道脱落上皮细胞中的衣原体含量,每隔4 d取阴道拭子接种体外培养的单层HeLa细胞,37℃孵育24 h;细胞经甲醛固定及透化处理后,以兔抗衣原体EB为一抗、Cy2标记的羊抗兔为二抗,荧光显微镜下计数衣原体包涵体形成单位(inclusion forming units,IFUs),将IFUs进行log10 IFUs对数转换后,再计算每组在每个时间点的log10 IFUs均值及标准差。
1.2.5 小鼠上生殖道的病理评估 小鼠阴道感染衣原体60 d后进行安乐死,并分离完整生殖道(含阴道、子宫颈、子宫角、输卵管及卵巢),拍照记录后立即放入10%甲醛中固定。样本经石蜡包埋处理后,以5μm/张纵向连续切片(每切3次,保留1张)5张。切片经H&E染色后,观察其组织结构及炎症细胞浸润情况。
1.3 统计学处理 采用方差分析比较各组小鼠下生殖道脱落上皮的衣原体含量,用成对样本的t检验比较组间的抗体水平及细胞因子水平,结果以±s表示。所有数据均采用SPSS13.0软件进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1 抗CT143特异性体液免疫应答 CT143+CpG免疫组血清总IgG水平在各稀释度下,均明显高于不添加佐剂的CT143免疫组,CpG佐剂对照组不产生针对CT143的特异性抗体;在1∶800倍血清稀释度下,CT143+CpG免疫组IgG2a的OD值为1.22±0.04,CT143免疫组IgG2a的OD值为0.43±0.03,两组间差异有统计学意义(P<0.01,图1)。
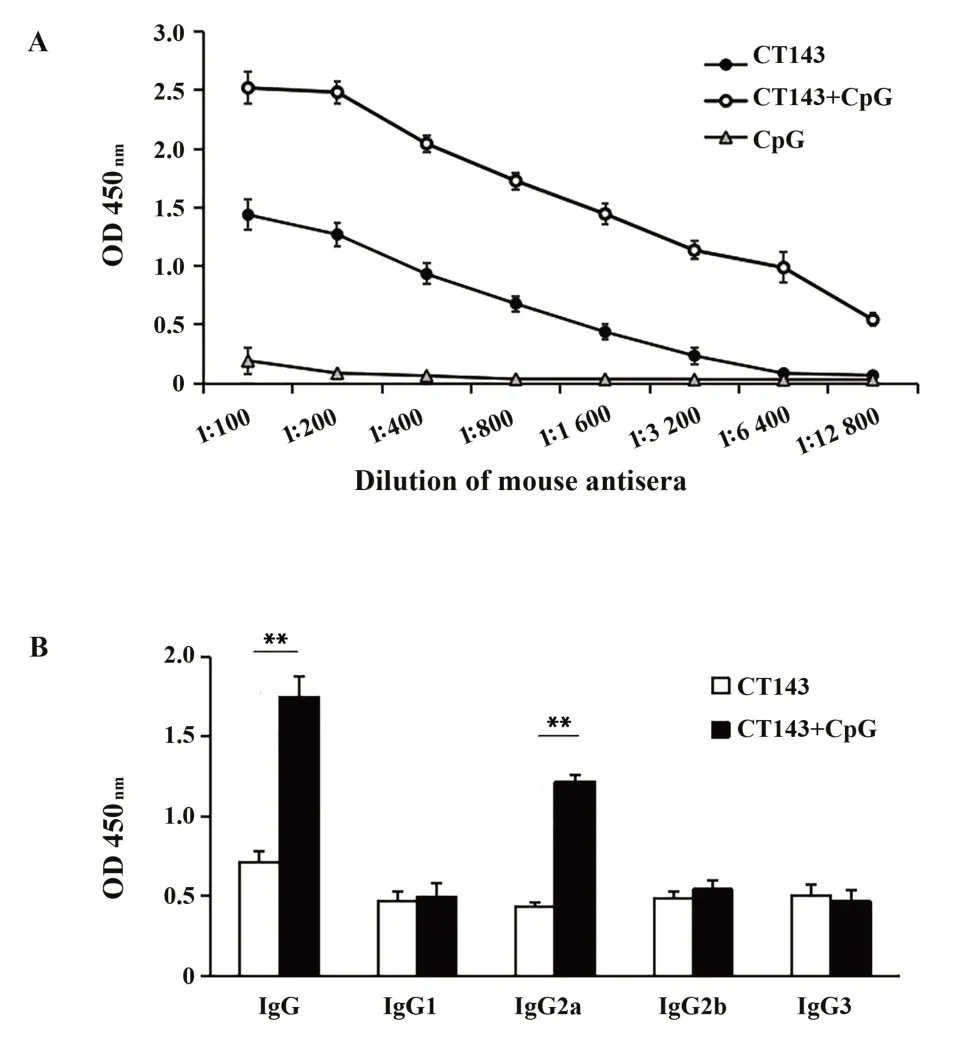
图1 免疫组小鼠血清抗CT143特异性IgG抗体滴度及亚类Fig.1 Titers and subclasses of anti-CT143 specific IgG antibody in serum of immunized group mice
2.2 CT143+CpG免疫组小鼠产生特异性Th1型细胞免疫应答 如图2所示,CT143+CpG免疫组小鼠脾细胞体外受CT143重组蛋白刺激,产生的Th1型细胞因子IFN-γ较CT143免疫组显著升高,产生的Th2型细胞因子IL-5较CT143免疫组显著降低,差异均有统计学意义(P<0.05);CpG佐剂对照组脾细胞受CT143重组蛋白刺激后,其IFN-γ和IL-5分泌水平较刺激前无明显变化。
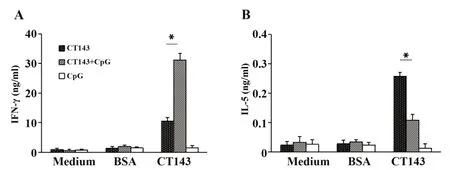
图2 各免疫组小鼠细胞因子IFN-γ和IL-5的产生Fig.2 Production of IFN-γand IL-5 in mice of each immunized group
2.3 CT143+CpG免疫组最早清除下生殖道感染的衣原体 小鼠阴道接种衣原体后,每隔4 d取阴道拭子,检测拭子脱落上皮细胞中衣原体的含量,监测下生殖感染的清除情况。感染后第4天,各组脱落细胞的衣原体含量均在1×105IFUs以上,高于阴道接种剂量,且各组间无显著差异,提示各组小鼠感染较均一、衣原体成功定植下生殖道。感染后第12、16、20天,CT143免疫组和CT143+CpG免疫组检出量较CpG佐剂对照组明显降低(P<0.05或P<0.01);感染后24 d,CT143+CpG免疫组的所有小鼠下生殖道脱落细胞均无衣原体检出,而CT143免疫组及CpG免疫组持续排菌24 d或28 d以上(图3)。
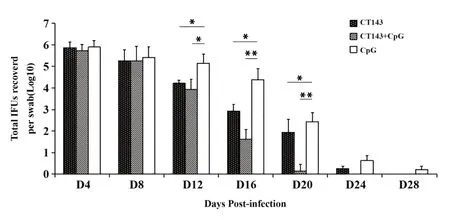
图3 各免疫组小鼠感染衣原体后下生殖道脱落上皮中的衣原体含量Fig.3 Chlamydia titres in exfoliated epithelium of lower reproductive tract of immunized mice following Chlamydia challenge
2.4 CT143+CpG免疫组小鼠上生殖道病理改变最轻 肉眼观察发现,各组小鼠阴道、子宫颈、子宫角及卵巢均无明显病变,但输卵管出现不同程度的积水。其中CT143免疫组和CT143+CpG免疫组积水主要见于单侧,且积水程度明显低于CpG佐剂对照组。病变的输卵管组织经HE染色镜检发现,CpG佐剂对照组管壁增厚,黏膜皱襞减少,顶部纤毛消失,伴有纤维组织增生及炎症细胞浸润;CT143+CpG免疫组小鼠输卵管结构较清晰,管腔稍有水肿,但炎症细胞浸润少,且皱襞及纤毛结构完整;CT143免疫组的病理程度介于其他两组之间(图4)。

图4 各免疫组小鼠感染衣原体后的上生殖道病理改变Fig.4 Pathological changes of upper reproductive tract of immunized mice following Chlamydia challenge
3 讨论
Ct生殖道感染严重影响我国优生优育政策推行。Ct感染的临床症状不典型,因此疫苗接种被认为是最理想的预防措施。然而到目前为止,仍无有效疫苗问世[8]。Ct全菌免疫可在一定程度上阻断衣原体感染,但部分全菌接种患者在随后的感染中,出现了更严重的免疫病理反应,提示全菌疫苗包含致敏成分[9]。目前,Ct疫苗研究主要集中于亚单位疫苗,Ct主要外膜蛋白、包涵体膜蛋白IncA、Ct蛋白酶样活性因子等亚单位疫苗免疫均能提供部分保护作用[10-12]。衣原体以原体形式感染,在宿主细胞包涵体内转变为始体,以始体形式增殖,最后转变为原体释放,感染更多细胞。由于衣原体感染周期复杂,单一亚单位疫苗难以发挥全面保护作用,制备Ct联合亚单位疫苗以期从黏附、定植、增殖、释放等环节全面阻断衣原体感染是疫苗研究的重要方向,寻找更多Ct疫苗候选抗原是衣原体研究的长期目标。
在与宿主细胞的相互作用过程中,许多革兰阴性细菌依靠T3S将效应蛋白输送到真核宿主细胞。Ct在其整个发育周期中,也通过T3S实现效应蛋白的跨包涵体膜及跨宿主细胞膜运输。有些效应蛋白,如TarP、CT694和TepP存在于Ct原体,在衣原体感染早期阶段被输送到宿主细胞,通过调节宿主机动蛋白骨架和破坏免疫信号转导,促进衣原体侵入宿主细胞;有些效应蛋白在Ct胞内感染阶段产生,而后被输送并嵌入包涵体膜(Inc),干扰宿主细胞的细胞骨架动力学、囊泡和非囊泡运输及死亡信号等;还有一类效应蛋白被输送至包涵体腔或宿主细胞浆,与衣原体的能量代谢、细胞蛋白泛素化和组蛋白甲基化等密切相关[13]。已有研究证实,Ct的T3S效应蛋白IncA和Tarp为有效的疫苗候选抗原[11,14]。
大量研究证实,Th1型细胞免疫应答及IFN-γ细胞因子在抗衣原体感染过程中发挥重要作用[5-6]。2008年,KARUNAKARAN等[15]采用蛋白质组学技术,从Cm感染的DC细胞成功筛选出8个T细胞抗原,其中包含TC0420(Ct143蛋白在Cm的同源物),提示CT143免疫可能激发Th1型细胞免疫应答;2010年,WANG等[16]采用Ct全基因组编码的抗原与99例女性生殖道Ct感染患者的血清反应,发现CT143蛋白能被50%以上的患者血清优势识别,进一步提示CT143具有良好的免疫活性。2017年,CUNHA等[17]研究发现,CT143是Ct T3S的效应蛋白,定位于包涵体腔,但其具体功能及是否有保护作用尚未见报道。
本研究采用原核表达并纯化的CT143重组蛋白,联合Th1型细胞免疫佐剂CpG经滴鼻途径免疫BALB/c小鼠,小鼠生殖道Cm感染模型评估CT143的对衣原体感染的保护性作用。研究发现,CT143+CpG免疫能诱导小鼠产生高滴度的特异性IgG抗体,尤其是IgG2a亚类的抗体产量显著高于CT143免疫组及CpG佐剂对照组。有文献报道IgG2a不仅有体外抗衣原体作用,且体液免疫应答所产生的IgG亚类中,IgG2a血清含量高于IgG1常提示机体存在Th1型细胞免疫应答[18];CT143+CpG免疫组小鼠脾细胞体外受CT143蛋白刺激,产生的IFN-γ(Th1型)细胞因子水平显著高于CT143不加佐剂组,而IL-5(Th2型)细胞因子水平显著低于CT143不加佐剂组,进一步说明CT143联合佐剂CpG免疫能诱导机体产生强烈的Th1型细胞免疫应答,该免疫应答保护小鼠快速清除下生殖道定植的衣原体。CT143免疫组小鼠感染Cm后12 d,阴道排菌量即与对照组出现统计学差异,且排菌时间明显缩短。此外,CT143免疫还能显著降低Cm导致的上生殖道病变,表现为输卵管水肿减轻,炎症细胞浸润减少等,尤其是CT143联合佐剂免疫组,输卵管结构清晰,管壁皱襞且纤毛结构完整。
综上所述,本研究采用Ct T3S效应蛋白CT143联合佐剂CpG滴鼻免疫小鼠,成功诱导小鼠产生Th1型细胞免疫应答。该免疫应答能有效保护小鼠抵抗Cm的生殖道感染,免疫组小鼠下生殖道排菌量明显降低,排菌周期缩短,上生殖道免疫病理减轻。本实验结果为深入探讨CT143蛋白的疫苗保护作用及衣原体联合亚单位疫苗的研制提供了重要参考。
