新辅助化疗对不同分子亚型局部晚期乳腺癌的疗效及预后分析
2021-08-18武佳邢壹李佳鹂赵贺宇胡大为张宏旭
武佳,邢壹,李佳鹂,赵贺宇,胡大为,张宏旭
(河北省承德市承德医学院附属医院乳腺外科,河北 承德 067000)
0 引言
乳腺癌是全球女性恶性肿瘤相关性死亡的最主要病因,其发病率也在逐年上升,目前位于女性恶性肿瘤发病率的首位[1]。尽管随着人们对乳腺癌认知程度的加深及检查手段的进步使得早期乳腺癌的检出率较前提高,但我国仍有6%~7%的乳腺癌患者确诊时即为局部晚期乳腺癌(local advanced breast cancer,LABC)[2]。
新辅助化疗(neoadjuvant chemotherapy,NACT)在对于治疗LABC方面,具有能够缩小肿瘤体积,降低乳腺癌临床分期特点。同时由于不同分子亚型乳腺癌对化疗敏感性各不相同,新辅助化疗还可为术后化疗提供指导依据[3]。但另一方面,新辅助化疗后再行手术治疗可能会延误治疗时机导致肿瘤扩散转移进而影响患者的预后。
本研究旨在通过对我院102例局部晚期乳腺癌患者进行随访及临床病理资料分析,研究不同分子亚型LABC的疗效及预后情况,分析其相关影响因素,为临床提供新的研究方向。
1 资料与方法
1.1 一般资料
收集2016年1月至 2020年6月承德医学院附属乳腺外科收治的接受新辅助化疗的临床分期为IIa-IIIc期的乳腺癌患者共102例作为研究对象。所有患者术前均接受病理学检查检确诊乳腺癌,同时接受以蒽环类和紫衫类化疗药物为基础的治疗方案,且治疗前经系统检查除外有远处转移、既往肿瘤史或诊断为男性乳腺癌、炎性乳腺癌的患者。对于观察组患者每两次治疗行b超或MRI检查评估疗效。
1.2 治疗方案
所有患者均接受蒽环联合或序贯紫杉类药物的化疗方案,包括TEC、EC-TH、TE、TA,每21天为1个化疗周期。HER-2阳性的患者由于经济状况和其他因素仅9例获得曲妥珠单抗治疗。化疗期间常规予以抗过敏、止吐、保肝治疗,同时给予重组人粒细胞集落刺激因子预防白细胞缺乏,全程监测血常规及肝、肾功能。
1.3 免疫组化的判定和乳腺癌分子亚型的分类
ER及PR阳性定义[4]为≥1%的肿瘤细胞核染色阳性;Ki-67高表达定义为≥14%的肿瘤细胞核染色阳性,Ki-67低表达定义为<14%的肿瘤细胞核染色阳性;通过荧光原位杂 交(Fluorescence in situ hybridization,FISH)评 估HER-2状态,HER-2阳性定义为HER-2 +++、HER-2 ++同时FISH检测提示扩增。依据2013年圣加伦共识[5]将乳腺癌分子亚型分为:(1)Luminal A型(ER和[或]PR阳性,HER2阴性,Ki-67<15%);(2)Luminal B/HER-2(+)型(ER和[或]PR阳性,HER2阳性,Ki-67无限制);(3)Luminal B/HER-2(-)型(ER和[或PR 阳性,HER2阴性,Ki-67≥15%);(4)HER-2过表达型(ER和PR阴性,HER2阳性,Ki-67无限制);(5)三阴性(ER阴性,PR阴性,HER2阴性,Ki-67无限制)。
1.4 疗效判定标准
临床疗效评估依据实体瘤疗效评价标准[6]分为完全缓解(Complete response,CR),患侧乳房无可触及的肿块同时腋窝未触及肿大淋巴结;部分缓解(Partial response,PR),肿瘤最大径之和缩小≥30%但未达到CR;疾病进展(Progressive disease,PD),肿瘤最大径之和增大≥20%,或化疗后患侧乳房其他部位出现新病灶,或化疗前腋窝未触及肿大淋巴结而化疗后腋窝可触及淋巴结肿大;疾病稳定(Stable disease,SD),肿瘤最大径之和有缩小但未达PR或有增大但未达PD。总有效率(Objective response rate,OPP)为CR+PR。病理疗效评估采用Miller-Payne组织学分级[7]系统进行疗效评价并分为部分缓解组(G1-G4)与完全缓解组(G5)。本研究中病理完全缓解(pCR)定义为乳房和腋窝淋巴结手术切除标本中均未见浸润性癌细胞残留。
1.5 不良反应及术后远期并发症
化疗不良反应包括:(1)血液系统毒副反应;(2)非血液系统的毒副反应,包括心脏毒性、胃肠道反应、肝肾功能损害。同时依照抗癌药物毒副反应分度标准[8],将其分为0~IV度。术后远期并发症主要为术后上肢水肿及活动受限。
1.6 随访情况
总生存时间(overall survival,OS)定义为从首次确诊起到任何原因引起死亡的时间。无病生存时间(disease free survival,DFS)是指从首次确诊起到任何部位发生复发转移或任何原因导致死亡的时间。随访方式采用门诊随访结合电话随访,随访时间为手术后每3个月随访1次。
1.7 统计学方法
采用SPSS 26.0软件分析数据,计量资料用独立样本t检验;计数资料比较使用卡方检验或Fisher精确概率法。生存分析选用Kaplan-Meier生存函数表示,并用Log-rank进行检验;对影响生存的多因素采用 COX 回归模型。均为双侧检验,P<0.05有统计学意义。
2 结果
2.1 新辅助化疗临床疗效分析
临床总有效率为79.4%,其中Luminal A型有效率为76.9%;Luminal B/Her-2(-)型 有 效 率 为80.8%;Luminal B/Her-2(+)型有效率为78.3%;HER-2过表达型有效率为84.2%;三阴性76.2%,五组间比较差异无明显统计学意义(P>0.05)。见表1。
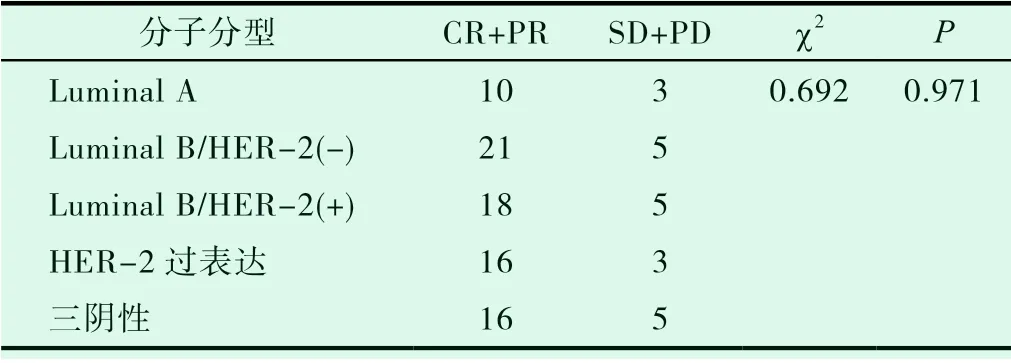
表1 不同分子亚型新辅助化疗后临床疗效比较(例)
2.2 新辅助化疗病理疗效分析
102 例局部晚期乳腺癌患者新辅助化疗后能够达到病理完全缓解者共24例(23.5%)。单因素分析显示:pCR与乳腺癌患者确诊时的年龄、绝经情况、BMI均无相关性(P>0.05),见表2。
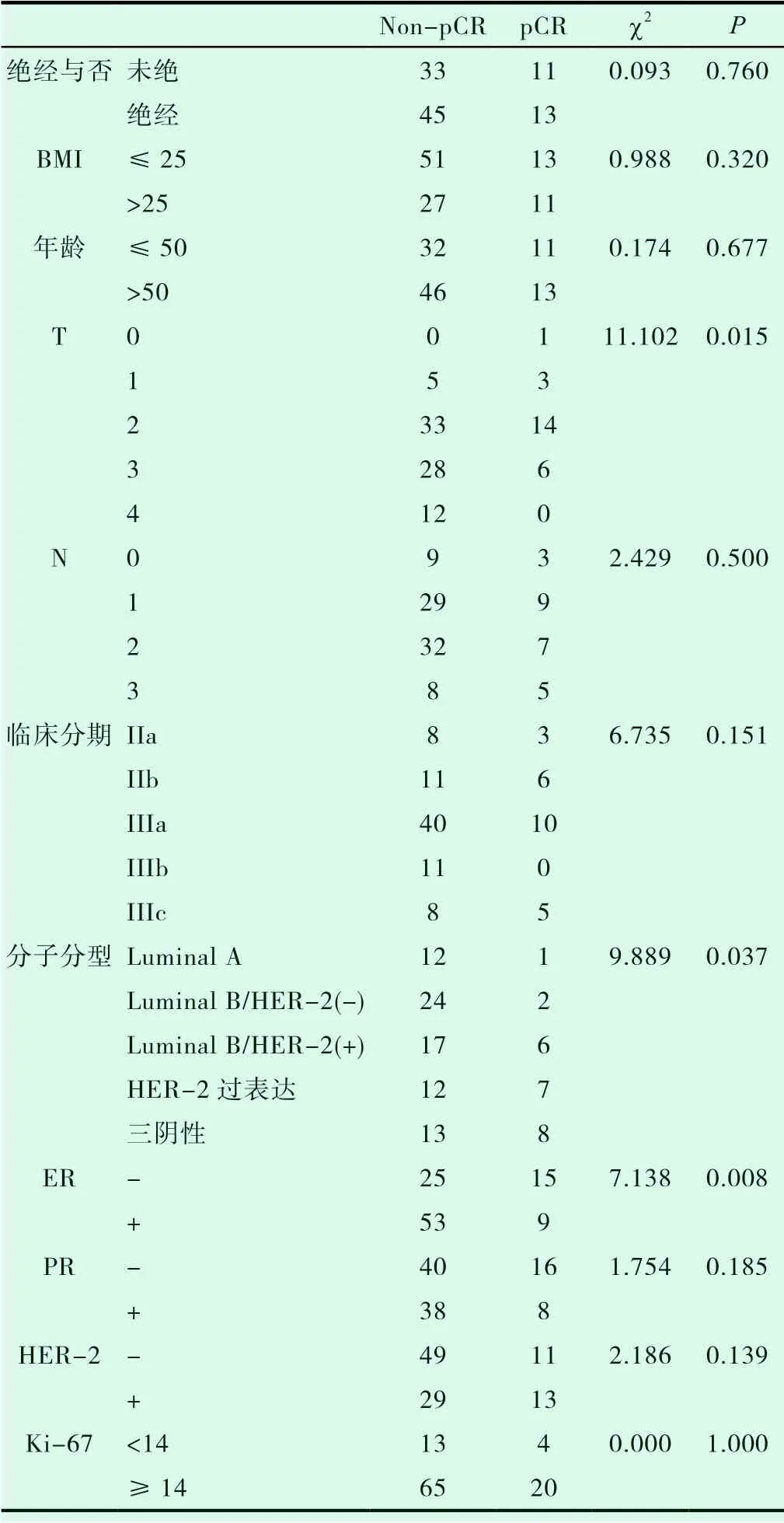
表2 新辅助化疗病理疗效比较(例)
依据肿瘤大小分组,组间的pCR率差异有统计学意义(P<0.05)。依据淋巴结转移情况分组,组间病理完全缓解率差异无统计学意义(P>0.05)。根据TNM分期分组,组间病理完全缓解率差异无统计学意义(P>0.05)。按照ER、PR、HER-2是否表达及Ki-67表达水平分组,其中PR、HER-2是否表达的组间病理完全缓解率差异无统计学意义(P>0.05),ER是否表达组间pCR率差异有统计学意义(P<0.05),Ki-67表达水平≥15%和<15%的组间病理完全缓解率差异无统计学意义(P>0.05)。依据分子分型进行分组,组间pCR率差异有统计学意义(P<0.05),见表2。
2.3 新辅助化疗影响预后因素分析
依据分子分型、肿瘤大小、淋巴结转移情况及ER、PR、HER-2、Ki-67表达情况分组,组间无病生存率、总生存率差异均差异无统计学意义(P>0.05),无统计学意义。依据患者是否达pCR分组,组间无病生存率存在差异性(P<0.05),有统计学意义,而组间总生存率则未见明显差异性(P>0.05),无统计学意义。依据临床疗效分组,组间无病生存率、总生存率差异均有显著性差异(P<0.05),有统计学意义,见表3。
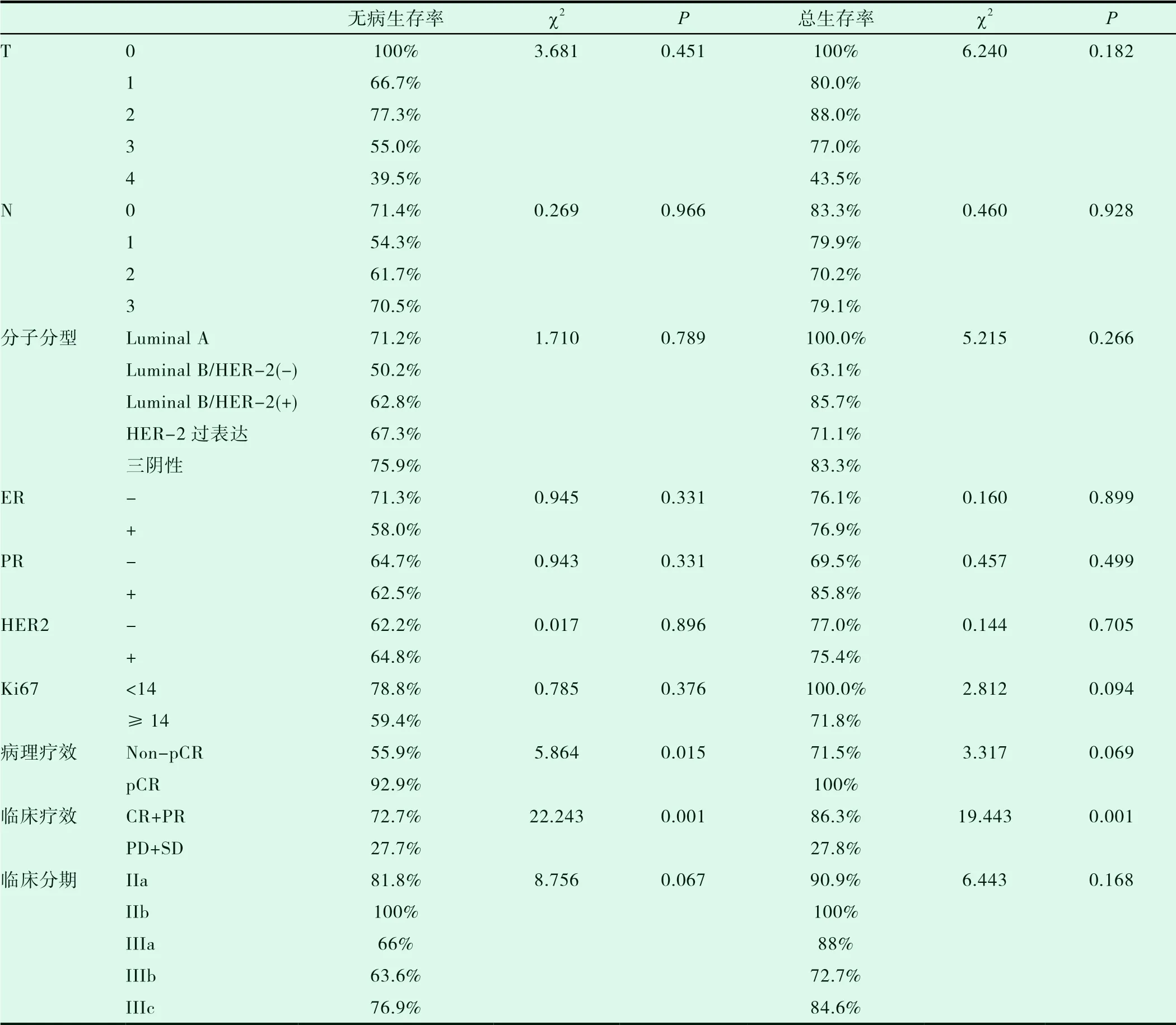
表3 新辅助化疗预后比较
2.4 生存分析
新辅助化疗患者随访时间为6~61月,中位随访时间为21月,其中Luminal A型、Luminal B/HER-2(-)型、Luminal B/HER-2(+)型、HER-2过表达型、三阴性乳腺癌患者的组间1年、3年的DFS、OS率无明显统计学差异(P>0.05),详见表4,图1。新辅助化疗中获得pCR的患者,其1年、3年DFS率为100%、93%,优于病理未缓解组(80%、56%),差异有统计学意义(P<0.05),见表5,图2。
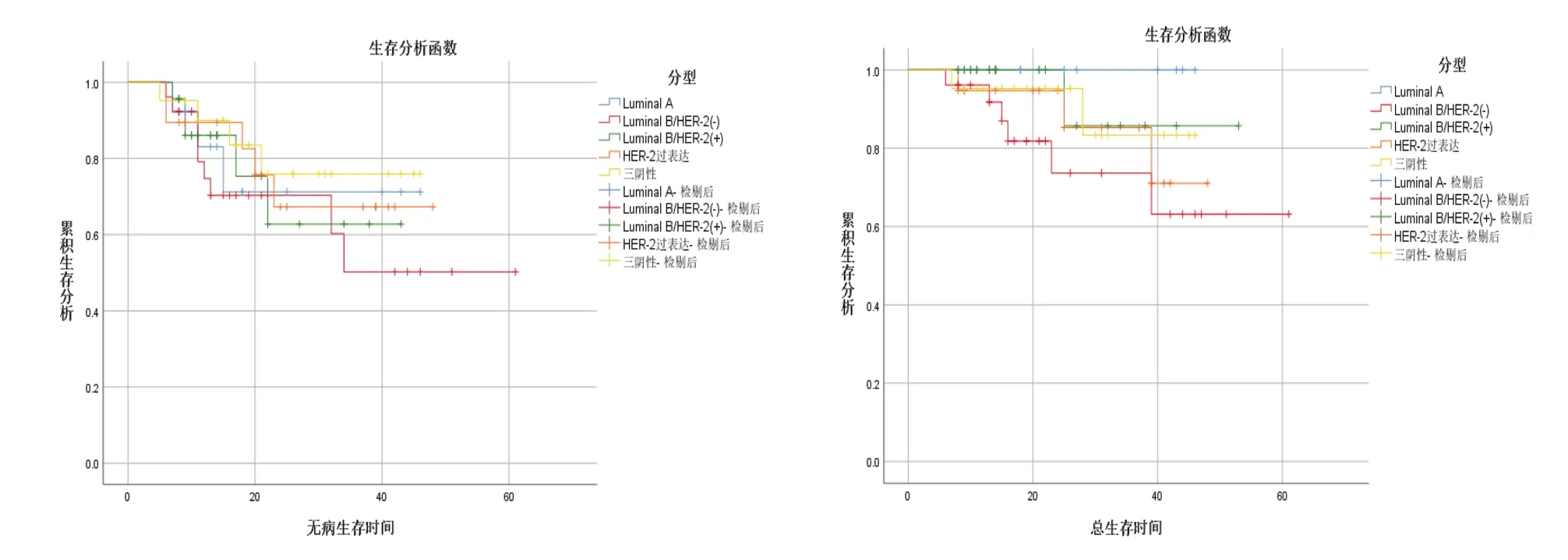
图1 新辅助化疗不同分子亚型生存曲线图
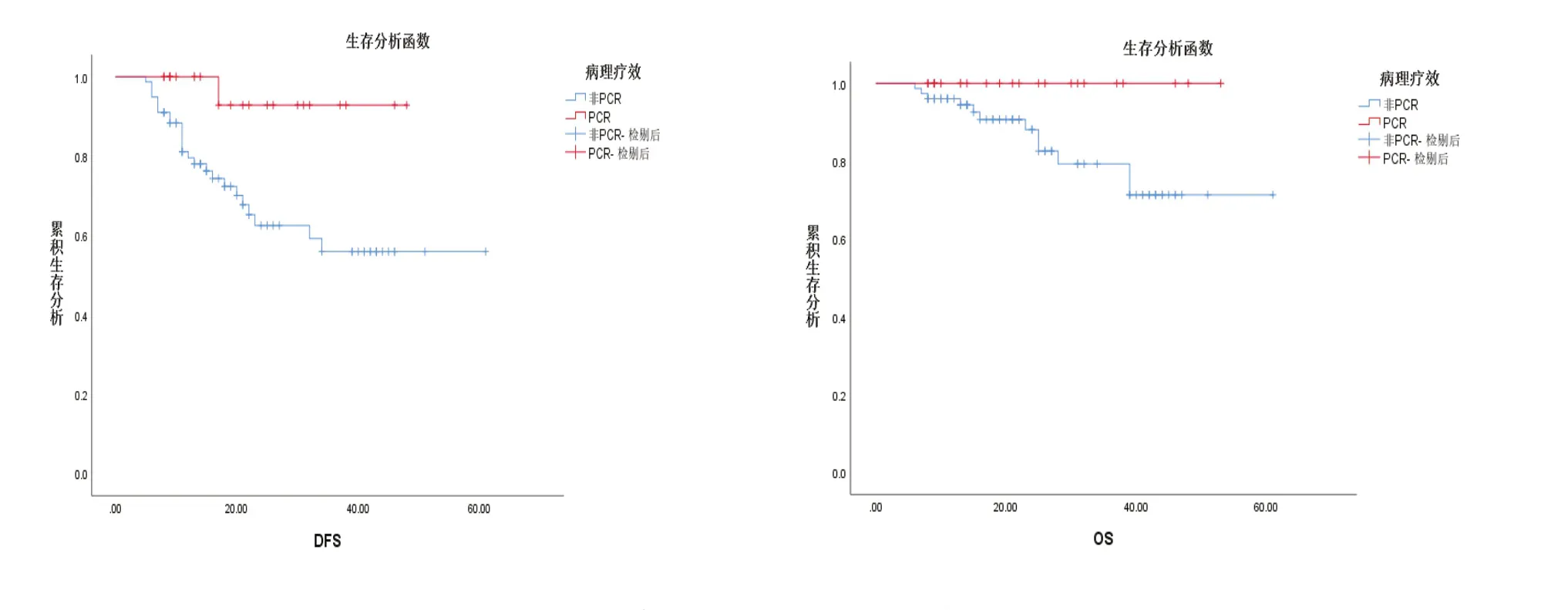
图2 新辅助化疗病理完全缓解率生存曲线图

表4 新辅助化疗不同分子亚型乳腺癌患者预后情况分析

表5 新辅助化疗后达到pCR对预后情况分析
3 讨论
局部晚期乳腺癌一方面由于其远处转移的可能性高,同时也存在着治疗后肿瘤完整切除的可能性,是早期乳腺癌到不可治愈乳腺癌的过渡阶段。对于局部晚期乳腺癌的治疗,目前指南推荐新辅助化疗作为标准的治疗方式,但新辅助化疗后哪些指标可以用于预测患者的生存情况仍未有统一的标准。
对于新辅助化疗而言,研究数据[9]显示,其总有效率可高达60%~90%,且约3%~30%的患者可达到病理完全缓解。本研究中新辅助化疗的总有效率为79.4%,pCR率为23.5%,与上述结果一致,说明新辅助化疗可以缩小原发病灶,以便对临床分期较晚的局部晚期乳腺癌患者实施手术治疗,进而改善预后。本研究通过对临床疗效进行组间OS、DFS分析,认为新辅助化疗敏感的患者能在DFS和OS上获益,差异有统计学意义,且对各分子亚型进行临床疗效亚组分析时认为组间比较并差异无统计学意义。因此对于新辅助化疗评估疗效时判定为不敏感的病例来说,无论哪种分子亚型均不建议为追求疗效增加化疗周期,以免延误时机。
随着NSABP B-18[10]、B-27[11]的研究结果证实NACT后pCR与DFS、OS呈正相关,认为NACT后能否达到pCR对预后具有重要意义,pCR已成为大多数的研究中用于评估预后的预测指标[11-12]。本研究中获得pCR的患者3年无病生存率和总生存率分别为93%和100%,而未获得pCR者仅为56%和80%,证实新辅助化疗的疗效达到pCR的患者能在DFS和OS上获益,但仅在DFS上差异有统计学意义,这可能与本研究随访时间较短有关,也许进一步增长随访时间后,能得到更加明确的结论。
Haque W等[13]的最新研究中表明,通过汇总来自美国国家癌症数据库中新辅助化疗的乳腺癌患者的临床病理资料,发现新辅助化疗对治疗不同分子亚型LABC的疗效并不相同,认为仅部分新辅助化疗疗效达pCR的患者其OS和DFS明显高于未达pCR者,说明pCR并不能成为乳腺癌患者替代预后的唯一预测指标。本研究中Luminal A型患者的pCR为7.7%,Luminal B/HER-2(-)型患者pCR为7.7%,Luminal B/HER-2(+)型患者pCR为26.1%,与TECHNO研究结果[14]一致。HER-2过表达型乳腺癌、三阴性乳腺癌与Luminal 型乳腺癌相比,二者新辅助化疗的pCR率远大于Luminal 型乳腺癌,pCR率分别是36.8% 、38.1%,差异具有统计学意义,这与Huober等在 Gepar Trio研究[15]中观察结果一致。由于病人的依从性问题以及地方经济原因,本研究观察组43例HER-2阳性患者仅9例接受了含曲妥珠单抗的EC-TH方案,其中5例获得pCR,pCR率为55.56%,说明曲妥珠单抗可以显著提高HER-2阳性患者的pCR率。以分子亚型为亚组,本研究还对组间进行3年总生存率和无病生存率的比较,未发现明显差异性,认为新辅助化疗可以使预后较差的HER-2过表达型和三阴性患者在预后上达到与Luminal型相同的效果,这与汪令成等[9]研究类似。因此对于HER-2过表达型及三阴性乳腺癌患者而言,新辅助化疗后达到pCR的患者其生存前景较好,而对于Luminal型乳腺癌患者,则需要期待未来有更好的预测指标对预后进行更准确的预测。
临床上对于免疫组化结果能否作为新辅助化疗疗效的预测指标尚未达成统一意见,但是诸多临床试验研究[16-17]表明ER阴性、PR阴性的患者在新辅助化疗中获益明显多于阳性患者,本研究中仅发现ER阴性患者新辅助化疗达到pCR率更高,可能与本研究样本量不够大、随访时间较短有关。同时本研究还对肿瘤大小进行疗效分析,认为肿瘤越小,新辅助化疗后局部晚期乳腺癌患者获得pCR率越高。
综上所述,新辅助化疗在局部晚期乳腺癌患者中的应用日趋广泛,大量研究表明新辅助化疗应用于LABC时疗效受不同分子亚型、肿瘤大小、ER状态等多种临床病理因素的影响,因此新辅助化疗的研究方向应从如何使局部晚期乳腺癌患者在疗效上获得更高的pCR率从而取得预期的生存目标,转变为依据乳腺癌的生物特性,制定出不同的新辅助化疗方案及其对应的最佳评估预后的预测指标,从而满足临床对疗效评价的精准、个体化要求,进而提高患者的预后。
